Kamerstuk
| Datum publicatie | Organisatie | Vergaderjaar | Dossier- en ondernummer |
|---|---|---|---|
| Tweede Kamer der Staten-Generaal | 2020-2021 | 29477 nr. 696 |
Zoals vergunningen, bouwplannen en lokale regelgeving.
Adressen en contactpersonen van overheidsorganisaties.
U bent hier:

| Datum publicatie | Organisatie | Vergaderjaar | Dossier- en ondernummer |
|---|---|---|---|
| Tweede Kamer der Staten-Generaal | 2020-2021 | 29477 nr. 696 |
Aan de Voorzitter van de Tweede Kamer der Staten-Generaal
Den Haag, 12 februari 2021
Medicijnen kunnen mensen een betere kwaliteit van leven geven, de mogelijkheid bieden te participeren in de maatschappij, pijn verlichten of klachten verhelpen en in sommige gevallen ziektes voorkomen of patiënten helemaal genezen. Er komen steeds meer en betere geneesmiddelen op de markt en dat is goed nieuws. Tegelijkertijd stelt dit ons voor belangrijke uitdagingen op het terrein van de betaalbaarheid, beschikbaarheid en kwaliteit van zorg. Sinds 2016 hebben mijn voorgangers en ik hierop een groot aantal acties ingezet die volgen uit de Geneesmiddelenvisie en het Regeerakkoord (Bijlage bij Kamerstuk 34 700, nr. 34). In deze brief schets ik de resultaten en een aantal inzichten die de aanpak van de afgelopen jaren opgeleverd hebben. In de navolgende thematische delen zoom ik uitgebreid in op ontwikkelingen in het geneesmiddelenbeleid.
Het kabinet heeft sinds 2016 verscheidene resultaten geboekt in de uitvoering van de geneesmiddelenvisie. We hebben bijvoorbeeld de geneesmiddelprijzen gematigd met onderhandelingen en financiële arrangementen voor dure geneesmiddelen en met een aanscherping van de Wet Geneesmiddelenprijzen (Kamerstuk 35 137). Daarnaast zorgt de nieuwe regeling voor voorwaardelijke toelating van weesgeneesmiddelen, conditionals en exceptionals ervoor dat dit type geneesmiddelen waarvan de effectiviteit nog onvoldoende zeker is, beter in het basispakket toegankelijk zijn. Wat betreft de beschikbaarheid van geneesmiddelen is er een goed werkend meldsysteem ingericht voor tekorten, hebben we de basis gelegd voor ijzeren voorraden en hebben we tijdens de Covid-19-crisis tekorten aan geneesmiddelen kunnen voorkomen. De kwaliteit van farmaceutische zorg is verder verbeterd door onder meer goede informatievoorziening over geneesmiddelgebruik zoals opioïden en de actualisatie van richtlijnen. Dat deden we samen met heel veel betrokken partijen zoals zorginstellingen, artsen, apothekers, zorgverzekeraars, geneesmiddelenproducenten en patiënten.
In de komende jaren zullen we steeds meer de effecten merken van de ontwikkelingen die zijn ingezet. Tegelijkertijd weten we dat voortdurende aandacht nodig is. En dat is niet verwonderlijk gezien de complexiteit van het geneesmiddelendomein. In de ex durante evaluatie van de geneesmiddelenvisie1 werd al geconcludeerd dat het laaghangende fruit is geplukt als het gaat om de verbetering van de kwaliteit en betaalbaarheid van de farmaceutische zorg. Ik onderschrijf die conclusie. Verdere structurele verbeteringen vragen om innovaties in de structuur van de geneesmiddelen(ontwikkel)keten. Die vergen meer tijd en uitwerking en in vele gevallen Europese samenwerking.
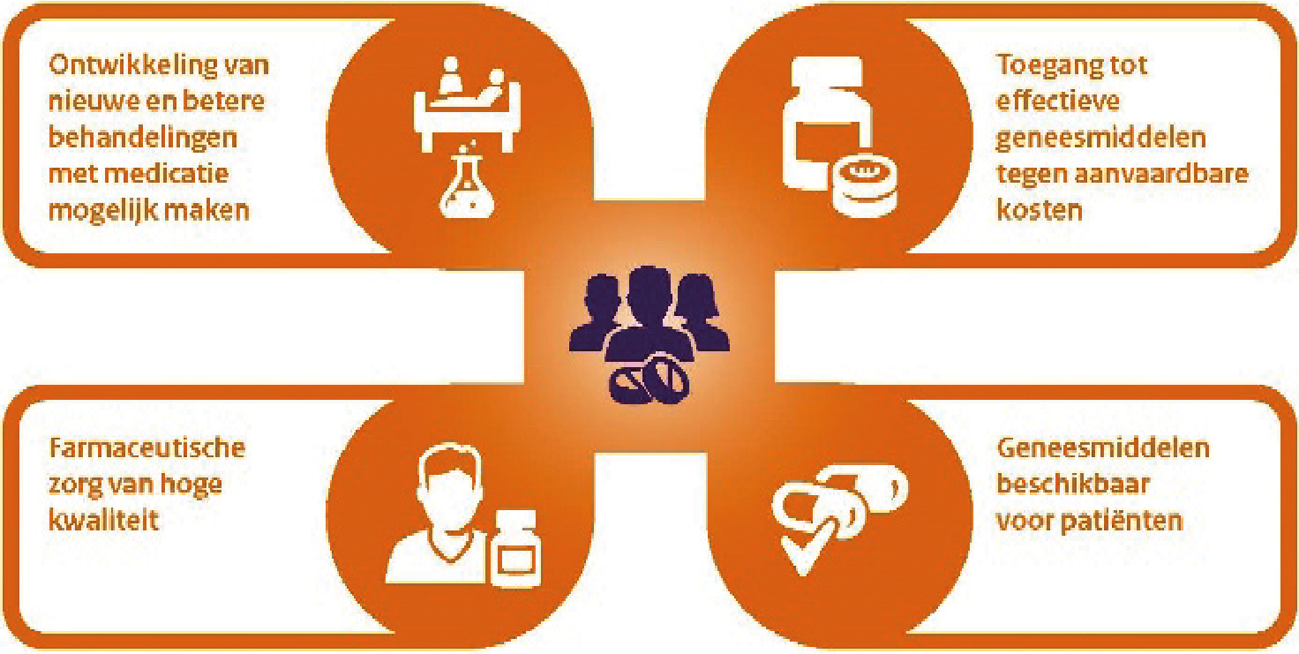
Ik heb u in eerdere brieven regelmatig geïnformeerd over de uitvoering van de maatregelen uit de geneesmiddelenvisie en het regeerakkoord. In deze brief sta ik kort stil bij de vier thema’s die de hoekstenen van het geneesmiddelenbeleid vormen:
– Ontwikkeling van nieuwe en betere behandelingen met medicatie mogelijk maken
– Toegang tot effectieve geneesmiddelen tegen aanvaardbare kosten
– Geneesmiddelen beschikbaar voor patiënten
– Farmaceutische zorg van hoge kwaliteit
Ontwikkeling van nieuwe en betere behandelingen met medicatie mogelijk maken
Nederland is een klein land zonder hoofdvestigingen van de grote farmaceutische industrie. De meeste innovatieve geneesmiddelen die we in Nederland gebruiken komen uit buitenlandse laboratoria. We moeten hier realistisch over zijn. Toch heeft Nederland iets bijzonders te bieden: een sterke kennisinfrastructuur, veel start- en scale-up bedrijven (met name in de biotechnologie) in een bloeiende topsector Life Sciences & Health (LSH) en sinds kort ook de aanwezigheid van het Europees Medicijn Agentschap (EMA).
In de afgelopen kabinetsperiode is er veel in gang gezet. Na een succesvolle Nederlandse lobby is de vestiging van het EMA in Amsterdam een feit. Dit vergroot de aantrekkelijkheid van Nederland als vestigingsland. Verder wordt geneesmiddelenontwikkeling gestimuleerd via bijvoorbeeld publieke private samenwerkingen onder de vlag van de topsector LSH, zoals Oncode Institute en RegMed XB2. Samen met andere ministeries zetten we in op de optimalisatie van wet- en regelgeving, zodat deze innovatie zo goed mogelijk stimuleert. Zoals de inzet van het kabinet om de uitvoering van de wetgeving op het terrein van genetisch gemodificeerde organismes minder belemmerend te laten zijn voor biotechnologisch onderzoek en door de doorlooptijden voor milieuvergunningen te verkorten3. Nederland staat steeds beter op de kaart als investeringsland, ook door succesvolle missies zoals die naar Boston in 2019. Bovendien hebben we veel bereikt door netwerkvorming en bundeling van expertise, bijvoorbeeld in het Topteam Life Science and Health. Tegelijkertijd is het ook van belang afspraken te maken over de juiste randvoorwaarden bij de inzet van publieke middelen. Zo is er op het terrein van maatschappelijk verantwoord licentiëren een belangrijke stap gezet met de toolkit.
Maar er ligt mijns inziens in Nederland nog meer onontgonnen terrein voor de ontwikkeling van geneesmiddelen met een hoog maatschappelijk rendement. Bijvoorbeeld voor geheel nieuwe geneesmiddelen (zoals gentherapiën), maar ook voor nieuwe toepassingen van bestaande geneesmiddelen, ook wanneer ze voor private investeerders minder lucratief zijn (zoals bij antibiotica). In de afgelopen jaren zijn al mooie stappen gezet, maar er zit meer in. Daarvoor is meer kennis, regie en bundeling van publieke én private financiering nodig, in nauwe samenwerking tussen overheid, kennisinstellingen en bedrijven. Dat creëert vervolgens ook meer ruimte om belangrijke randvoorwaarden te stellen op het gebied van transparantie en maatschappelijk aanvaardbare prijzen. Met als uitgangspunt om marktfalen te corrigeren, zonder dat de investeringsrisico’s onverantwoord groot zijn. Dit zijn ook de elementen van het initiatief Future Affordable & Sustainable Therapies (FAST) waar de afgelopen twee jaar aan gewerkt is en waarvan het rapport aan uw kamer is aangeboden en nog een inhoudelijke reactie is toegezegd (Bijlage bij Kamerstuk 29 477, nr. 649). Het lopende onderzoek naar het financiële ecosysteem van geneesmiddelenonderzoek zal ons op dit terrein ook waardevolle inzichten verschaffen.
Toegang tot effectieve geneesmiddelen tegen aanvaardbare kosten
We streven er naar dat Nederlandse patiënten tijdig toegang krijgen tot (innovatieve) effectieve geneesmiddelen tegen aanvaardbare kosten. Daar hebben we mooie resultaten neergezet. Maandelijks wordt het basispakket uitgebreid met nieuwe effectieve geneesmiddelen. Het gaat hier zowel om intramurale- als extramurale geneesmiddelen. Zo zijn bijvoorbeeld «Arikayce» en «Baqsimi» op respectievelijk 1 februari en 1 januari 2021 aan het basispakket toegevoegd. Met nieuw beleid omtrent de voorwaardelijke toelating hebben we de toegang voor patiënten tot onder andere weesgeneesmiddelen verbeterd. Hiervoor heb ik een budget van structureel oplopend tot € 36,8 miljoen per jaar beschikbaar. Op dit moment is er één geneesmiddel voorwaardelijk toegelaten en zitten er twee potentiële kandidaten in het proces. Het CBG en het Zorginstituut Nederland (hierna: ZINL) voeren een pilot uit om de procedures van markttoelating en vergoeding meer parallel te laten verlopen zodat geneesmiddelen eerder bij de patiënt komen. De eerste twee geneesmiddelen hebben dit proces succesvol doorlopen en zijn hierdoor eerder beschikbaar gekomen voor patiënten. Twee andere geneesmiddelen doorlopen op dit moment de parallelle procedure.
Om de kosten nu en in de toekomst betaalbaar te houden zetten we verschillende instrumenten in. Zo zijn de criteria voor de «pakketsluis» wettelijk verankerd. Voor de dure geneesmiddelen zijn financiële arrangementen afgesloten waardoor de uitgaven in 5 jaar met ruim een miljard zijn verlaagd ten opzichte van hetgeen de farmaceutische industrie vroeg.4 Door internationale samenwerking, onder meer in Beneluxa-verband, hebben we onze onderhandelingspositie versterkt en de horizon scanning verbeterd. Met een wijziging van de Wet geneesmiddelenprijzen zijn de prijzen voor met name specialistische geneesmiddelen in Nederland meer in lijn gebracht met het Europese gemiddelde en om (de hoogte van) de vergoedingen te moderniseren wordt nu het fundament gelegd voor een verbeterd Geneesmiddelen Vergoedingen Systeem. Zorgaanbieders en zorgverzekeraars dragen met inkoop en doelmatig gebruik in belangrijke mate bij aan het beheersen van de uitgaven aan geneesmiddelen. Via het integraal pakket aan maatregelen (IPAM) stimuleren en faciliteren we hen om nog scherper in te kopen en meer te sturen op gepaste zorg.
We zijn er echter nog niet. Er zijn twee categorieën geneesmiddelen die in toenemende mate onze aandacht blijven vragen. Ten eerste is er de zogeheten onderkant van de markt. Het gaat hier bijvoorbeeld over geneesmiddelen met lage prijzen in combinatie met relatief lage volumes. Ik wil voor dit deel van het speelveld een beter beeld krijgen van de effecten van de dynamiek in het speelveld, overheidsinstrumenten en de rol van verschillende partijen in de geneesmiddelenketen. Is er bijvoorbeeld sprake van een risico op een verschraling van het aanbod van beschikbare medicijnen en leidt dit mogelijk zelfs tot nieuwe beschikbaarheidsproblemen, zoals sommige veldpartijen aangeven? Ik laat daarom onderzoek doen om meer zicht te krijgen op dit segment om zo eventuele risico’s tijdig te kunnen aanpakken. Daarnaast blijf ik binnen de Wgp dit jaar de meer kwetsbare geneesmiddelen met een relatief lage omzet op verzoek ontzien van verdere prijsdalingen.
Ten tweede, de dure innovatieve geneesmiddelen. Het beschikbaar komen van nieuwe innovatieve geneesmiddelen is een goede ontwikkeling en geeft hoop voor patiënten op een betere kwaliteit van leven of zelfs genezing. Maar de keerzijde is dat deze geneesmiddelen regelmatig ongekend duur zijn. De prijzen en uitgaven van deze groep geneesmiddelen blijven stijgen en drukken op de zorguitgaven van met name medisch specialistische zorg. Het aandeel dure geneesmiddelen is in vergelijking met de totale uitgaven aan medisch specialistische zorg gestegen van 6,8% in 2012 naar 9,5% in 2018.5 De totale uitgaven aan dure geneesmiddelen zijn in 2017 en 2018 met respectievelijk 9% en 9,3% gestegen (op basis van recente cijfers van het ZINL). In 2019 vindt een afvlakking van de groei plaats, namelijk 4,1% (exclusief btw-verhoging).6 Deze daling van de groei in 2019 heeft te maken met een forse uitgavendaling bij biologicals door patentverloop. Dit is naar verwachting niet representatief voor de komende jaren. De stijgende uitgaven aan dure geneesmiddelen leggen een steeds grotere druk op de houdbaarheid en daarmee de toegankelijkheid van het zorgstelsel. Daarnaast zien we ook steeds vaker dat er bij deze dure innovatieve geneesmiddelen nog onzekerheden zijn ten aanzien van de (relatieve) effectiviteit en kosteneffectiviteit van een behandeling op het moment van pakkettoelating. Dit brengt uitdagingen voor ZINL, beroepsgroepen en verzekeraars met zich mee in het bepalen van de toegevoegde waarde en juiste inzet van deze geneesmiddelen voor patiënten.
We doen al veel om effectief in te spelen op deze trends om de toegankelijkheid van dure effectieve innovatieve geneesmiddelen tegen aanvaardbare prijzen te borgen. Tegelijkertijd zie ik drie specifieke aandachtspunten voor de toekomst om hier nog beter op in te kunnen spelen. In de eerste plaats, een praktisch toepasbaar kader voor maatschappelijk aanvaardbare prijzen, dat internationaal breder ondersteund wordt, dient verder uitgewerkt te worden. Transparantie en de (maatschappelijke en politieke) bereidheid om als ultieme consequentie nee te zeggen zijn hiervoor wel een randvoorwaarde. Dit sluit ook aan bij een van de aanbevelingen van het onderzoek van de Algemene Rekenkamer.7 In de tweede plaats de noodzaak om meer differentiatie in te zetten bij pakkettoelating en het (indien nodig) kunnen stellen van afdwingbare randvoorwaarden om de pakkettoelating te versoepelen en het inzicht in de waarde van de behandelingen te vergroten. Denk bijvoorbeeld aan het op een verantwoorde manier mogelijk maken van meer differentiatie in het gehanteerde onderzoekskader en daaraan gerelateerde beoordelingskader dat het Zorginstituut hanteert. Maar ook het beter kunnen afdwingen van bijvoorbeeld gepast gebruik-onderzoek om vragen die nog resteren bij de pakkettoelating te adresseren. Meer differentiatie in pakkettoelating is ook nodig om beter in te kunnen spelen op geneesmiddelen met een hoog gepersonaliseerd karakter. En in de laatste plaats zie ik dat vervolgonderzoek in de praktijk steeds belangrijker wordt voor de doorontwikkeling en effectieve en doelmatige toepassing van een geneesmiddel. Het leren van inzichten in de praktijk leidt tot een betere kwaliteit van behandeling voor een patiënt en kan tevens een positieve bijdrage leveren aan de betaalbaarheid.
Een verdere verkenning en/of uitwerking van deze drie aandachtspunten heeft mijn volle aandacht, waarbij ik me ook realiseer dat dit structurele investeringen in ons systeem zal vergen (bijvoorbeeld een betrouwbare data-infrastructuur) voordat het daadwerkelijk leidt tot lagere uitgaven. Ik heb hiervoor al de eerste stappen gezet door bijvoorbeeld te investeren in de 2e fase van het programma regie op registers. De verdere doorontwikkeling van het geneesmiddelenbeleid en de keuzes die hierin gemaakt worden zijn aan een volgend kabinet.
Geneesmiddelen beschikbaar voor patiënten
Op het moment dat een geneesmiddel (allang) op de markt is, is het ook van belang dat dit daadwerkelijk beschikbaar is en blijft voor patiënten. Wereldwijd zien we het aantal leveringsonderbrekingen en (dreigende) tekorten al enkele jaren toenemen. Ook is door pandemie de wens voor meer autonomie en eigen productie in de EU in een stroomversnelling gebracht. Er is de afgelopen jaren veel geïnvesteerd om de effecten van geneesmiddelentekorten aan te pakken. De Werkgroep Geneesmiddelentekorten (waarin verschillende veldpartijen en overheid samenwerken) heeft in 2017 een lijst met maatregelen opgesteld, waarvan inmiddels een groot deel is uitgevoerd. Denk bijvoorbeeld aan de oprichting van het Meldpunt geneesmiddelentekorten en -defecten (hierna: het Meldpunt). Op deze samenwerking hebben we goed kunnen voortbouwen tijdens de Covid-19-crisis en hebben mede door het uitstekende werk van het Landelijk Coördinatiecentrum Geneesmiddelen ernstige tekorten van (IC-)geneesmiddelen kunnen voorkomen.
Tegelijkertijd blijkt ook dat we met de ingezette maatregelen de grondoorzaken van geneesmiddelentekorten niet kunnen aanpakken. Die oorzaken zijn complex en hebben een internationaal karakter. Ik pleit hierover, ook in het kader van de EU strategische autonomie discussie, dan ook al langer in Europa voor actie. Ik ben ook verheugd om te zien dat er in de farmaceutische strategie van de Commissie ruim aandacht voor dit onderwerp is. Dat geldt ook voor het onderzoek dat de Europees Commissie momenteel uitvoert naar strategische afhankelijkheden in de geneesmiddelenketen, de oorzaken van (toenemende) tekorten en het identificeren van oplossingsrichtingen waarbij Europese samenwerking meerwaarde heeft, bijvoorbeeld door diversificatie van productie en toeleveringsketens. Samen met andere lidstaten bekijken we wat een robuuste en weerbare geneesmiddelenketen is en wat criteria kunnen zijn voor het mogelijk opstellen van een EU-lijst «kritische geneesmiddelen». Relevant is ook het voornemen van de Europese Commissie om een Health Emergency Response Authority (HERA) op te richten. Het voorstel hiertoe wordt eind 2021 verwacht. Het volgende kabinet zal dit op zijn merites beoordelen en goed kijken hoe HERA zou kunnen bijdragen aan het versterken van de leveringszekerheid en de productie in Europa. De komende periode blijft Nederland zich actief opstellen bij discussies in Brussel. Ook nationaal heeft het versterken van de leveringszekerheid mijn continue aandacht. Eerder heb ik, samen met de Staatssecretaris van EZK, uw Kamer geïnformeerd8 over de lening aan het Nederlandse initiatief InnoGenerics voor de overname van de grootste generieke geneesmiddelenfabriek Apotex in Nederland van het Indiase Aurobindo. Ik heb uw Kamer, samen met de Staatssecretaris van EZK, op 18 december 20209 geïnformeerd dat deze overname inmiddels is afgerond. Het behoud van de grootste generieke geneesmiddelenfabriek in Nederland acht ik van groot belang voor de leveringszekerheid van generieke medicijnen.
Door middel van «rondetafels leveringszekerheid» in maart van dit jaar wil ik met nationale veldpartijen beter in kaart brengen waar de kansen liggen voor Nederland en Europa ten aanzien van eigen productie en het verminderen van de afhankelijkheden. Daarnaast wil ik met deze partijen vaststellen wat de knelpunten zijn en hoe we kunnen helpen om hun ambities waar te maken. En ik wil onderzoeken hoe we duurzame en innovatieve productie kunnen versterken door bijvoorbeeld door het stellen bepaalde inkoopcriteria. De resultaten uit die tafels worden meegenomen in het vormen van een strategische beleidsrespons en in de onderhandelingen op EU niveau. Ik realiseer me wel dat Europese samenwerkingstrajecten een lange adem vragen en dat de uiteindelijke uitkomsten onzeker zijn. Daarom moeten ook alle nationale oplossingsrichtingen maximaal verzilverd worden, zoals de doorontwikkeling van het Meldpunt en de uitwerking van de ijzeren voorraad. Het aanhouden van ruimere voorraden door groothandels en leveranciers lost de oorzaken van tekorten niet op, maar hiermee kunnen problemen die ontstaan in de keten beter overbrugd worden. Zo verkleinen we de gevolgen voor patiënten aan de balie.
De beschikbaarheid van geneesmiddelen hangt nauw samen met de aantrekkelijkheid van Nederland als afzetmarkt. Met meerdere aanbieders kunnen we tekorten beter ondervangen, met minder gevolgen voor patiënten. Deze elementen betrek ik dan ook bij het eerdergenoemde onderzoek naar de onderkant van de geneesmiddelenmarkt.
Ten slotte, om de weerbaarheid bij van een eventuele volgende crisis te vergroten, zal ik de aanpak en genomen beslissingen tijdens de Covid-19 crisis evalueren. De belangrijkste lessons learned worden daarmee verankerd voor de toekomst.
Farmaceutische zorg van hoge kwaliteit
De kwaliteit van de farmaceutische zorg is in Nederland hoog. We hebben kundige professionals, zoals artsen, apothekers, assistenten en verpleegkundigen, die veel aandacht hebben voor het juiste gebruik van medicijnen. Daar waar dat mis dreigt te gaan, grijpen we gezamenlijk in, zoals bij het toenemende gebruik van opioïden is gebeurd. We hebben de stijging kunnen afbuigen, in 2019 is het aantal gebruikers ten opzichte van eerdere jaren gedaald met 4,9%.
Begrijpelijke voorlichting voor medicijngebruikers en actuele informatie voor zorgverleners zorgt voor beter gebruik en beter voorschrijven. Zo helpt het Netwerk Patiënteninformatie sinds 2018, met ondersteuning door VWS, patiënten om online beter betrouwbare en begrijpelijke medicijninformatie te vinden. Actuele kennis vindt bij zorgverleners zijn weg in het ontwikkelen en verbeteren van richtlijnen. Mede op verzoek van de Kamer hebben we ons actief bemoeid met de actualisatie van de richtlijn voor Polyfarmacie bij ouderen die bijdraagt aan het voorkomen van medicatie-incidenten en onnodig medicijngebruik bij kwetsbare ouderen. Ik ben verheugd dat deze is afgerond en nu wordt geïmplementeerd.
Een andere richtlijn die mijn aandacht heeft is de recent geactualiseerde richtlijn medicatieoverdracht. In de apotheek, ziekenhuizen en behandelkamers is momenteel vaak geen correct beeld van de medicijnen die gebruikt (zouden moeten) worden door een patiënt. Patiënten, zorgverleners en mantelzorgers weten dit zelf ook vaak niet. Er ontbreekt een actueel medicatieoverzicht en mede daardoor gaat het nog te vaak mis. We zetten gelukkig grote stappen in de digitalisering van die informatie met het programma Gegevensuitwisseling in de zorg, waarvan medicatieoverdracht het vlaggenschip is. De implementatie van de Richtlijn Medicatieoverdracht en de bijbehorende informatiestandaarden geven in de komende jaren een enorme impuls aan de kwaliteit van de farmaceutische zorgverlening en wordt actief ondersteund vanuit VWS. We trekken de komende jaren € 86 mln uit voor een VIPP-programma Farmacie10. In 2021 beginnen we met de «Kickstart», waarin we de richtlijn en bijbehorende informatiestandaard van de tekentafel naar de praktijk brengen en beproeven.
Een belangrijke poot onder de kwaliteit is die van passende farmaceutische zorg. Zoals ik ook al schreef in mijn brief over de doorontwikkeling van gepast gebruik van december11: zorg moet meerwaarde hebben voor een patiënt. Dat is belangrijk vanuit het oogpunt van doelmatigheid, maar vooral ook omdat mensen een behandeling moeten krijgen die bij hen past. De juiste zorg op de juiste plek dus, op het juiste moment. En met de juiste informatie, over geneesmiddelen en hun effect. Het programma Regie op Registers is gestart om meer regie te voeren op de data-infrastructuur over (de effecten van) het gebruik van dure geneesmiddelen. Het zal een majeure operatie zijn in de komende jaren om onze data-infrastructuur op het juiste niveau te krijgen. Ook hierbij geldt: de kosten gaan voor de baat uit.
Farmaceutische strategie voor Europa
Nederland was de afgelopen jaren koploper in de discussie over een Europese farmaceutische agenda. Deze agenda moet in onze ogen toekomstbestendig zijn én concrete oplossingsrichtingen bevatten. In juli van het afgelopen jaar hebben we het voortouw genomen om een non-paper bij de Europese Commissie in te dienen met steun van 17 andere landen om de urgentie en noodzaak voor gezamenlijk handelen te markeren. Het non-paper roept op tot sterkere samenwerking tussen de lidstaten en de Commissie, met respect voor de onderlinge competenties en benadrukt de noodzaak voor een gezamenlijke agenda met concrete lange- en kortetermijnacties.
We hebben, ook vóór de Covid-19-crisis, in verschillende Europese gremia aangedrongen op Europese oplossingen om kwetsbaarheden in de mondiale productieketen te verminderen. Het hierboven genoemde onderzoek van de Europese Commissie naar de geneesmiddelenketen en tekorten zie ik dan ook als een resultaat van de Nederlandse inzet in de verschillende gezondheidsraden in de afgelopen jaren.
Het gaat ons niet alleen om tekorten en voorzieningszekerheid, maar ook om beleidsterreinen zoals duurzaamheid, industriebeleid, intellectueel eigendom, innovatie en digitalisering, waarop het kabinet nauw samenwerkt. Nederland agendeert al jaren het belang van prijstransparantie en samenwerking op het gebied van Health Technology Assessments, het delen van kennis en expertise om tot gezamenlijke pakketbeoordelingen te komen. In 2018 heeft de Europese Commissie een voorstel opgesteld voor een EU-brede HTA samenwerking. Deze wordt op dit moment door de lidstaten besproken. Nederland is voorstander en maakt zich hard voor excellente kwaliteitsborging en onpartijdigheid van deze beoogde samenwerking. Ook dringen we aan op het onder de loep nemen van de regelgeving om de registratieprocedures te vereenvoudigen en zo innovatie en markttoegang tot geneesmiddelen te stimuleren. De weesgeneesmiddelen-verordening en aanvullende beschermingscertificaten hebben onze focus. Ik constateer dat de Nederlandse gedachte over minder marktexclusiviteit voor bestaande producten weerklank vindt binnen de Europese Commissie.
Veel van onze prioriteiten komen terug in de recent uitgebrachte farmaceutische strategie van de Europese Commissie. Mijn inhoudelijke reactie op de strategie is eind januari in de vorm van een BNC-fiche naar uw Kamer verzonden.12
Kortom, in de afgelopen kabinetsperiode zijn vele maatregelen ingezet die de farmaceutische zorg in Nederland op een hoog niveau moeten houden en de kosten beheersbaar. De problematiek in de geneesmiddelenketen is echter complex en veelal mondiaal en zal in de komende jaren veel inzet blijven vragen. We moeten er voor waken dat we die problematiek versimpelen en ons op korte termijn symptoombestrijding richten. Er liggen geen «easy fixes» op de plank om de grondoorzaken aan te pakken. Dat vereist een nationale en internationale blik, innovatie van de structuur van de geneesmiddelen-(ontwikkel)keten en in sommige gevallen een andere ordening van de markt. Duurzame vernieuwing en verankering van de kwaliteit kost tijd, geld en meestal ook internationale samenwerking.
Met deze brief heb ik uw Kamer meegenomen in het brede geneesmiddelenbeleid, zoals toegezegd in de Voortgangsbrief geneesmiddelenbeleid in 201813 en het Algemeen Overleg geneesmiddelenbeleid op 6 november 201914.
In de navolgende delen van de brief zoom ik verder in op de vier thema’s die voor mij de hoekstenen vormen voor het geneesmiddelenbeleid. Daarin kom ik ook terug op recente ontwikkelingen, moties en toezeggingen.15
De Minister voor Medische Zorg, T. van Ark
In aanvulling op de betreffende passages in de brief volgt hier uitgebreide informatie over de vier thema’s:
|
|
Ontwikkeling van nieuwe en betere behandelingen met medicatie mogelijk maken |
|
|
Toegang tot effectieve geneesmiddelen tegen aanvaardbare kosten |
|
|
Geneesmiddelen beschikbaar voor patiënten |
|
|
Farmaceutische zorg van hoge kwaliteit |
Nederland is een klein land zonder hoofdvestigingen van de grote farmaceutische industrie. Niettemin investeert de farmaceutische industrie veel in ons land en heeft Nederland een sterke kennisinfrastructuur, veel start-up en scale-up bedrijven in een bloeiende topsector Life Sciences & Health (LSH) en sinds 2019 ook de vestiging van het EMA. Nederland moet daarom een betekenisvolle rol kunnen spelen bij het ontwikkelen van nieuwe geneesmiddelen en het ontwikkelen van nieuwe indicaties voor bestaande geneesmiddelen, die betaalbaar zijn en meerwaarde hebben voor patiënten. Bij het ontwikkelen en op de markt brengen van geneesmiddelen met een hoog potentieel maatschappelijk rendement, ook wanneer die voor private investeerders minder lucratief zijn. In de afgelopen periode zijn al stappen gezet, maar er zit nog meer in. Dat vergt echter regie en kennis van zaken. Daar blijf ik de komende tijd aan werken. Dat biedt kansen voor publiek private samenwerking in geneesmiddelenontwikkeling, op een verantwoorde manier, waarbij wordt aangegrepen op marktfalen, zonder dat de investeringsrisico’s te groot zijn. Het FAST-rapport (zie hieronder) dat op verzoek van mijn ambtsvoorganger en de Staatssecretaris van EZK is opgesteld, schetst een aanpak voor de noodzakelijke regie die verder kan worden uitgewerkt. Uw Kamer ontvangt binnenkort een inhoudelijke reactie op dat rapport. Een volgend kabinet zal het ambitieniveau van deze ontwikkeling moeten bepalen.
In de afgelopen periode zijn ontwikkelingen ingezet langs drie lijnen die ik zal voortzetten:
A. Investeren in geneesmiddelenontwikkeling
B. Optimaliseren wet- en regelgeving
C. Vergroten kennis over geneesmiddelenontwikkeling
Meer en beter gerichte publieke financiering van geneesmiddelenontwikkeling
Voor een groot deel van de geneesmiddelenontwikkeling vinden investeringen op een goede manier plaats door private investeerders. Overheidsinvestering in geneesmiddelenontwikkeling kan echter legitiem en doelmatig zijn als deze aangrijpt op marktfalen en het project een relatief beperkte faalkans heeft. Daarbij moeten we de maatschappelijke kosten en baten van overheidsingrijpen zorgvuldig afwegen, rekening houdend met het risico van overheidsfalen. Voor VWS zijn er twee vormen van marktfalen relevant. Bij de ene vorm zijn private investeerders niet bereid om de ontwikkeling van een gewenst geneesmiddel (geheel) te financieren omdat de maatschappelijke opbrengst niet voldoende bij hen neerslaat (bijvoorbeeld wel een aanzienlijk gezondheidseffect maar nauwelijks financieel rendement). Bij de andere vorm willen private investeerders graag investeren, maar dreigt het geneesmiddel veel te duur te worden (marktfalen door monopolie en marktmacht). In beide gevallen kunnen selectieve overheidsinvesteringen leiden tot maatschappelijk rendement en in het tweede geval mogelijk ook tot financieel rendement. Een verantwoorde investeringsstrategie vergt veel deskundigheid. De uitkomsten van het onderzoek naar het financiële ecosysteem voor geneesmiddelenontwikkeling en de ervaringen van Fair Medicine (zie hieronder) kunnen daarbij helpen. Idealiter investeert het kabinet selectief in projecten met een hoog potentieel maatschappelijk rendement en een relatief beperkte faalkans bij een falende markt. De overheid kan dan een hefboom creëren waardoor met betrekkelijk weinig overheidsgeld veel ander geld wordt aangetrokken voor de ontwikkeling van geneesmiddelen. De overheidsinvestering kan dan het risico voor private investeerders verder verlagen. In ruil voor de publieke financiering moet de overheid garanties krijgen ten aanzien van de betaalbaarheid en beschikbaarheid als het geneesmiddel de markt bereikt, zoals met de principes voor Maatschappelijk Verantwoord Licentiëren (zie hieronder). Innovatie moet immers hand-in-hand gaan met betaalbaarheid en beschikbaarheid.
Future Affordable and Sustainable Therapies (FAST) en het Actieprogramma Nieuwe kansen voor de topsector LSH
De publieke financiering van geneesmiddelenontwikkeling komt van verschillende departementen vanuit verschillende doelstellingen. Een betere coördinatie kan leiden tot minder fragmentatie, minder overlap en meer samenhang tussen economische, maatschappelijke en klinische prioriteiten.16 Ook ontwikkelingen tijdens de COVID-crisis laten dit zien.
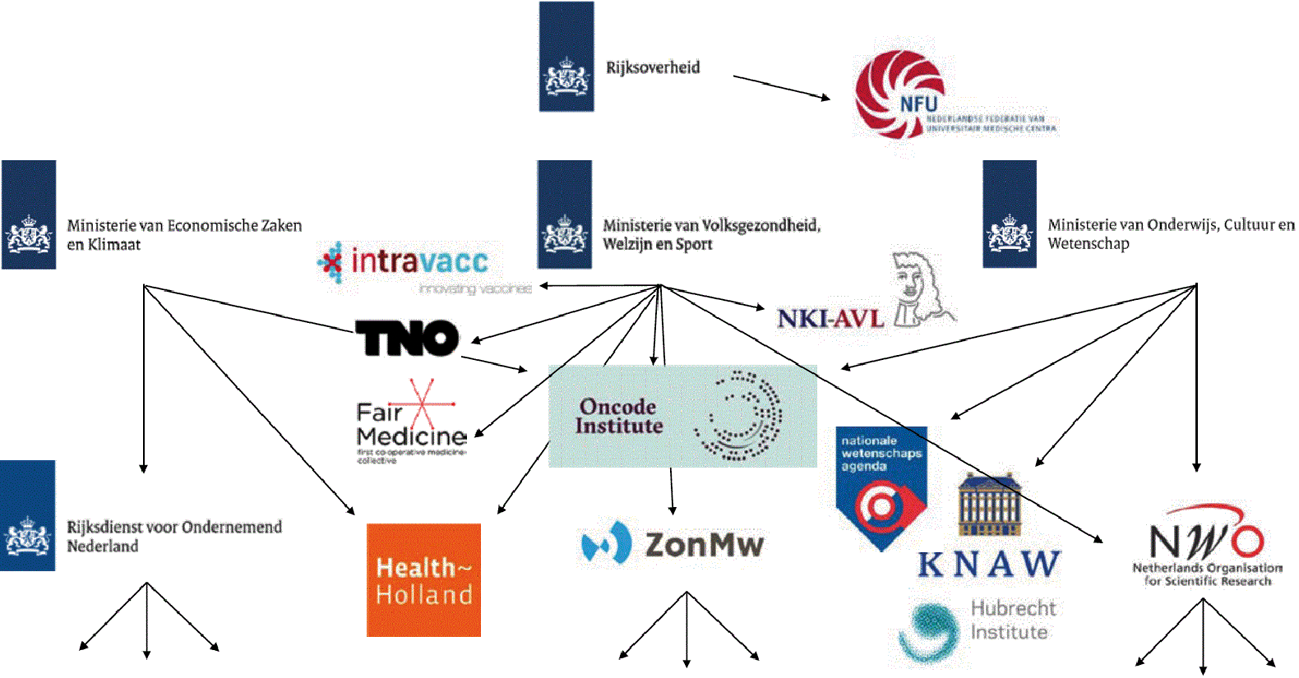
Figuur 1 uit: FAST Impuls voor innovatieve ontwikkeling. Enkele belangrijke initiatieven en financieringsstromen – voor een vollediger overzicht zie Tweede Kamer, vergaderjaar 2020–2021, 29 477, nr. 693
ZonMw heeft in oktober 2019 een schets aangeboden voor een nationaal platform therapieontwikkeling, FAST (Future Affordable and Sustainable Therapies). Dit FAST-initiatief zou het proces van therapieontwikkeling moeten overzien, verbinding maken tussen onderzoeksgroepen en bedrijven, bijdragen aan het ontwikkelen van infrastructuur en onderwijs en bijdragen aan een meer samenhangend R&D-programma. Daarbij is het ook cruciaal om voorwaarden te stellen aan de publieke financiering zoals beschikbaarheid en aanvaardbare prijzen. Daarop hebben VWS en EZK aan ZonMw de opdracht gegeven een kwartiermaker aan te stellen om dit verder uit te werken. Op 21 december 2020 is het FAST-rapport van de kwartiermakers naar uw Kamer gestuurd.17 Ik verwacht uw Kamer in het eerste kwartaal van 2021 een inhoudelijke reactie te kunnen sturen samen met de Staatssecretaris van EZK. FAST beoogt:
– Meer samenhang in publiek gefinancierde therapieontwikkeling middels een regie-orgaan en visie op toekomstige therapieontwikkeling waarin innovatie en betaalbaarheid samengaan.
– Wegwijzer voor onderzoekers en ondernemers op gebied van therapieontwikkeling wat bijdraagt aan een positief R&D-klimaat van ons land. Bij positieve besluitvorming over FAST wordt een wegwijzerfunctie voor het MKB gebouwd. Daarmee zullen de eerste twee verzoeken uit de motie van het lid Veldman18 worden aangepakt.19
– Versterking van infrastructuur op gebied van therapieontwikkeling, waaronder fysiek (bijv. laboratoriumruimte) maar ook onderwijs op het grensvlak wetenschap/bedrijfsleven.
– Voorstel voor een gerichte impulsfinanciering op geselecteerde thema’s om beloftevolle ontwikkelingen sneller van lab tot patiënt te krijgen, met name daar waar sprake is van marktfalen. Bij positieve besluitvorming over FAST zal in de uitwerking worden voldaan aan het verzoek in de motie van de leden Van Gerven en Van den Berg (onderzoek naar voorwaarden om te komen tot revolverend fonds voor niet-commercieel academisch onderzoek, ontwikkeling en registratie van geneesmiddelen).20
Parallel aan FAST werken de ministeries van EZK en VWS aan het door de Staatssecretaris van EZK en de Minister van MZS in 2019 aangekondigde21 Actieprogramma Nieuwe Kansen voor de Topsector LSH in kader van de EMA-vestiging in Amsterdam. Hierin staat nationale coördinatie, versterking van strategische acquisitie en samenhang van innovatieve ontwikkelingen centraal die door departementen worden ingezet op het terrein van nieuwe geneesmiddelen en medische interventies. Met het FAST-rapport werd ook het rapport van het Actieprogramma naar uw Kamer gestuurd (Bijlage bij Kamerstuk 29 477, nr. 649). Hierop zal eveneens op korte termijn een inhoudelijke reactie volgen.
Antibiotica
De coronacrisis toont het ontwrichtende effect dat een infectieziekte op onze maatschappij kan hebben. Bij bacteriële infecties kennen we het gevaar van resistentie. Er zijn niet genoeg nieuwe antibiotica in ontwikkeling om gelijke tred te houden met de toenemende resistentie. Om dit te veranderen investeert VWS in onderzoek en vraagt aandacht voor dit onderwerp in internationale gremia. Een duurzame oplossing vereist internationale samenwerking. Zo verkent Nederland in Europa nieuwe vormen van inkoop en vergoeding om de ontwikkeling van antibiotica te stimuleren.
– In het NACTAR programma van NWO werken 8 academische groepen aan de ontwikkeling van nieuwe antibiotica. VWS draagt hieraan bij met € 4,85 mln in de periode 2017–2022. In 2020 is in dit programma aan twee projecten subsidie verleend voor preklinisch onderzoek.
– Het Netherlands Antibiotic Development Platform (NADP) heeft verschillende initiatieven, zowel publiek als privaat, ondersteund met vouchers voor ondersteuning met bijvoorbeeld een patent aanvraag, of voor onderzoek. VWS draagt hieraan bij met € 1,85 mln in de periode 2017–2021.
– VWS doneert € 5 mln aan GARDP, een internationale organisatie die zich als doel heeft gesteld om in 2025 vijf nieuwe antibiotica op de markt te brengen.
– De Europese Commissie heeft het onderwerp opgenomen in de nieuwe Farmaceutische Strategie.
Kankergeneesmiddelen
Kanker is tegenwoordig doodsoorzaak nummer één en van de uitgaven aan verschillende ziektegroepen zullen die voor de behandeling van kankers het snelst groeien.22 VWS financiert samen met OCW, EZK en KWF het Oncode Institute. Het Oncode Institute bundelt excellent kankeronderzoek in combinatie met een sterke valorisatiestructuur, waardoor vindingen de patiënt makkelijker kunnen bereiken, met als voorwaarde aandacht voor de beschikbaarheid en betaalbaarheid van die vindingen. Het gaat daarbij om de ontwikkeling van geneesmiddelen, diagnostica en research tools. Oncode was een initiatief van de topsector LSH. Het instituut werd in februari 2018 officieel geopend. Het krijgt voor 5 jaar financiering met de intentie om dit bij goede resultaten met nog eens 5 jaar te verlengen.
– Een International Review Committee heeft Oncode in november 2020 tussentijds positief geëvalueerd. Het is echter nog te vroeg voor een oordeel over vervolgfinanciering na de eerste fase. Oncode werkt nu aan een strategisch plan voor de tweede fase. Uiteraard geldt voor VWS daarbij de voorwaarde dat de principes van maatschappelijk verantwoord licentiëren worden gehanteerd (zie hieronder) en dat werk wordt gemaakt van het doorvertalen van onderzoek naar betaalbare producten voor de patiënt. Bij positieve besluitvorming rondom FAST zal de Oncode-financiering daar deel van uitmaken.
Regeneratieve geneeskunde
Regeneratieve geneeskunde is erop gericht nieuwe behandelingen te ontwikkelen die gebruik maken van het zelfherstellend vermogen van ons lichaam. Het moet op een duurzame manier en zonder bijwerkingen cellen, weefsels en orgaanfuncties repareren, vervangen of herstellen na schade door ziekte of letsel. Hiervoor wordt gebruik gemaakt van gentherapie, (stam)celtherapie, al of niet in combinatie met functionele biomaterialen. Het is een veelbelovend vakgebied. Het biedt voor veel chronische aandoeningen een perspectief om de behandeling te verschuiven van «care» naar «cure». In Nederland is een sterk innovatief landschap van publieke en private partijen actief op dit terrein. RegMed XB is een initiatief vanuit de topsector LSH dat deze partijen samenbrengt en innovatie wil stimuleren.
– Om de vertaalslag van onderzoek naar de patiënt te kunnen maken richt VWS samen met EZK een PPS-fonds in. Hiermee kunnen publiek-private samenwerkingsprojecten worden gesteund, met speciale aandacht voor projecten die leiden tot betere zorg tegen lagere zorgkosten. Het fonds richt zich op preklinisch en vroeg klinisch onderzoek. Als alles volgens plan verloopt start het fonds dit jaar, zal het een looptijd van 10 jaar hebben en een budget van € 30 mln waaraan VWS en EZK ieder de helft bijdragen. Bij positieve besluitvorming rondom FAST zal ook dit onderdeel daarvan uitmaken.
Drug rediscovery/repurposing: nieuwe toepassingen voor bestaande geneesmiddelen
Onderzoek naar de mogelijke toepassing van een bestaand geneesmiddel bij een nieuwe indicatie wordt drug rediscovery of drug repurposing genoemd. Drug rediscovery duurt vaak korter dan de ontwikkeling van een heel nieuw geneesmiddel, omdat er al veel bekend is over het geneesmiddel. De toepassing kan daardoor relatief snel de patiënt bereiken en relatief goedkoop zijn. Vanuit patiënten perspectief is het wenselijk dat zo’n nieuwe toepassing ook in de bijsluiter van het geneesmiddel wordt vermeld, zodat de patiënt beschikt over de juiste informatie. In de praktijk gebeurt dat vaak niet: er vindt wel onderzoek naar een nieuwe toepassing plaats, maar dit wordt niet zover doorontwikkeld dat de informatie in de bijsluiter wordt opgenomen (de nieuwe toepassing wordt niet geregistreerd). Het bestaande geneesmiddel wordt dan off-label toegepast. Registratie heeft de voorkeur omdat alleen zo de patiënt over de juiste informatie beschikt.
– Het Oncode Institute heeft een «drug repurposing» programma waarvoor een stoffenbibliotheek is aangeschaft met meer dan 6000 geneesmiddelen in verschillende stadia van ontwikkeling.
– Dit onderwerp heeft ook aandacht op EU-niveau. In 2019 is een pilot ontwikkeld binnen het Farmaceutisch Comité voor een raamwerk voor not-for-profit organisaties (inclusief academie) om data te genereren die nieuwe indicaties voor een bestaand geneesmiddel onderbouwen.
– Binnen het ZonMW-programma Goed Gebruik Geneesmiddelen is aandacht voor drug rediscovery. Een recent succes: in een lage dosis blijkt het goedkope colchicine (veelal gebruikt bij jicht) het risico op een nieuwe hart- of vaatziekte te verkleinen bij mensen die eerder een hartinfarct hebben gehad. Deze ontdekking is gepubliceerd in het toptijdschrift The New England Journal of Medicine.
Resultaten van drug rediscovery komen veelal wel bij de patiënt terecht maar nog niet op een gestructureerde manier en niet geregistreerd. Eén van de uitdagingen ligt op het vlak van de vergoeding en hoe we de investeringen van private partijen kunnen waarderen. Ik ga in 2021 hierover een tafel organiseren om te bespreken hoe we dit soort trajecten wel kunnen belonen c.q. stimuleren. Tegelijkertijd zien we ook specifieke casussen waarbij drug rediscovery leidt tot ongewenst gedrag van fabrikanten. Denk bijvoorbeeld aan de casus mexiletine (Namuscla), waarbij de fabrikant het geneesmiddel registreert voor een al bekende toepassing in de praktijk en na registratie een verveelvuldiging van de prijs vraagt. Dit is ongewenst. Op Europees niveau zet ik me daarom in voor aanpassing van de weesgeneesmiddelenverordening. Ik kom hier verderop in deze brief op terug.
Transitie Proefdiervrije Innovatie (TPI)
Geneesmiddelenontwikkeling heeft een hoge faalkans in de klinische fase, onder meer door de geringe voorspellende waarde van dierproeven. Die problematiek speelt breder dan alleen bij geneesmiddelenontwikkeling. Een alternatief voor de dierproef is echter vaak nog niet voorhanden. De overheid wil daarom samen met partners uit verschillende sectoren de transitie naar proefdiervrije innovatie versnellen. Dat netwerk bestaat uit verschillende departementen, wetenschappelijke en maatschappelijke organisaties en het bedrijfsleven. Het Ministerie van LNV voert de regie op dit traject. We streven naar onderzoekmodellen en beoordelingsmethoden die een betere voorspelling geven van werkzaamheid of functionaliteit en van bijwerkingen of toxische effecten van medicijnen en chemische stoffen. Daarbij worden dierproeven minder noodzakelijk terwijl de informatie over medicijnen en chemische stoffen nauwkeuriger wordt. Die betere alternatieven worden gezocht in meetmodellen die op kennis over de mens gebaseerd zijn, bijvoorbeeld met behulp van organ-on-chip-technologie. Dit sluit goed aan bij de ontwikkeling van personalised medicine. Voor wezenlijke verandering is aanpassing van de internationale wet- en regelgeving vaak onontbeerlijk.
– VWS en andere departementen investeren in een oproep voor projecten voor het thema «Naar een nieuwe veiligheidsbeoordeling op grond van pathologische en fysiologische kennis van de mens» uit de Nationale Wetenschapsagenda.
– Waar humane meetmodellen succesvol zijn, is er beleidsinspanning om te voorkomen dat dierproeven als vanzelfsprekend in Europese richtlijnen worden opgenomen. Dat geldt bijvoorbeeld voor cel- en gentherapie producten (in het TPI-Vernieuwingsnetwerk ATMP’s)
Maatschappelijke voorwaarden verbinden aan publieke financiering
Geneesmiddelenontwikkeling is voor een groot deel privaat gefinancierd, maar de publieke financiering voor geneesmiddelenontwikkeling is niettemin substantieel.23 Het is daarom verstandig om voorwaarden te stellen aan het licentiëren van geneesmiddelenoctrooien van publieke kennisinstellingen met het oog op de latere betaalbaarheid en beschikbaarheid van die geneesmiddelen. Dit is ook een van de uitgangspunten van het FAST-initiatief: innovatie moet hand-in-hand kunnen gaan met betaalbaarheid. De NFU heeft samen met de VSNU de nodige instrumenten ontwikkeld om vindingen vanuit de academie maatschappelijk verantwoord naar de markt te brengen. Hierover is de Kamer geïnformeerd.24
– De Tien Principes voor Maatschappelijk Verantwoord Licentiëren (2019)
– De toolkit voor Maatschappelijk Verantwoord Licentiëren (2020) die door alle Nederlandse universiteiten en UMC’s gebruikt zal worden en waarover zij zullen rapporteren. Deze toolkit zal worden doorontwikkeld en ik zal daarover met de NFU in gesprek gaan.
– In samenwerking met diverse partijen zullen we deze principes ook internationaal onder de aandacht brengen.
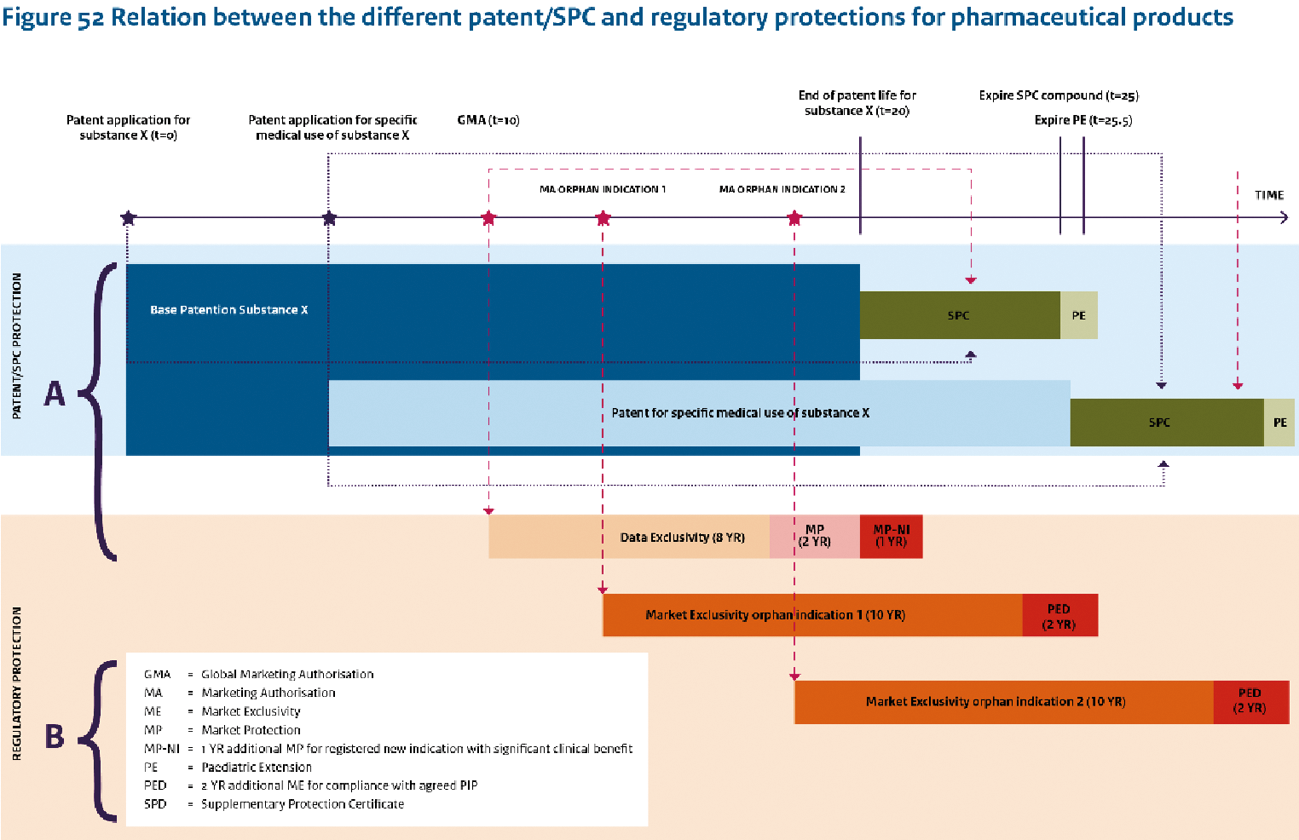
Aanpassing aanvullende beschermingsmechanismen voor geneesmiddelen
Naast publieke financiering zijn investeringen door private partijen van eminent belang. Zij moeten hun investeringen kunnen terugverdienen. Op 3 juni 2019 hebben de Minister van MZS en de Minister van EZK aan uw Kamer de «Appreciatiebrief studies aanvullende beschermingsmechanismen voor geneesmiddelen» verstuurd.25 Het systeem van aanvullende bescherming is ingericht met de gedachte dat ontwikkelingen die meer moeite, tijd en investeringen vergen, in aanmerking komen voor langere en uitgebreidere bescherming. De balans in het systeem raakt verstoord als men bescherming maximaliseert op innovaties die een minimale inspanning hebben gevergd. Voor het kabinet geven de studies aanleiding om te concluderen dat de balans tussen de omvang en reikwijdte van de aanvullende bescherming, de innovatie die het oplevert, en de gevolgen voor de uitgaven aan geneesmiddelen niet meer optimaal is. Een goede balans biedt ruimte voor innovatie én voor concurrentie. Het geheel aan regelingen is in de laatste jaren zeer complex geworden, maar niet gerichter en heeft soms ongewenste (neven)effecten. Er is ruimte voor aanscherping van het beleid om de oorspronkelijke doelstellingen beter te dienen:
– Wij achten het wenselijk de originele intentie van de ABC-verordening te handhaven, waarbij het niet mogelijk is een aanvullend beschermingscertificaat af te geven voor een andere toepassing van een reeds bekende werkzame stof. Nederland heeft hiertoe ook met succes geïntervenieerd in verschillende procedures bij het Europese Hof van Justitie.
– Aanpassing weesgeneesmiddelen- en kindergeneesmiddelenverordening zodat deze efficiënter de ontwikkeling van nieuwe geneesmiddelen voor weesziekten en voor kinderen stimuleert, maar wel de onbedoelde neveneffecten, zoals prijskaping van reeds bestaande middelen, worden aangepakt. De Europese Commissie heeft op 25 november 2020 de Inception Impact Assessment gepubliceerd. Nederland heeft op 6 januari een reactie bij de Commissie ingestuurd.
– In het Notaoverleg Big Pharma van 10 december 2018 (Kamerstuk 34 834, nr. 16) heeft mijn abtsvoorganger toegezegd uw Kamer nader te informeren over de voorwaarden voor octrooibescherming van geneesmiddelen. De Minister van EZK zal u hierover mede namens mij een brief sturen.
Figuur 2 Technopolis Group. Effects of supplementary protection mechanisms for pharmaceutical products. Publication date: 15 June 2018
Aanpassing regelgeving ATMPs en GGOs
De eerste advanced therapy medicinal products (ATMPs) zijn de afgelopen jaren op de markt gekomen. Denk aan gen- en celtherapie. Deze innovatieve therapieën zijn vaak gericht op ziekten waar nog geen ander geneesmiddel voor bestaat. De komende jaren verwacht men veel nieuwe ATMPs; in de horizonscan staan er nu tientallen. Er zijn echter signalen dat het huidige systeem niet aansluit bij deze verschillende innovatieve producten. Dit komt doordat de producten complex zijn, vaak ontwikkeld worden voor kleine groepen patiënten, speciale faciliteiten vereisen en hoge kosten met zich mee brengen. Daarnaast is het regulatoire systeem ontworpen vanuit de klassieke blik op farmaceutische middelen, terwijl ATMPs diverse vormen aannemen. Dit lijkt niet altijd de juiste route en bemoeilijkt de ontwikkeling en de weg naar de patiënt.
– Er is met stakeholders gesproken om uitdagingen in kaart te brengen. Op basis hiervan is een actieplan opgezet om met stakeholders deze uitdagingen aan te pakken.
– VWS heeft de gesignaleerde problematiek rondom ATMPs in Europa aangekaart en de Europese Commissie heeft dit onderwerp opgenomen in de nieuwe Farmaceutische Strategie.
Er is de afgelopen jaren kritiek geweest op de doorlooptijd en complexiteit van de vergunningsverleningsprocedure voor Genetisch Gemodificeerde Organismen (GGOs). Met de modernisering van biotechnologie, tegelijk met de opkomst van toepasbare therapieën en veel meer aanvragen voor vergunningen, werd duidelijk dat er iets moest veranderen.
– In 2019 en 2020 zijn daarom in samenwerking met het veld grote stappen gezet. Zo zijn de doorlooptijden voor vergunningverlening aanzienlijk verkort en de procedurelasten verlaagd.
– Door de introductie van een lerend systeem van vergunningverlening zal ook in de toekomst het systeem waar nodig aangepast en verbeterd kunnen worden. Dit blijft een lopend proces.
– Voor COVID-19 producten is de milieuvergunningsprocedure tijdelijk buitenwerking gesteld.
In het notaoverleg Geneesmiddelenbeleid/Hulpmiddelenbeleid van 15 oktober jl. (Kamerstuk 29 477, nr. 685) heeft mevrouw Van den Berg gevraagd om een overzicht waaruit blijkt op welk vlak Nederlandse wetgeving afwijkt van wetgeving in andere Europese landen en wat de reden hiervoor is. Nederland wijkt niet af van de Europese wetgeving, maar implementaties van deze wetgeving lopen uiteen in Europa. In de Europese Unie speelt een niet opgelost discussiepunt of gentherapie valt onder het zogenaamde «ingeperkt gebruik» (IG) of «doelbewuste introductie in het milieu» (IM). Dat zijn twee regimes waarvoor twee verschillende Europese richtlijnen met verschillende procedures gelden. Nederland behoort tot de meerderheid van lidstaten die gentherapie in beginsel als doelbewuste introductie in het milieu behandelen. De onderbouwing hiervoor is dat patiënten of proefpersonen de instelling waar zij zijn behandeld verlaten en het GGO dat hen is toegediend in het milieu terecht kan komen en door uitscheiding, bijvoorbeeld via speeksel, aan andere personen kan worden overgedragen. Door de opgebouwde kennis met vergunningsverlening voor gentherapie is de uitkomst van een milieurisicobeoordeling van nieuwe gentherapieën die via dezelfde mechanismen werken grotendeels bekend, waarbij «ten hoogste verwaarloosbaar risico» de norm is. Om vergunningsverlening voor deze gelijksoortige aanvragen te vergemakkelijken zijn recent de procedurelast en beoordelingstermijnen voor dit soort aanvragen verminderd van maximaal 120 naar 56 dagen (en in sommige gevallen zelfs 28 dagen)26. Hierdoor zijn de verschillen in doorlooptijden met landen die het ingeperkt gebruik regime hanteren nagenoeg verdwenen en is Nederland een aantrekkelijk land voor werkzaamheden met medische biotechnologie door onderzoeksinstellingen en bedrijven. Ook in de toekomst zal in samenwerking met de stakeholders worden gewerkt aan een lerend systeem van vergunningverlening, waarbij toepassingen met een bekend (hoogstens verwaarloosbaar) risico, een kortere doorlooptijd zullen hebben.
Fair Medicine
In 2016 heeft Fair Medicine subsidie ontvangen om ervaring op te doen met een alternatief businessmodel voor geneesmiddelenontwikkeling en drug rediscovery. VWS zou Fair Medicine tijdelijk ondersteunen, waarna Fair Medicine op eigen benen zou kunnen staan. De subsidie is in 2019 met een jaar verlengd tot en met eind 2020. Fair Medicine werkte met uitgangspunten waarmee zij zich onderscheidde van de gewone geneesmiddelenindustrie. Dit ging uit van een coalitiemodel waarin verschillende partijen, waaronder artsen, onderzoekers, industrie en investeerders, samen een geneesmiddel naar de markt brengen. De geneesmiddelen zouden in de markt worden gezet met een fair price, wat Fair Medicine definieert als een maximaal winstpercentage van 8–15% per product. Ten slotte gold dat de prijs van een succesvol product niet mocht compenseren voor de kosten van onderzoeken en producten die de eindstreep niet hebben gehaald. Inmiddels heeft Fair Medicine een eindrapportage opgeleverd met relevante inzichten over de kansen en beperkingen van het gekozen model (bijlage II)27. Uit het rapport blijkt eens te meer dat geneesmiddelenontwikkeling risicovol is en dat veel onderzoeken uiteindelijk niet leiden tot een product waarmee omzet gegenereerd kan worden. Ook deze kosten moeten echter op enige wijze gedekt worden. Het principe dat een succesvol product hiervoor niet mag compenseren is voor de langere termijn niet houdbaar. Daarnaast geeft Fair Medicine aan dat het vooraf vastzetten van de winst op een bepaald percentage in de huidige markt niet voldoende investeerders aantrekt. Voor sommige partijen uit het coalitiemodel lijkt het niet mogelijk of wenselijk om als risico-investeerder op te treden. Fair Medicine noemt in haar rapportage specifiek de uitdagingen voor de UMC’s om voldoende deel te nemen aan dit model. Dit kan alleen als daar een oplossing voor wordt gevonden.
Fair Medicine zal haar activiteiten, al dan niet in aangepaste vorm, voortzetten en streeft ernaar in de komende jaren een eerste product naar de markt te brengen. Voor mij toont de ervaring van Fair Medicine echter aan dat een hoog investeerdersrisico en het vooruitzicht op een beperkte winst niet goed samengaan. Bij marktfalen zal de overheid daarom soms zelf gericht moeten investeren in geneesmiddelenontwikkeling met een hoog potentieel maatschappelijk rendement, zodat voor andere partijen het investeerdersrisico afneemt en zij genoegen kunnen nemen met een beperkt potentieel financieel rendement. Zie hiervoor ook de paragraaf over investeren in geneesmiddelenontwikkeling.
Stichting Nationaal Farmaceutisch Kennis-, Ontwikkel- en Opleidingscentrum (NFKOO)
Mede in het licht van COVID-19 is het van belang dat kennis over therapieontwikkeling, registratie en productie binnen kennisinstellingen in Nederland en Europa behouden blijft en uitgebouwd wordt. Die kennis is ook essentieel bij het ontwikkelen van op de individuele patiënt toegesneden bereidingen. Wegens de brede toepasbaarheid van deze kennis is het onderbrengen ervan in kennisinstellingen opportuun. Het werk van de Stichting NFKOO past ook bij de trend dat in kennisinstellingen meer aan geneesmiddelenontwikkeling en -bereiding wordt gedaan en er vanuit deze instellingen een wens tot registreren van bepaalde producten komt.
Het LUMC en partners op het Bio Sciencepark Leiden werken al geruime tijd aan de opbouw van een dergelijk kenniscentrum. De stichting zal zich richten op de volgende onderwerpen:
1. Kennis opbouwen en bundelen voor niet-commerciële partijen om kwaliteit, veiligheid en werkzaamheid van geneesmiddelen, bijvoorbeeld voor zeer kleine patiëntpopulaties, te waarborgen;
2. Beter inzicht krijgen in hoe kwaliteitscontroles van zowel geregistreerde als bereide geneesmiddelen verder te verbeteren zijn.
3. Onderzoeken of 3D-printtechnologie een oplossing kan zijn waardoor men in de toekomst in een ziekenhuisapotheek, poliklinische apotheek of zelfs een openbare apotheek geneesmiddelen met een gepersonaliseerde formulering kan produceren met een gekwalificeerd proces.
De subsidie wordt verstrekt tot 2023 en heeft een omvang van maximaal € 12.683.679,– in de periode van 1-12-2020 tot 1-12-2023.
Onderzoek naar financieel ecosysteem voor geneesmiddelenontwikkeling
Het beeld dat een farmaceut een medicijn van begin tot eind zelf ontwikkelt sluit niet meer aan bij de complexe werkelijkheid. Er is een heel ecosysteem ontstaan van onderzoekers, start-ups, investeerders en grote farmabedrijven, gericht op medicijnontwikkeling. Een potentieel medicijn wordt tijdens de ontwikkeling verschillende keren op waarde geschat, doorverkocht of uitgelicentieerd. Dit betekent dat er ook meerdere keren rendement moet worden behaald, nog voordat een medicijn op de markt komt. Hoe dit ecosysteem functioneert is onderwerp van deze studie. Het doel is inzicht in de financiële stromen en belangen die ertoe leiden dat een geneesmiddel ontwikkeld wordt en uiteindelijk beschikbaar komt voor de patiënt.
Na een internationale aanbestedingsprocedure is een kwalitatief hoogstaand onderzoeksvoorstel uitgekozen. Dit zal worden uitgevoerd door SiRM als hoofdaannemer, in combinatie met Rand Europe en LEK Consulting. Als alles volgens plan verloopt start het onderzoek begin 2021 en wordt het rapport in de eerste helft van 2022 opgeleverd. Het uitvoeren van dit onderzoek komt tegemoet aan een verzoek van mevrouw Van den Berg in het AO Geneesmiddelenbeleid van 7 februari 2019 (Kamerstuk 29 477, nr. 557).
Het streven is dat Nederlandse patiënten tijdig toegang krijgen tot (innovatieve) effectieve geneesmiddelen tegen aanvaardbare kosten. Aanvaardbaar in de zin van niet meer betalen dan nodig en niet minder dan noodzakelijk.
De afgelopen jaren hebben we verschillende verbeteringen doorgevoerd om dit te borgen. Deze verbeteringen hebben zowel geleid tot een matiging van geneesmiddelenprijzen als tot verbeterde toegang voor met name innovatieve weesgeneesmiddelen, conditionals en exceptionals. Tegelijkertijd zijn we er nog niet. Twee categorieën van geneesmiddelen blijven in toenemende mate onze aandacht vragen de komende jaren. Het gaat hier enerzijds om geneesmiddelen aan de zogenaamde onderkant van de markt, waar ik in het deel van deze brief dat gaat over beschikbaarheid dieper op in ga. Anderzijds gaat het hier om de zogenoemde bovenkant van de markt oftewel de dure innovatieve geneesmiddelen. De uitgaven hieraan stijgen nog steeds fors. Om hier nog beter op in te kunnen spelen zie ik drie aandachtspunten voor de toekomst op het terrein van pakketbeheer, onderzoek in de praktijk en maatschappelijk aanvaardbare prijzen. Op deze punten kom ik verderop terug. Ik schets eerst wat we in de afgelopen jaren hebben verbeterd.
Verbeteringen in de afgelopen jaren
De afgelopen jaren zijn verschillende verbeteringen doorgevoerd om de toegang tot effectieve geneesmiddelen tegen aanvaardbare kosten voor patiënten te borgen. Deze laten zich indelen in de volgende dimensies:
A. Overheidsmaatregelen om betaalbaarheid en toegang te borgen
B. Faciliteren en stimuleren van partijen in het veld om betaalbaarheid en toegankelijkheid dure geneesmiddelen te borgen
C. Internationale samenwerking
Hieronder schets ik een aantal voorbeelden waarop waardevolle stappen zijn gezet.
Verankering sluiscriteria, aanpassing Wgp en modernisering GVS
Om de betaalbaarheid beter te borgen zijn per 1 juli 2018 de criteria voor de «pakketsluis» wettelijk verankerd.28 Hiermee is de basis voor besluiten tot het in de «pakketsluis» plaatsen van geneesmiddelen die een groot financieel risico met zich meebrengen of een hoge prijs hebben verstevigd. Met deze criteria, samen met de informatie uit de eerder geïntroduceerde horizon scan voor geneesmiddelen is het voor alle partijen transparanter geworden of een nieuw geneesmiddel onderwerp zal zijn van een sluisplaatsing, beoordeling door het Zorginstituut en een prijsonderhandeling.
Eind 2019 is een wijziging van de Wet geneesmiddelenprijzen (Wgp)(Kamerstuk 35 137), die maximumprijzen voor geneesmiddelen stelt, doorgevoerd. Met deze wijziging zijn met name de geneesmiddelenprijzen voor specialité geneesmiddelen meer in lijn gebracht met het Europese gemiddelde. Wel behoud ik bij de vaststelling van de maximumprijzen dit jaar de laagdrempelige voorziening waarmee de maximumprijzen voor producten met een relatief lage omzet (minder dan € 1 miljoen per jaar in Nederland) op verzoek niet verder zullen dalen. Hiermee blijf ik eventuele risico’s op beschikbaarheidsproblemen voor deze meer kwetsbare producten mitigeren. Met de wijziging van de Wgp wordt € 300 miljoen structureel per jaar bespaard, deels intramuraal, deels extramuraal. Tenslotte wordt het fundament gelegd voor de modernisering van het GVS per 1 januari 2023 waarmee structureel € 140 miljoen bespaard wordt in het extramurale geneesmiddelenkader. Op beide instrumenten ben ik uitgebreider ingegaan in recente brieven.29
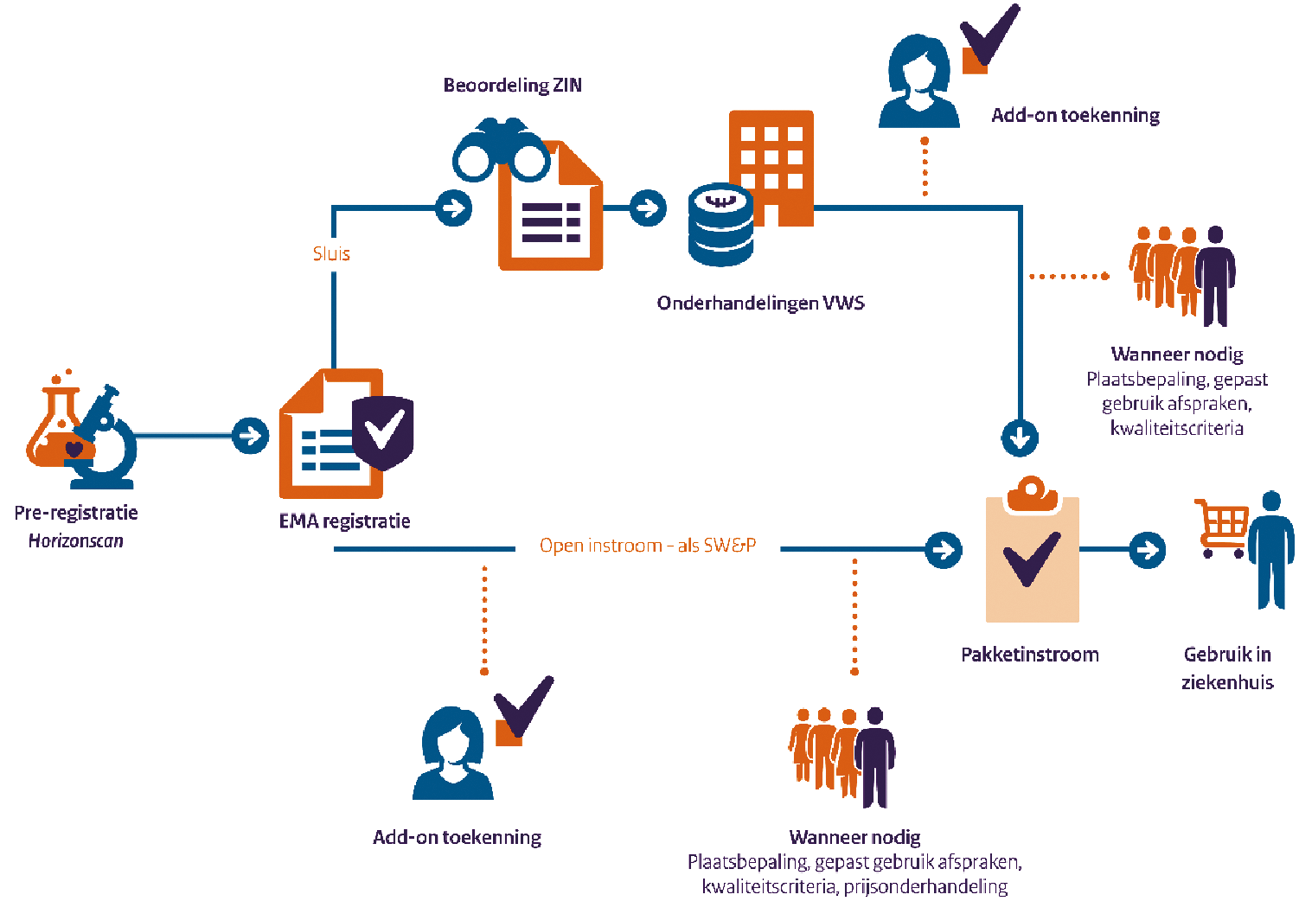
Nieuwe voorwaardelijke toelating weesgeneesmiddelen, exceptionals en conditionals
Om de toegang voor de patiënt voor weesgeneesmiddelen, conditionals en exceptionals te verbeteren en verder effectiviteitsonderzoek te stimuleren is per 22 oktober 2019 de nieuwe voorwaardelijke toelating van dit type geneesmiddelen in werking getreden.30 Bij deze geneesmiddelen bleek immers dat het bewijzen en vaststellen van de effectiviteit lastig kan zijn of langer kan duren wat een belemmering kan vormen voor opname in het verzekerde pakket. Door deze voorwaardelijke toelating krijgen patiënten met een ernstige, vaak zeldzame ziekte waarvoor nog geen goede behandeling is eerder toegang tot geneesmiddelen waarvan de effectiviteit nog onvoldoende zeker is. Binnen de nieuwe voorwaardelijke toelating is er meer ruimte dan voorheen voor maatwerk, zowel in onderzoek als onderzoeksduur, waardoor deze beter toegespitst is op de specifieke problematiek in bewijsvoering van weesgeneesmiddelen, conditionals en exceptionals. Voor deze voorwaardelijke toelating heb ik een budget van structureel oplopend tot € 36,8 miljoen per jaar beschikbaar. Op dit moment zit er een geneesmiddel (Spinraza) in de voorwaardelijke toelating. Daarnaast heeft het Zorginstituut Nederland (ZINL) mij onlangs geadviseerd om twee nieuwe geneesmiddelen (Translarna en Natpar) als potentiele kandidaten aan te wijzen. Ik ben hiermee akkoord gegaan. En daarnaast bestaat er ook nog de subsidieregeling veelbelovende zorg, waarin een onderzoek naar CAR-T cellen is opgenomen.31
Pilot Parallelle Procedures CBG en ZINL
In het kader van een vervroegde besluitvorming over de vergoeding van nieuwe geneesmiddelen loopt op dit moment een pilot van het College ter Beoordeling van Geneesmiddelen (CBG) en het ZINL waarbij geëxperimenteerd wordt met parallelle beoordeling van geneesmiddelen. Dit houdt in dat de inhoudelijke toetsing door ZINL voor vergoeding al parallel aan de markttoelatings-procedure wordt ingezet. Experts van het CBG en ZINL werken hierop samen en wisselen informatie uit. Zo kan bij markttoelating direct een vergoedingsbesluit genomen worden, waardoor geneesmiddelen eerder het verzekerde pakket in kunnen stromen. De eerste ervaringen zijn zeer positief. De eerste twee geneesmiddelen «Rybelsus» voor diabetes en «Arikayce» voor longinfecties hebben dit proces doorlopen en zijn op respectievelijk 1 augustus 2020 en 1 februari 2021 tot het basispakket toegelaten. Hierdoor zijn deze geneesmiddelen sneller beschikbaar gekomen voor patiënten dan anders het geval was geweest. Op dit moment doorlopen nog 2 geneesmiddelen de parallelle procedure. De pilot wordt binnenkort geëvalueerd. Daarna kunnen parallelle procedures mogelijk permanent onderdeel gaan uitmaken van de beoordelingsprocedures van het Zorginstituut.
Overheveling geneesmiddelen
Per 1 januari 2021 zijn de geneesmiddelen voor Gaucher en totale parenterale voeding (TPV) overgeheveld van het extramurale geneesmiddelenkader naar het intramurale kader. Dit draagt bij aan het verduidelijken van de verzekerde aanspraak en de doelmatigheid en kwaliteit van zorg. De effecten van de overheveling van de Gaucher geneesmiddelen worden gemonitord. Ik heb inmiddels de nulmeting hiervoor ontvangen. Volgend jaar volgt de effectmeting. Hiermee voldoe ik aan mijn eerdere toezegging om de Kamer te informeren over de voortgang van de overheveling voor de middelen voor Gaucher en de monitoring daarvan. Verder werk ik aan het voorbereiden van de overheveling van de immunoglobulinen, epoetines en g-csf middelen die per 1 januari 2022 plaatsvindt.
Integraal pakket aan maatregelen dure geneesmiddelen (IPAM)
In het Hoofdlijnenakkoord Medisch Specialistische Zorg heb ik met partijen32 afspraken gemaakt over het borgen van de betaalbaarheid en toegankelijkheid van dure geneesmiddelen. Meer concreet, zijn deze afspraken vastgelegd in het IPAM, waaruit verschillende actielijnen voortvloeien. Binnen het Landelijk Overleg Dure Geneesmiddelen (LODG) werk ik met partijen aan de uitwerking van deze actielijnen.
Een van de acties is om aan de voorkant, op basis van de horizonscan, tijdig en actief in te spelen op mogelijke opgaven ten aanzien van de betaalbaarheid en/of kwalitatief goede en doelmatige inzet van dure geneesmiddelen. Hiervoor is als pilot een triage-proces ingericht met alle betrokken LODG-partijen. Dit is ook een van de geadviseerde actielijnen van het Platform Inkoopkracht Dure Geneesmiddelen.33 Het ZINL heeft het secretariaat voor de triage ontwikkeld en opgezet. VWS is nauw betrokken en ondersteunt dit proces. Tijdig inspelen aan de voorkant op de vraagstukken die deze middelen met zich meebrengen, voorkomt onnodige vertraging in de toegang voor patiënten en kan partijen voor pakketinstroom inzicht geven in de toegevoegde waarde en gepaste en doelmatige inzet van nieuwe geneesmiddelen. De triage geeft ook helderheid over de vervolgstappen en wie hiervoor verantwoordelijk is op de terreinen van (gezamenlijke) inkoop, pakkettoelating en plaatsbepaling. Daarnaast faciliteert de triage ook het gezamenlijk optrekken van partijen bij de inkoop van dure geneesmiddelen. Deze pilot is in september 2020 van start gegaan.
De rol van de beroepsgroep in dit triage-proces is cruciaal. Zij moeten immers tijdig een uitspraak doen over in hoeverre de toegevoegde waarde van het geneesmiddel duidelijk is en wat de beste plek is in de behandeling van de patiënt. Om hen hierin te faciliteren ben ik in gesprek met de Federatie Medisch Specialisten (FMS) over financiële ondersteuning.
Ook het gepast gebruik van dure geneesmiddelen is belangrijk voor de kwaliteit en betaalbaarheid van de zorg. Hiervoor heb ik een subsidie verleend aan het Programma Gepast gebruik dure geneesmiddelen van de Nederlandse Vereniging van Ziekenhuizen (NVZ), de Federatie Medisch Specialisten (FMS), de Nederlandse Federatie van Universitair Medische Centra (NFU), Zorgverzekeraars Nederland (ZN) en de Patiëntenfederatie. Doel is inzicht krijgen in effectieve interventies van gepast gebruik bij dure geneesmiddelen en komen tot brede implementatie van deze interventies in de praktijk. Recent heb ik u ook in de breedte geïnformeerd over de stand van zaken en ontwikkelingen op gepast gebruik en waarover ik met het veld in gesprek wil gaan.34 Een update van alle actielijnen van het IPAM is te vinden in bijlage III 35.
Subsidie verleend om kennis over biosimilars te vergroten
Vooral door kennisgebrek was voorschrijvers de acceptatie van biosimilars laag, terwijl ze even werkzaam en veilig zijn als het origineel waarvan ze zijn afgeleid, maar in de regel veel lager geprijsd. Ik vind het belangrijk om de kennis van zorgverleners over biosimilars te vergroten. Daarom heb ik een subsidie verleend aan Biosimilars Nederland en het Instituut Verantwoord Medicijngebruik voor het Biosimilars op Maat programma (BOM programma). Het BOM programma is in april 2018 gestart en richtte zich op het verspreiden van de benodigde basiskennis en het delen van best-practice ervaringen met zorgverleners, patiënten en zorgverzekeraars, en deze ook aan te passen aan de lokale behoefte. Het initiatief heeft hierdoor bijgedragen aan een betere uitvoering van doelmatig voorschrijfbeleid, acceptatie voor biosimilars en betaalbaarheid van de zorg. Het BOM programma heeft ook onderzoek gedaan naar de kostenbesparingen door het op de markt komen van biosimilars. Hierbij is specifiek gekeken naar vijf biosimilars (Adalimumab, Etanercept, Infliximab, Rituximab en Trastuzumab). De komst van deze vijf biosimilars op de Nederlandse markt heeft geleidt tot een uitgavenverlaging van meer dan 50% voor deze vijf geneesmiddelen, wat neerkomt op ruim 300 miljoen euro op jaarbasis, terwijl een kwart meer patiënten hiermee is behandeld. Voor een samenvatting van de eindrapportage van het mooie initiatief van Biosimilars op Maat zie bijlage IV36.
Feiten en cijfers
Over geneesmiddelen verschijnen jaarlijks meerdere rapporten en analyses met verschillende databronnen. Een integraal en eenduidig overzicht van gepubliceerde feiten en cijfers over geneesmiddelen met data over gebruik, uitgaven en ontwikkeling van middelen, helpt in de discussie over de interpretatie/duiding van die cijfers. Het bijgevoegde «prototype» in bijlage V37 bevat een eerste opzet van feiten en cijfers in de vorm van een interactief informatiebeeld. In de toekomst werk ik dit graag verder uit, in samenspraak met de betrokken veldpartijen.
In toenemende mate is internationale samenwerking nodig om betaalbaarheid en toegankelijkheid van geneesmiddelen te kunnen waarborgen. Andere landen lopen bij nieuwe geneesmiddelen tegen dezelfde uitdagingen aan die wij hebben. We zoeken daarom al geruime tijd de samenwerking met andere landen in Europa. Denk hierbij aan het Beneluxa initiatief dat is opgericht om informatie uit te wisselen, pakketbeoordelingen te doen en gezamenlijk prijsonderhandelingen te voeren met andere landen. Ierland heeft zich in 2018 als vijfde land aangesloten bij dit initiatief. Er vinden binnen dit initiatief diverse activiteiten plaats om meer inzicht te genereren rond prijzen en vergoedingen van geneesmiddelen. Zoals eerder aangegeven is vanuit het initiatief het «Internationale Horizon Scanning Initiative» (IHSI) opgericht, waaraan nu negen landen deelnemen. De voorbereidingen om tot een internationale Horizon Scan te komen zijn in volle gang en moeten medio 2021 de eerste inzichten opleveren in nieuw te introduceren geneesmiddelen en hun kosten. Dit inzicht biedt een basis voor tijdige actieve samenwerking tussen landen met betrekking tot nieuwe dure geneesmiddelen.
Daarnaast vindt overleg plaats met diverse andere landen, waaronder diverse Scandinavische landen verenigd in het «Nordic Forum», over nieuwe mogelijkheden om al voorafgaand aan de markttoelating van geneesmiddelen duidelijkheid te geven aan fabrikanten over de betalingsbereidheid (de zogeheten «willingness to pay») voor een geneesmiddel. Fabrikanten kunnen zo vooraf een meer realistisch beeld krijgen over de betalingsbereidheid van overheden en kunnen hier dan bij het stellen van de prijs van hun geneesmiddelen rekening mee houden. Samenwerking kent daarmee niet alleen een praktische uitwerking, maar is ook uitgegroeid tot het innemen en ventileren van gezamenlijke opvattingen. In het onderstaande kader een voorbeeld hiervan.
Een gezamenlijke stem in het debat
Transparantie als belangrijke stip op de horizon
Voor de Beneluxa landen is grotere transparantie een belangrijke factor in het waarborgen van toegang tot en betaalbaarheid van geneesmiddelen. Daarom namen zij een gezamenlijk standpunt rond transparantie in. Landen vinden dat vergroten van inzicht in het ecosysteem van geneesmiddelenontwikkeling en -vermarkting noodzakelijk is en dat ook toegang tot negatieve data uit klinisch onderzoek essentieel is voor innovatie. Het onderwerp staat inmiddels op de agenda van het samenwerkingsinitiatief en de Beneluxa landen verwelkomen bredere, internationale samenwerking op dit vlak. In die contacten zien de Beneluxa partners het vergroten van prijstransparantie tussen landen als belangrijk speerpunt.
Gezamenlijke verklaring van de Beneluxa leden over onethisch gedrag
Begin 2020 maakten de gezondheidsministers van België, Nederland, Luxemburg, Oostenrijk en Ierland zich grote zorgen over de plannen van Novartis en Avexis. De bedrijven wilden zonder duidelijke objectieve criteria door loting ernstig zieke kinderen met de dodelijke spierziekte SMA het geneesmiddel Zolgensma toewijzen, nog voordat het op de Europese markt zou komen. De ministers – verenigd in het Beneluxa-initiatief – namen gezamenlijk duidelijk stelling over het gedrag van de fabrikant. Zij gaven aan de inspanningen van de bedrijven te waarderen om een geneesmiddel te ontwikkelen voor een kwetsbare patiëntengroep, maar dat bij het uitdelen van een geneesmiddel, ook in een vroeg stadium, objectieve, medische criteria gehanteerd worden. Mede hierdoor wijzigden de bedrijven hun procedure.
Toekomstige uitdagingen en aandachtspunten
Voor het grootste deel van de bewezen effectieve geneesmiddelen hebben we met de ingezette maatregelen toegang voor patiënten tegen aanvaardbare kosten goed geborgd. We zijn er echter nog niet. We zien twee categorieën geneesmiddelen die in toenemende mate onze aandacht blijven vragen de komende jaren. Het gaat hier enerzijds om geneesmiddelen aan de zogenaamde onderkant van de markt, bijvoorbeeld met een hele lage omzet. Ik ga hier structureel meer aandacht aan geven. In het deel van deze brief dat gaat over de beschikbaarheid van geneesmiddelen ga ik daar dieper op in. Daarnaast blijf ik binnen de Wgp dit jaar de meer kwetsbare geneesmiddelen met een relatief lage omzet op verzoek ontzien van verdere prijsdalingen.38Anderzijds gaat het om de dure innovatieve geneesmiddelen met hoge totale uitgaven en/of hoge kosten per patiënt.
Uitdagingen bij dure geneesmiddelen
Het beschikbaar komen van nieuwe innovatieve geneesmiddelen is een goede ontwikkeling en geeft hoop voor patiënten op een betere kwaliteit van leven en soms zelfs genezing. Tegelijkertijd stellen deze geneesmiddelen ons op twee vlakken voor uitdagingen. Ten eerste zien we dat de prijzen en uitgaven van deze nieuwe innovatieve geneesmiddelen blijven stijgen. De fabrikanten van deze geneesmiddelen hebben in het algemeen een sterke positie (bijvoorbeeld als enige aanbieder) waardoor ze een hoge prijs kunnen vragen en er ook geen prikkel is de prijs te verlagen of inzicht te geven in de onderliggende kosten die deze hoge prijs zouden moeten rechtvaardigen. Dit brengt dilemma’s met zich mee. Hoeveel zijn we bereid voor deze geneesmiddelen te betalen om toegang voor patiënten te garanderen? En hoe stimuleren we fabrikanten om een maatschappelijk aanvaardbare prijs te vragen? Ten tweede zien we bij de pakketbeoordeling steeds vaker onzekerheden over de (relatieve) effectiviteit en kosteneffectiviteit van nieuwe behandelingen. Dat komt doordat het hier veelal gaat om complexe medisch-specialistische geneesmiddelen, geneesmiddelen die zich steeds meer richten op kleine patiëntenpopulaties en/of geneesmiddelen in een behandelveld waar innovaties elkaar snel opvolgen (zoals in de oncologie). Daardoor zijn er bij pakkettoelating bijvoorbeeld nog onduidelijkheden over de lange termijneffecten of hoe het geneesmiddel zich verhoudt tot de andere geneesmiddelen die er al zijn of nog aankomen. Dit brengt uitdagingen met zich mee voor het ZINL, beroepsgroepen of verzekeraars om snel een goed oordeel te geven over de toegevoegde waarde en de plek in de behandeling. Daarnaast geldt dat indien het middel voldoende bewezen wordt geacht en een patiënt toegang krijgt dit niet betekent dat alle vragen omtrent de effectiviteit van het geneesmiddel in de praktijk zijn opgelost. Zo kunnen er bijvoorbeeld nog vragen resteren over het gepast gebruik.
Aandachtspunten voor de toekomst
Een groot deel van de beleidsmaatregelen die al zijn ingezet, waaronder het Integraal pakket aan maatregelen (IPAM) dat met veldpartijen overeen is gekomen, richt zich ook op deze uitdagingen die de groep dure innovatieve geneesmiddelen met zich meebrengt. Tegelijkertijd zie ik drie specifieke aandachtspunten voor de toekomst om hier nog beter op in te kunnen spelen.
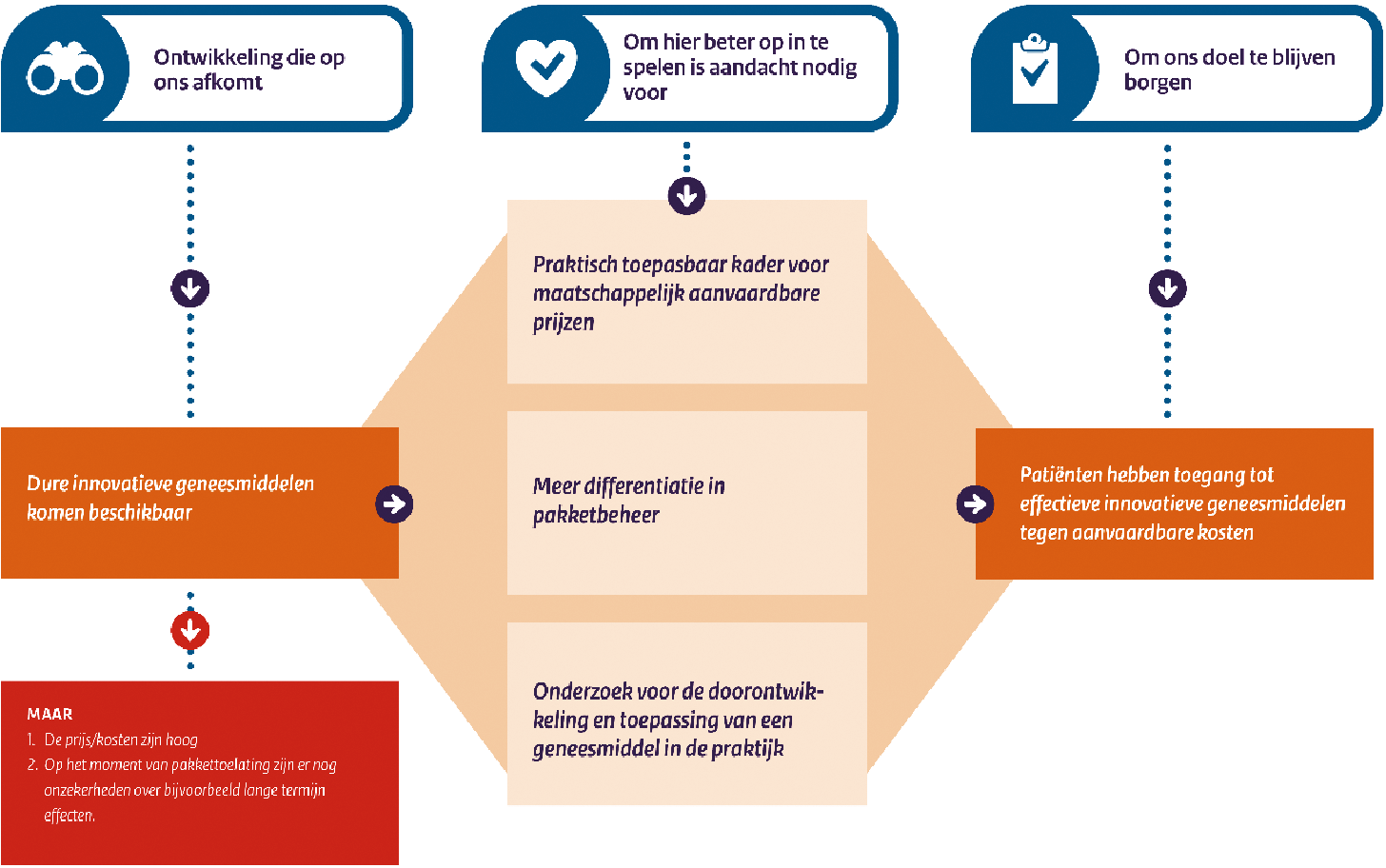
1. Een praktisch toepasbaar kader voor maatschappelijk aanvaardbare prijzen dat internationaal breder ondersteund wordt dient verder verkend te worden
Een van de meest weerbarstige onderwerpen is de prijsstelling van bepaalde innovatieve geneesmiddelen en de discussie over maatschappelijk aanvaardbare prijzen. In de afgelopen jaren heeft Nederland zich actief in internationale discussies gemanifesteerd over dit thema. Via financiële arrangementen, Beneluxa en Horizonscanning hebben we meer grip op de materie gekregen vanuit onze rol als onderhandelaar. Maar we zijn er nog lang niet. De hoge en steeds stijgende vraagprijzen van geneesmiddelen houdt de gemoederen in Nederland en daarbuiten terecht bezig. En we zien steeds weer behandelingen beschikbaar komen met prijzen waar we vraagtekens bij kunnen plaatsen. Een voorbeeld daarvan is het geneesmiddel Ibrutinib (Imbruvica) dat onlangs geregistreerd is als behandeling voor patiënten met een specifieke vorm van leukemie. De kosten bedragen bijna 70.000 euro per behandeling per jaar en de kosten voor een volledige behandeling (meerdere jaren) bedragen gemiddeld meer dan 200.000 euro. Momenteel onderhandel ik met de leverancier van dit geneesmiddel over de prijs. Hoewel het een duidelijke trend is, is het belangrijk om ook te benadrukken dat niet alle innovatieve geneesmiddelen buitensporig hoge prijzen hebben.
De kern van de zaak is dat we de prijs van een geneesmiddel maatschappelijk aanvaardbaar vinden als (1) het geneesmiddel kosteneffectief is (de gezondheidsuitkomsten staan in verhouding tot de extra kosten)39, (2) die zich in redelijke en proportionele mate verhoudt tot de inspanningen en investeringen die zijn gedaan om tot het geneesmiddel te komen40 en (3) deze voldoende ruimte biedt voor innovatie.
Deze drie elementen moeten met elkaar in balans zijn om betaalbare innovatie voor elkaar te krijgen, waarbij de meerwaarde van de innovatie voor patiënten de meerkosten vanuit het zorgbudget waard is. Dit is een delicate balans. Zo kan een op zichzelf kosteneffectieve prijs toch niet aanvaardbaar zijn als het volume in combinatie met de hoge prijs leidt tot kassuccessen met hoge winsten die de investeringen ver overstijgen. Er is dan vanuit het perspectief van de zorgbetaler sprake van buitensporige prijzen, omdat slechts een fractie van de betaalde prijs daadwerkelijk een relatie heeft met innovatie en productie. En ook als de elementen in balans met elkaar lijken kan het toch zijn dat er een grens is aan wat betaalbaar is. De uitgaven dienen immers te worden gefinancierd vanuit een beperkt zorgbudget en kunnen andere vormen van zorg verdringen. Voor het budget van één duur geneesmiddel zouden we immers wellicht veel meer patiënten kunnen behandelen met een andere interventie die in zijn totaliteit meer gezondheidswinst oplevert.
Dit blijft een complex vraagstuk en een uitdaging om te operationaliseren in beleid en handelingsopties. Daarbij zijn twee zaken randvoorwaardelijk.
a) Transparantie
Om het vergoeden van geneesmiddelen uit collectieve middelen te kunnen verantwoorden en om steeds weer een afweging te kunnen maken over de aanvaardbaarheid van prijzen van individuele geneesmiddelen is inzicht nodig in de opbouw en rechtvaardiging van prijzen van geneesmiddelen. Daarom vraag ik aan fabrikanten waarmee ik onderhandel om de vraagprijs nader te onderbouwen, en die daarmee te motiveren of rechtvaardigen om zo hun «licence to operate» te behouden. Dit heeft in de afgelopen jaren meer inzicht opgeleverd, maar nog lang niet voldoende. Het gaat dan niet alleen om inzicht in investeringen in onderzoek, maar ook om inzicht in de kapitaalkosten. Met het eerder genoemde onderzoek naar het financiële ecosysteem van geneesmiddelen-ontwikkeling, wil ik meer inzicht krijgen in de financiële transacties rondom innovatieve geneesmiddelenontwikkeling die de prijs uiteindelijk mede bepalen.
Het feit dat een groot aantal landen vertrouwelijke prijsafspraken maakt met als doel kosten te beheersen, werkt in het voordeel van fabrikanten. Daarom is het belangrijk om om inzicht te krijgen in de prijzen die in andere landen worden betaald. Landen moeten daarom een bewuste keuze maken om dit soort informatie met elkaar te delen.
Bij transparantie kun je ook denken aan beter inzicht in het aandeel publiek gefinancierd onderzoek bij de ontwikkeling van een geneesmiddel. In dit kader heeft de Tweede Kamer in een eerder debat geïnformeerd naar een initiatief in Frankrijk om een verplichting voor fabrikanten bij de vergoedingsaanvraag van nieuwe geneesmiddelen op te nemen dat zij de publieke investeringen in R&D van dat geneesmiddel inzichtelijk moeten maken. Ik heb u toegezegd te onderzoeken wat de voordelen en nadelen zijn van het Franse voorstel met betrekking tot transparantie en te kijken wat dit betekent voor de Nederlandse situatie in de brede zin. In de Nederlandse context zou een dergelijk voorstel in theorie kunnen leiden tot meer transparantie en lagere prijzen voor geneesmiddelen waarin veel publieke middelen zijn geïnvesteerd. Hoewel het voorstel door de «Assemblee Nationale» is aangenomen, is dit voorstel niet door de Franse regering overgenomen. De transparantie-eis wordt dan een verplichte voorwaarde voor vergoeding uit het verzekerde pakket. Het is de vraag of dit leidt tot het gewenste effect. Een denkbaar risico is dat fabrikanten bij een dergelijke verplichting een geneesmiddel niet op de Nederlandse markt introduceren, ten koste van de patiënt. Ook nu al zien we dat fabrikanten in een vertrouwelijke onderhandeling met het Bureau Financiële Arrangementen Geneesmiddelen van het Ministerie van VWS doorgaans niet bereid zijn tot transparantie, of prijsverlagingen op grond van het aandeel van publieke financiering. Bij een verplichte openbaarmaking van de prijsopbouw kunnen bedrijven het effect daarvan op andere, grotere markten zwaarder laten wegen. Daarnaast bestaat het risico dat bedrijven onderzoek niet langer in Nederland laten plaatsvinden om te voorkomen dat zij aan de transparantie-eis moeten gaan voldoen. Ik beschouw hiermee de toezegging als afgedaan. Het is aan een nieuw kabinet om te besluiten of ze deze optie verder willen verkennen.
b) (Juridisch) Kader maatschappelijk aanvaardbare prijzen dat internationaal breder wordt ondersteund
Meer expliciet invulling en uiting geven aan onze betalingsbereidheid en hoe die wordt begrensd zou de prijsvorming bij fabrikanten kunnen beïnvloeden, mits Nederland hierin niet solo opereert. Een enkel land kan immers niet een verandering in internationale prijsdynamiek bewerkstelligen. Dat zou vooral ten koste gaan van de toegankelijkheid tot innovatieve geneesmiddelen voor de eigen patiënten. We hebben in de afgelopen jaren veel contacten gehad met experts en direct betrokkenen (zoals medisch specialisten) over maatschappelijk aanvaardbare prijzen in meer algemene zin. Een van de conclusies daaruit is dat er een concreet afwegingskader nodig is om als publieke sector op voorspelbare en consistente wijze te beoordelen of een prijs maatschappelijk aanvaardbaar is. Het is wenselijk en effectiever om zo’n kader niet alleen in nationale context te ontwikkelen en toe te passen, maar samen met Europese partners. Onze uitvoeringspraktijk in de onderhandelingen rondom de financiële arrangementen en onze steeds sterkere Beneluxa samenwerking en andere internationale samenwerking vormen hiervoor een goede basis.
Ook heb ik een verkenning gedaan naar welke mogelijkheden de mededingingswetgeving biedt voor meer marktordening en regulering. In de mededingingswet kent men immers het begrip «onbillijk hoge» of «excessieve prijzen». Een voorzichtige conclusie is dat de mededingingswet en de jurisprudentie op deze punten onvoldoende handvatten geven om het begrip maatschappelijke aanvaardbare prijzen in te kaderen (afgezien voor zeer excessieve gevallen). Het begrip in de mededingingswet is in beginsel niet bedoeld voor prijsregulering. Het is in de formele wetgeving beperkt uitgewerkt en toepassing in de uitvoeringspraktijk blijkt niet eenvoudig. Er is daarom in de toekomst wellicht een nieuw (juridisch) kader nodig, dat meer gefocust is op prijsregulering en prijstransparantie.
Voor de bovenstaande oplossingsrichtingen geldt uiteraard wel dat er ook de (maatschappelijke en politieke) bereidheid moet zijn om dit beoordelingskader in de praktijk toe te passen. Dat houdt in dat in de onderhandelingen de ultieme consequentie (nee zeggen) aanvaardbaar moet zijn.
2. Toekomstbestendig pakketbeheer: De noodzaak van differentiatie en het kunnen stellen van (indien nodig afdwingbare) randvoorwaarden bij pakkettoelating
Ondanks de onzekerheden die nieuwe geavanceerde geneesmiddelen of snel elkaar opvolgende behandelmethoden met zich meebrengen is het van belang dat de effectiviteit van de verzekerde zorg zo goed als mogelijk wordt bewaakt en tegelijkertijd de tijdige toegang voor patiënten wordt geborgd. Om dit te kunnen blijven realiseren is a) meer differentiatie in pakketbeheer, b) het kunnen stellen van (indien nodig afdwingbare) randvoorwaarden en c) een betere aansluiting van financiering van onderzoek op pakketbeheer noodzakelijk.
a) Meer differentiatie in het pakketbeheer
Meer differentiatie in pakketbeheer wordt gerealiseerd doordat het ZINL, zoals ook blijkt uit de Kaderwetevaluatie, continue werkt aan de doorontwikkeling van haar pakketbeheer om in te spelen op nieuwe ontwikkelingen.41 Meer specifiek heeft het ZINL verschillende trajecten lopen die moeten leiden tot innovatieve manieren om in te spelen op de vraagstukken die de nieuwe geneesmiddelen door wetenschappelijke en technologische ontwikkelingen met zich meebrengen. Denk bijvoorbeeld aan nieuwe onderzoeksmethodieken en/of het op een verantwoorde manier mogelijk maken van meer differentiatie in het gehanteerde onderzoekskader en daaraan gerelateerd beoordelingskader. In de Kaderwetevaluatie wordt ook aandacht gevraagd voor differentiatie in pakketbeheer, specifiek voor nieuwe geneesmiddelen met een hoog gepersonaliseerd karakter waarvoor geen grote patiëntgroepen zijn. Uitgangspunt is en blijft dat geneesmiddelen die tot het pakket worden toegelaten voldoen aan de stand van de wetenschap en praktijk – en dus bewezen effectief moeten zijn – en het ZINL daarbij ook een uitspraak kan doen over de andere pakketcriteria kosteneffectiviteit, uitvoerbaarheid en noodzakelijkheid.
b) Randvoorwaarden bij pakkettoelating
Meer maatwerk in pakketbeheer betekent ook een toenemende noodzaak om meer (indien nodig afdwingbare) randvoorwaarden te stellen bij de pakkettoelating om met de vragen en onzekerheden om te gaan die op het moment van pakkettoelating nog kunnen spelen. Het kan hierbij gaan om vragen over effectiviteit of doelmatige toepassing. Ik verken met het ZINL of het mogelijk is de rol die het ZINL hierin heeft te versterken. Dit kan leiden tot meer instrumenten voor maatwerk in de toelating. Bijvoorbeeld door het stellen van afdwingbare voorwaarden voor verder onderzoek naar de relatieve effectiviteit en kosteneffectiviteit van een geneesmiddel of gepast gebruik en gepast gebruik onderzoek. Evaluatie in de praktijk krijgt hiermee een grotere rol (cyclisch pakketbeheer). Ik voel mij hierin gesteund door de recente motie van het lid Van den Berg c.s.42
c) Aansluiting financiering onderzoek op pakketbeheer
Op het moment dat het Zorginstituut bij pakkettoelating adviseert dat verder onderzoek in de praktijk noodzakelijk is om doelmatige verzekerde zorg te waarborgen, dan moet de financiering geen bottleneck zijn om dit uit te voeren. Op dit moment ontbreekt een koppeling tussen het pakketadvies en het proces om in aanmerking te komen voor een subsidie voor gepast gebruik onderzoek. Ik ga onderzoeken hoe een betere aansluiting tussen de voorwaarden gesteld bij pakkettoelating en financiering voor onderzoek gerealiseerd kan worden en hoe dit zich verhoudt tot de rol van de industrie in de financiering van onderzoek.
3. Het belang van vervolg- en uitkomstenonderzoek voor de doorontwikkeling en toepassing van een geneesmiddel in de praktijk neemt toe
Geneesmiddelen moeten op een effectieve en doelmatige manier worden ingezet zodat ze een positieve bijdrage leveren aan de kwaliteit van leven van een patiënt, en de betaalbaarheid in oog gehouden wordt. Om dit beter te kunnen borgen wordt vervolgonderzoek in de praktijk voor de doorontwikkeling en toepassing van een geneesmiddel steeds belangrijker. De onzekerheden bij de nieuwe innovatieve geneesmiddelen over de (relatieve) effectiviteit en kosteneffectiviteit op het moment van pakkettoelating nemen immers toe. Ook als het ZINL heeft geoordeeld dat een geneesmiddel bewezen effectief is en voor vergoeding voor patiënten in aanmerking komt, kunnen er nog steeds vragen zijn. Denk aan vragen over de effectiviteit bij specifieke patiëntengroepen, wat de meest optimale dosering is of de effecten op de lange termijn. Dit geldt overigens niet alleen voor de groep nieuwe innovatieve geneesmiddelen, ook bij andere geneesmiddelen kunnen deze vragen spelen. De kosten lopen hier vooruit op de baten. Om dit goed tot stand te laten komen is behoefte aan (a) een adequate data-infrastructuur en (b) grote praktijkstudies gepast gebruik geneesmiddelen.
Investeren in uitkomstenonderzoek dient meerdere doelen:
Uitkomstenonderzoek kan aanvankelijke onzekerheid over effectiviteit en effectieve toepassing van nieuwe behandelingen mitigeren en zo bijdragen aan maatwerk in het pakketbeheer, dit komt de verzekerde toegang ten goede.
Uitkomstenonderzoek biedt meer inzicht in de effectieve en gepaste toepassing van de behandeling in de praktijk en verbetert zo de kwaliteit van zorg
Uitkomstenonderzoek biedt meer inzicht in doelmatig gebruik en gepaste inzet van nieuwe behandelingen en draagt zo bij aan de betaalbaarheid
Investeren in uitkomstenonderzoek versterkt Nederland als kennisland en de data infrastructuur
a) Een adequate data-infrastructuur voor inzicht in uitkomsten. Alles begint bij een passende data-infrastructuur. Dit is een randvoorwaarde voor het doen van goed onderzoek en het kunnen leren van de ervaringen en uitkomsten van het gebruik van geneesmiddelen in de praktijk. Met als uiteindelijk doel betere uitkomsten voor de kwaliteit van zorg voor patiënten en betaalbaarheid. Om een goede data-infrastructuur te borgen werkt het ZINL aan het project Regie op Registers dure geneesmiddelen (RoRDGM). In de recente Kamerbrief over gepast gebruik heb ik uw Kamer hierover een update verzonden.43 Op dit moment is een van de belangrijkste knelpunten waar individuele registers mee te maken hebben het ontbreken van structurele financiering. In andere landen is daar al wel meer ervaring mee. Binnen RoRDGM wordt een advies opgesteld met betrekking tot de toekomstige financiering van registers. Momenteel worden de huidige trajecten betaald door middel van publieke en private gelden. Idealiter zouden we in de toekomst willen dat beide geldstromen beschikbaar blijven om de registers structureel te financieren. Ik wil verkennen hoe dit traject een sterkere impuls kan krijgen, omdat het een randvoorwaarde is voor het verder vormgeven van betere en betaalbare zorg met behulp van gepast gebruik, uitkomstgerichte zorg en cyclisch pakketbeheer. Hiervoor zal ik de komende tijd de mogelijke impuls verder uitwerken en uw Kamer in 2021 verder informeren, zoals ook toegezegd naar aanleiding van de motie van dhr. Veldman bij de begrotingsbehandeling.44
b) Behoefte aan grote praktijkstudies gepast gebruik geneesmiddelen
Het belang van gepast gebruik van geneesmiddelen is groot, voor de betaalbaarheid en juist ook voor de kwaliteit van de zorgverlening aan de patiënt. Als iemand bijvoorbeeld ook toe kan met een lagere dosering van een geneesmiddel, dan is dat niet alleen goed voor de betaalbaarheid, het brengt het ook minder risico op bijwerkingen met zich mee. Vanuit IPAM actielijn 5 is onderzocht welke bronnen van financiering er zijn voor gepast gebruik. Veel onderzoeksvoorstellen worden ingediend en gehonoreerd via het Goed Gebruik Geneesmiddelen programma bij ZonMw. Echter niet alle initiatieven kunnen worden gehonoreerd. Er is een knelpunt bij grote multicenter onderzoeken waarvoor het budget van ZonMw niet toereikend is, terwijl juist deze onderzoeken veel baten met zich mee kunnen brengen (zoals de SONIA-trial). In de eindrapportage van Platform inkoopkracht wordt hier ook aandacht voor gevraagd. Deze studies verdienen tijdens de studieduur de investering reeds terug en leiden uiteindelijk tot een verlaging van de totale macro budgettaire kosten met betere of gelijke kwaliteit van zorg. Ik ben dan ook aan het onderzoeken hoe deze gefinancierd kunnen worden.
Een verdere verkenning en/of uitwerking van bovenstaande drie aandachtspunten heeft mijn volle aandacht. De verdere doorontwikkeling van het geneesmiddelenbeleid en de keuzes die hierin gemaakt worden zijn uiteraard aan een volgend kabinet.

Voor patiënten is belangrijk dat de geneesmiddelen die zij gebruiken ook daadwerkelijk beschikbaar zijn en blijven. Geneesmiddelentekorten zijn een hardnekkig mondiaal probleem, waar we ook in Nederland al enige tijd hinder van ondervinden.
Om (dreigende) tekorten tijdig te kunnen signaleren is op 1 januari 2017 het Meldpunt geneesmiddelentekorten en -defecten (hierna: het Meldpunt) opgericht. Het Meldpunt speelt sindsdien een cruciale rol bij het verzamelen van informatie over (dreigende) tekorten en het inzetten van acties om de gevolgen voor patiënten te verkleinen. Bij het Meldpunt melden bedrijven (verwachte) leveringsproblemen. In 2017 zijn 536 meldingen van verwachte leveringsproblemen ontvangen, in 2018 waren dat er 1390 en in 2019 3070.45 De stijging is deels te verklaren door meer bekendheid met het Meldpunt. In de cijfers van 2020 zien we, ondanks de aanvullende onzekerheden rondom de beschikbaarheid door de COVID-19 crisis, een afvlakking van de groei (3723 meldingen). De cijfers van 2020 zijn als bijlage VI46 toegevoegd.
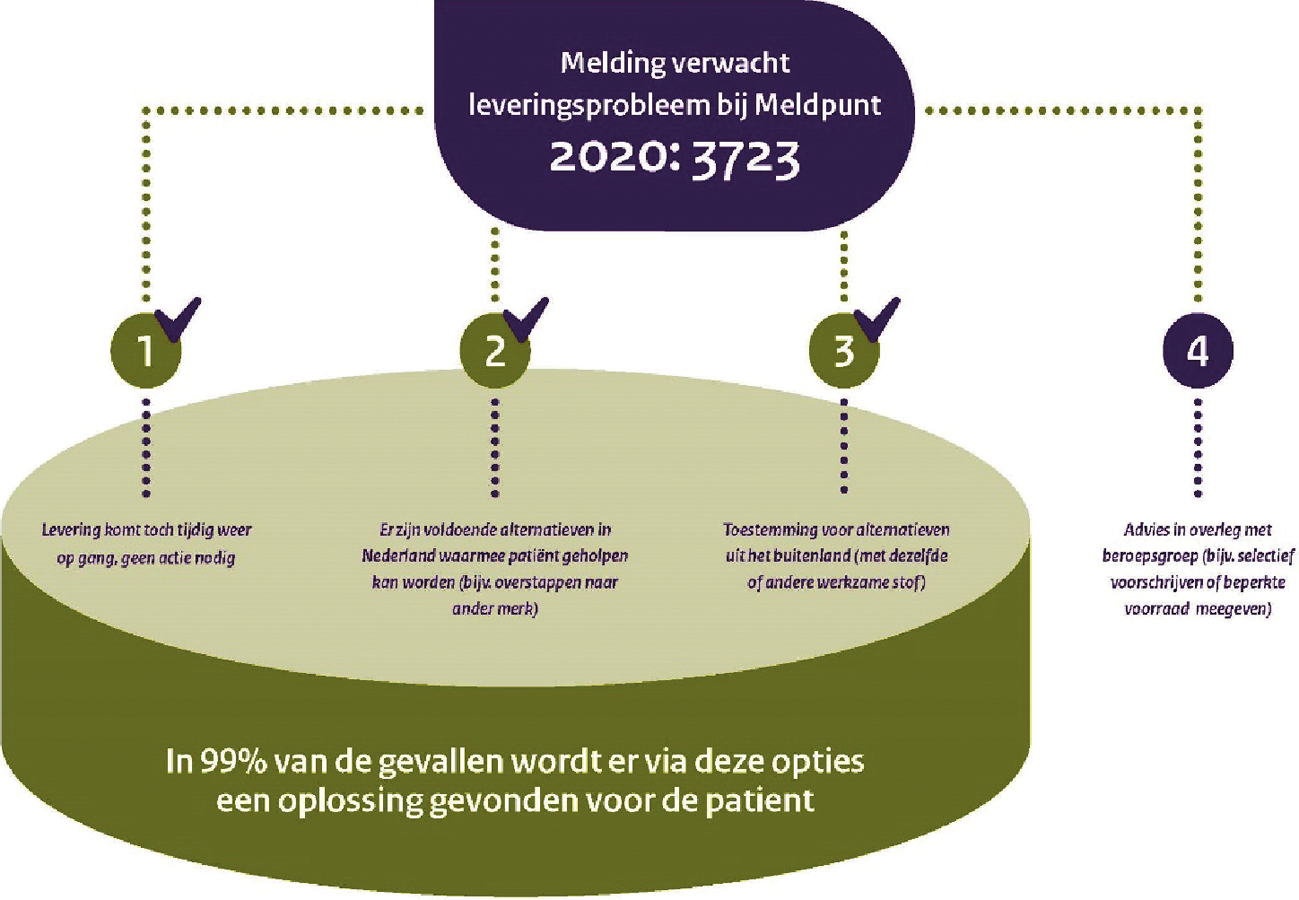
Een melding wil niet zeggen dat er ook daadwerkelijk een tekort aan het geneesmiddel ontstaat. In 99% van de gevallen is er gelukkig een oplossing voor de patiënt. Soms blijkt dat er alsnog voldoende voorraad in de keten aanwezig is om het leveringsprobleem op te vangen. Daarnaast zijn er voorde meeste geneesmiddelen met leveringsproblemen voldoende alternatieven beschikbaar met dezelfde werkzame stof, (vergelijkbare) sterkte en toedieningsvorm of kunnen producten uit het buitenland een uitkomst bieden. In de uitzonderlijke gevallen waarin er geen alternatieven zijn, wordt in overleg met de beroepsgroep besloten wat de beste oplossing is. Het CBG kan dan een advies publiceren, bijvoorbeeld om het geneesmiddel alleen voor te schrijven aan patiënten die niet kunnen wisselen. Dit betreft gemiddeld circa 3 geneesmiddelen per jaar.
Hoewel vrijwel altijd een oplossing kan worden gevonden, kost het zoeken naar beschikbare alternatieven zorgverleners kostbare tijd en capaciteit en ook voor patiënten is het moeten uitwijken naar een alternatief in sommige gevallen vervelend.
Lessons learned COVID-19
Een groot deel van vorig jaar stond in het teken van de COVID-19 crisis. Dit geldt ook voor de inzet bij het voorkomen van geneesmiddelentekorten. Wegens een wereldwijd toegenomen vraag naar bepaalde geneesmiddelen en signalen over kwetsbaarheden van de keten (bijvoorbeeld wegens verminderde productiecapaciteit en verstoringen in de logistieke keten door lockdowns) waren zowel veldpartijen als overheid extra alert.
Uw Kamer is meerdere malen geïnformeerd over de aanvullende maatregelen die zijn ingezet om geneesmiddelentekorten als gevolg van de COVID-19 crisis zoveel als mogelijk te voorkomen.47 Kortgezegd kwam de aanpak neer op (i.) een intensievere vorm van informatie-uitwisseling tussen overheid en veldpartijen zodat actualiteiten en oplossingsrichtingen tijdig gedeeld konden worden en (ii.) het proactief monitoren van geneesmiddelen met een beschikbaarheidsrisico. Zo is afgelopen maart het Landelijk Coördinatiecentrum Geneesmiddelen (LCG) opgericht, een initiatief van de Nederlandse Vereniging van Ziekenhuisapothekers (NVZA). Het LCG volgt nauwkeurig de beschikbaarheid van een lijst van coronagerelateerde (IC-)medicatie. Ziekenhuizen, leveranciers en groothandels leverden hiervoor data aan over de beschikbare voorraden. De IGJ en het CBG hebben (preventieve) acties ondernomen om mogelijke tekorten van deze geneesmiddelen te voorkomen (door veterinaire medicatie toe te staan, preventieve tekortenbesluiten te nemen en toestemming te verlenen voor het onderling uitwisselen van geneesmiddelen). Op dit moment wordt in de ziekenhuizen voor deze geneesmiddelen een COVID Crisis Voorraad (CCV) aangelegd. Nadat de CCV is aangelegd, zal het LCG zich richten op het monitoren van de beschikbaarheid van deze voorraden in de ziekenhuizen. Daarnaast waren de fabrikanten en groothandels een vrijwillige, tijdelijke monitor gestart voor een risicogerichte lijst van additionele geneesmiddelen. Ik wil alle partijen complimenteren voor hun inzet en medewerking de afgelopen maanden. Dankzij hun inspanning en goede onderlinge samenwerking konden acute, onoplosbare tekorten waarvoor geen passende alternatieven waren, worden voorkomen.
De tijdelijke, vrijwillige monitoring van fabrikanten en groothandels is onlangs door veldpartijen geëvalueerd. Hieruit bleek kortgezegd dat de monitor in de aanvankelijk zeer onzekere tijden rust heeft gebracht. Ook heeft het opzetten van de monitor een positief effect gehad op de samenwerking tussen partijen. Tegelijkertijd zijn er wel vragen of de inzet van een monitor achteraf bezien noodzakelijk was en of het in de gekozen vorm een toegevoegde waarde heeft gehad op het voorkomen van tekorten. Daar waar beschikbaarheidsproblemen dreigden voor de gemonitorde geneesmiddelen, konden deze tijdig worden opgelost. Mogelijk was dit ook gebeurd binnen de reguliere werkzaamheden van het Meldpunt. In het kader van de uitwerking van de ijzeren voorraad bekijk ik samen met partijen welke vorm van monitoring effectief is. Hierbij worden de lessen uit de evaluatie betrokken. Zoals toegezegd in de schriftelijke reactie op de initiatiefnota Veldman over structurele weerbaarheid van de medische industrie in crisistijd, worden dit jaar ook andere ingezette maatregelen geëvalueerd om lessen te kunnen trekken voor de toekomst.48 Het gaat dan onder andere om de inzet van het Coronaberaad en het Landelijk Coördinatiecentrum Geneesmiddelen.
Samenwerking in Europa
Om tekorten effectief tegen te gaan, moeten de oorzaken worden aangepakt. De oorzaken van tekorten zijn echter complex. Het betreft een internationale keten die steeds kwetsbaarder is geworden door een kleiner aantal productieplaatsen voor grondstof en eindproduct in voor een groot deel derde landen (waaronder China en India) en een verkleining van het aantal voorraden in de keten.
Omdat de oorzaken deels grensoverschrijdend zijn, kunnen bepaalde oorzaken alleen op internationaal niveau aangepakt worden. Daarom ben ik blij dat na aandringen van onder andere Nederland, de Europese Commissie op dit moment onderzoek doet naar de oorzaken van geneesmiddelentekorten en mogelijke oplossingsrichtingen. De resultaten van dit onderzoek verwacht ik rond september 2021.
Door de COVID-19 crisis staat de aanpak van (onder andere) geneesmiddelentekorten nog nadrukkelijker op de Europese agenda. Op Europees niveau werd al eerder informatie uitgewisseld over tekorten in de verschillende lidstaten via het SPOC netwerk. Tijdens de crisis is gezocht naar aanvullende manieren om Europees samen te werken, onder andere in de werkgroep «EU Executive Steering group on shortages of medicines caused by major events». Hierbinnen was onder andere een pilot gestart om op Europees niveau gegevens over vraag en aanbod bij elkaar te brengen middels een monitoringssysteem. Nederland heeft ook deelgenomen aan deze pilot. Het ging over vijf geneesmiddelen waarvan de beschikbaarheid door COVID-19 als kwetsbaar werd gezien. De pilot levert waardevolle inzichten op. Tegelijkertijd zie ik dat het verder uitdenken en uitwerken van een dergelijk Europees monitoringssysteem nog veel haken en ogen kent, zowel met betrekking tot het compleet krijgen van de data en een toename van administratieve lastendruk als overeenstemming over de acties die moeten volgen op basis van de gegenereerde informatie. Het is daarom nog te vroeg om te concluderen of de voorgestelde wijze van samenwerking een waardevolle toevoeging is.
In recente Europese initiatieven, zoals de EU farmaceutische strategie en het EU Gezondheidsuniepakket en het eerdere EU4health programma, is aandacht voor geneesmiddelentekorten en het nader onderzoeken en implementeren van kansrijke aanvullende Europese oplossingsrichtingen. De nieuwe voorstellen van de Europese Commissie voor de aanpak van tekorten richten zich op mogelijke strengere leverings- en transparantieverplichtingen, eerdere melding van leveringsproblemen en het uit de handel nemen van geneesmiddelen bij de autoriteiten en sterkere EU-coördinatie en -mechanismen om tekorten te monitoren, te beheersen en te voorkomen. Ik heb uw Kamer in de vorm van BNC-fiches bericht over deze voorstellen.
Leveringszekerheid
Al ruim voor de coronacrisis hebben mijn voorgangers de afhankelijkheid van een kleine groep landen en de kwetsbaarheid van productieketens op de Europese agenda gezet. Immers, kwetsbaarheden in de internationale handelsketens en onwenselijke afhankelijkheden raken Nederland en Europa. De coronacrisis heeft deze bestaande zorgen extra blootgelegd. Afhankelijkheden van één land of één individuele leverancier moeten daarom zo mogelijk voorkomen worden.
Het borgen van de leveringszekerheid van geneesmiddelen blijft dan ook een belangrijke prioriteit. Hierbij geldt dat we als Nederland sterker zijn als we op Europees en internationaal niveau strategisch samenwerken. We trekken op dit thema nauw samen op met de Europese Commissie en andere landen en zijn proactief als het gaat om Europese agendering en koersbepaling. Momenteel bespreek ik op Europees niveau de mogelijkheden van het versterken van de productie in Europa en in Nederland. De Europese Commissie is in het kader van de implementatie van de farmaceutische strategie met twee acties gestart. Als eerste wil zij samen met de lidstaten en een brede groep stakeholders in 2021 werken aan het vergaren van meer kennis, informatie en data om de redenen en oorzaken van kwetsbaarheden van de geneesmiddelenketens te analyseren. Dit biedt een solide, evidence based basis om vervolgens in 2022 te werken aan concrete beleidsvoorstellen of maatregelen. Het is hierbij belangrijk om niet alleen naar de productie van eindproducten te kijken, maar ook naar de benodigde grondstoffen of halffabricaten. Ik heb mij er dan ook voor ingezet dit te laten opnemen in de door het Duitse Voorzitterschap van de Raad opgestelde Raadsconclusies. Ten tweede wil de Europese Commissie in het kader van het op de lange termijn versterken van de open strategische autonomie van de EU verkennen of ze samen met de lidstaten kan werken aan een EU lijst van kritische geneesmiddelen. Er zijn landen binnen en buiten de EU die over dergelijke lijsten beschikken (hoewel vaak op verschillende gronden) en er zijn landen zonder. Ik zie vanuit die optiek een mogelijke meerwaarde in een gemeenschappelijke EU lijst van kritische geneesmiddelen. Vanwege deze recente bewegingen en de proactieve rol die Nederland al jaren heeft op leveringszekerheid, ga ik met de Europese Commissie en andere lidstaten in gesprek over de haalbaarheid en mogelijkheden voor het opstellen van een EU lijst met kritische medische producten. Ik wil hier meedenken over de aanpak en goed kijken naar de criteria om te bepalen wat een «kritisch geneesmiddel» is. Relevant is ook het voornemen van de Europese Commissie om een Health Emergency Response Authority (HERA) op te richten. Het voorstel hiertoe wordt eind 2021 verwacht. Het volgende kabinet zal dit op zijn merites beoordelen en goed kijken hoe HERA zou kunnen bijdragen aan het versterken van de leveringszekerheid en de productie in Europa.
Bij het kijken naar productie, wil ik optimaal benutten wat in Nederland al mogelijk is. Het behoud van de grootste generieke geneesmiddelenfabriek in Nederland (voormalig Apotex) acht ik van belang voor onze leveringszekerheid. Ik heb u samen met de Staatssecretaris van EZK op 18 december 2020 geïnformeerd over de lening die is verstrekt aan het Nederlandse initiatief InnoGenerics voor de inmiddels gerealiseerde overname van Apotex.49 Het is niet haalbaar dat we voor alle geneesmiddelen in Europa of Nederland eigen productie kunnen realiseren. Als het gaat om meer productie vind ik het belangrijk dat we inzetten op innovatieve, efficiënte, duurzame en schonere productieprocessen en daarin het verschil maken ten opzichte van andere landen. Daarnaast wordt vanzelfsprekend ook ingezet op producten met hoge kwaliteitseisen. Hierbij wil ik benadrukken dat het versterken van de bestaande nationale of Europese productie één van de verschillende manieren is waarop we leveringszekerheid kunnen borgen.50 Er zal onder andere ook gekeken worden naar mogelijkheden om diversificatie van de ketens te stimuleren en in hoeverre het betrekken van duurzaamheids- of leveringszekerheidstendercriteria bij inkoop mogelijk en effectief is.51 Bij dit laatste geldt wel als kanttekening dat de overheid in het geneesmiddelendomein niet de inkopende partij is, met uitzondering van bijvoorbeeld het Rijksvaccinatieprogramma.
De Nederlandse behoeften en inzet ten aanzien van leveringszekerheid wil ik met input van veldpartijen vaststellen. Hiervoor worden onder andere begin maart 2021 verschillende ronde tafels georganiseerd. De resultaten neem ik in 2021 mee in het vormen van een strategische beleidsrespons en in mijn onderhandelingen op EU niveau.
Nationale aanpak
Europese oplossingsrichtingen zijn noodzakelijk om bepaalde oorzaken van tekorten in de keten te kunnen adresseren. Tegelijkertijd zijn dit onzekere trajecten van de lange adem en zijn er ook nationale oplossingsrichtingen die een cruciale rol (kunnen) spelen bij het verkleinen van de gevolgen van tekorten voor de Nederlandse patiënten aan de balie. We zien dat ook in andere lidstaten dat er verschillende nationale oplossingsrichtingen worden geïmplementeerd om tekorten te aan te pakken.
Verschillende partijen, waaronder firma’s, groothandels, apothekers, zorgverzekeraars en de relevante overheidspartijen, werken in de werkgroep geneesmiddelentekorten samen aan de problematiek. Er zijn al verschillende maatregelen uitgewerkt en geïmplementeerd. Het RIVM heeft vorig jaar een evaluatie uitgebracht over het maatregelenpakket. Het RIVM concludeert dat het maatregelenpakket een belangrijke rol speelt bij het verkleinen van de gevolgen voor patiënten, maar dat ze niet of nauwelijks tekorten voorkomen.
Een van de maatregelen is de oprichting van het Meldpunt. Het Meldpunt onderneemt naar aanleiding van meldingen indien nodig actie om de gevolgen van dreigende of reeds ontstane leveringsproblemen te verkleinen. Op dit moment wordt gewerkt aan de doorontwikkeling van het Meldpunt. De twee voornaamste doelen zijn het optimaliseren van het meldproces en het actief publiceren van toegankelijke informatie over leveringsproblemen. Dit moet, in lijn met de aangenomen motie Dik-Faber, dienen als toegankelijke informatiebron voor voorschrijvers en apothekers.52 Eind 2021 zal deze publicatiefunctie gereed zijn.
Het Meldpunt rapporteert ook over het aantal geneesmiddelen dat ieder jaar definitief van de markt wordt gehaald. Terugtrekkingen kunnen leiden tot (structurele) beschikbaarheids-problemen. Het CBG zet zich bij meldingen over terugtrekkingen in om producten waarvoor geen alternatief meer beschikbaar is, te behouden voor de Nederlandse markt. Het lukt echter niet altijd omdat sommige partijen niet geïnteresseerd zijn om het alternatief in Nederland te registreren. Ook in Europa zie ik verscherpte aandacht voor deze problematiek.
Sommige veldpartijen hebben hun expliciete zorgen uitgesproken over de beschikbaarheid van geneesmiddelen aan de zogenaamde «onderkant van de markt», bijvoorbeeld geneesmiddelen met een hele lage omzet. Afgelopen zomer is toegezegd dat er structureel meer aandacht zal zijn hiervoor.53 Ten aanzien van deze kwetsbare geneesmiddelen bestaat zowel bij VWS als in het veld behoefte aan meer inzicht in de werking van dit deel van de geneesmiddelensector. Een door VWS uit te zetten onderzoek beoogt meer inzicht te geven in wat precies onder dit deel van de geneesmiddelensector moet worden verstaan en welke vraagstukken hier spelen. Door het analyseren van data zal de relatie tussen prijzen, omzet, aantal aanbieders en beschikbaarheid inzichtelijker worden gemaakt om zo de oorzaken van problemen beter te kunnen achterhalen. Ook zal dit onderzoek analyseren wat het effect en de samenhang is van het beleid en gedrag van de overheid, verzekeraars, apotheken, groothandels en fabrikanten. Zo kan ook beter van te voren worden ingeschat wat nieuw beleid voor effect zal hebben. De regie over het onderzoek ligt bij VWS, maar de input van partijen neem ik graag mee, om daarmee alle relevante vragen te kunnen betrekken. Mijn verwachting is dat het onderzoek in het voorjaar kan starten en na de zomer is afgerond. Het onderzoek zal dan worden gepubliceerd.
In het RIVM rapport worden de gemaakte afspraken over export beschreven. Het importeren en exporteren van geneesmiddelen is onderdeel van de normale bedrijfsvoering van onder andere groothandels. Deze handelingen dragen in sommige gevallen ook bij aan het voorkomen of oplossen van tekorten, doordat er voorraden uit het buitenland binnengehaald kunnen worden om een leveringsprobleem in Nederland te overbruggen. Tegelijkertijd kan parallelexport ook een rol spelen bij het ontstaan van tekorten. De Europese Commissie benoemt in haar farmaceutische strategie parallelhandel als een van de mogelijke oorzaken van tekorten. Er zijn in Nederland afspraken gemaakt dat in het geval van (dreigende) tekorten, de schaarse voorraad niet geëxporteerd zal worden. Sommige veldpartijen geven aan dat aanvullende afspraken en/of maatregelen nodig zijn op dit terrein. Door de open, interne markt is dit echter slechts beperkt mogelijk. Op Europees niveau zijn richtsnoeren gepubliceerd over het inzetten van exportbeperkingen in het geval van geneesmiddelentekorten. Lidstaten hebben dit op verschillende manieren geïmplementeerd. Naar verwachting zal de Europese Commissie de rol van parallelhandel ook betrekken in haar lopende onderzoek. Ik wil op basis van de resultaten van dit onderzoek bespreken met partijen wat in Nederland eventueel aanvullend nodig en effectief is.
Met veldpartijen werk ik daarnaast aan de implementatie van de ijzeren voorraad. De ijzeren voorraad moet zorgen voor een verhoging van de voorraden in de geneesmiddelenketen, zodat er meer weerbaarheid is om tijdelijke leveringsonderbrekingen beter op te vangen. Zo kunnen de gevolgen voor patiënten verkleind worden. Momenteel werken we verschillende vraagstukken uit rondom de invulling van de ijzeren voorraad, de handhaving, monitoring en de wijze van financiering. Bij de uitwerking houd ik rekening met de motie van het lid Veldman.54 Hierin heeft u gevraagd om maatwerk toe te passen bij de ijzeren voorraad (geen one-size-fits-all benadering) en om rekening te houden met de aanpak in andere Europese landen. Zoals beschreven in de Kamerbrief van 7 juli vindt de opbouw plaats via een gefaseerde, lerende wijze en in goed overleg met partijen.55 Begin 2021 vindt het eerste evaluatiemoment plaats, kort hierna zal ik u over de voortgang informeren.
De beschikbaarheid van geneesmiddelen kan ook in het geding komen door een recall. Om tekorten te voorkomen wordt bij een kwaliteitsdefect zorgvuldig de afweging gemaakt of er voldoende alternatieven beschikbaar zijn. Als dit niet het geval is, kan worden besloten niet over te gaan op een recall wanneer het risico van het niet gebruiken van het geneesmiddel groter is dan het gevonden kwaliteitsdefect. Over de afwikkeling van de kosten van recalls vindt nog overleg plaats tussen verzekeraars, apothekers en fabrikanten. Ik zal de Kamer berichten over de uitkomsten van dat overleg zodra die er zijn.
Vooruitblik
Ik concludeer dat er door verschillende partijen in de afgelopen jaren al veel stappen zijn gezet om geneesmiddelentekorten te adresseren. Aanvullende maatregelen zijn echter nodig. Zoals beschreven zal dit een combinatie moeten zijn van de inzet van Europese samenwerking om bepaalde oorzaken te kunnen adresseren en het maximaal verzilveren van nationale oplossingsrichtingen om de gevolgen voor patiënten aan de balie zoveel mogelijk te verkleinen. Hierbij ben ik me er bewust van dat er geen easy fixes zijn en dat we goed moeten waken voor de neveneffecten van de maatregelen die we nemen.
Overig
De beschikbaarheid van geneesmiddelen mag niet afhankelijk zijn van de woonplaats van een patiënt («postcodegeneeskunde»). Mijn voorganger heeft de NZa eerder verzocht om in de volgende monitor specifiek aandacht te besteden aan toegankelijkheid en dat is ook gebeurd in de monitor van mei 2020. Hieruit bleek dat er geen sprake was van postcodegeneeskunde. Hiermee is uitwerking gegeven aan de motie van het lid Van Gerven.56
Ten slotte informeer ik uw Kamer graag over de beschikbaarheid van medicinale cannabis en de stand van zaken van de leveringen aan Duitsland en Italië. Voor Duitsland (sinds 2016) en Italië (sinds 2017) wordt bij hoge uitzondering van een interne richtlijn voor de export van medicinale cannabis afgeweken om deze landen te helpen om in de groeiende behoefte te voorzien van patiënten aan medicinale cannabis totdat beide landen hiertoe zelf in staat zijn. U bent hier door mijn ambtsvoorgangers steeds over geïnformeerd.57
De export van medicinale cannabis komt de beschikbaarheid van medicinale cannabis voor patiënten in Nederland ten goede doordat de prijs hierdoor relatief laag gehouden wordt. Ook wordt met de extra inkomsten onderzoek naar de werking van medicinale cannabis bekostigd. In mijn brief van 14 oktober jl. heb ik u hier nader over geïnformeerd.58
In Duitsland is in 2017 beleid ingezet (o.a. de inwerkingtreding van wet- en regelgeving in 2017 om de teelt, distributie en beschikbaarheid van medicinale cannabis te reguleren) om zelf te kunnen voorzien in de behoefte van patiënten. Mijn Duitse ambtscollega heeft kenbaar gemaakt dat vanwege de COVID-19 pandemie rekening moet worden gehouden met vertragingen bij de eerste leveringen door de drie gecontracteerde bedrijven aan het Duitse overheidsbureau (Bfarm). Reden is dat de eerste oogsten pas vanaf het eerste kwartaal van 2021 worden verwacht. Omdat het – weliswaar grote – aantal Duitse patiënten dat medicinale cannabis gebruikt constant blijft, heeft Duitsland voor 2021 verzocht om dezelfde hoeveelheid als in 2019 en 2020, namelijk max. 2.500 kg.
In Italië neemt de productie van medicinale cannabis jaarlijks toe. Het is echter nog niet mogelijk om alle soorten medicinale cannabis te produceren waar patiënten behoefte aan hebben. Derhalve heeft Italië voor 2020 verzocht om een additionele 250 kg bovenop de reeds geleverde 750 kg en is voor 2021 een verzoek ingediend voor 1.000 kg. Het Bureau voor Medicinale Cannabis (BMC) kan op grond van de huidige productiecapaciteit max. 900 kg per jaar leveren aan Italië.
Door beide landen wordt gewerkt aan het zelf kunnen voorzien in de binnenlandse behoefte van patiënten aan medicinale cannabis. Vooral Duitsland heeft hier reeds vergaande stappen in gezet. Op grond daarvan heb ik in overleg met het BMC besloten om de verzoeken van beide landen voor 2021 te honoreren onder de voorwaarde dat de huidige productiecapaciteit niet wordt overschreden.

Zoals ook in de geneesmiddelenvisie gesteld, draait het geneesmiddelenbeleid om het zorgen voor toegang tot waardevolle geneesmiddelen waar patiënten behoefte aan hebben. Hier hoort ook goede zorgverlening bij: goede begeleiding in het juist gebruiken van middelen, dus niet te veel en niet te weinig, niet te snel beginnen, maar ook niet onnodig lang door gaan. Mensen moeten op het juiste moment geïnformeerd worden over het gebruik van medicijnen, maar ook het niet (meer) hoeven gebruiken van medicijnen. Er wordt helaas nog steeds een onnodig grote hoeveelheid patiënten opgenomen in het ziekenhuis vanwege incidenten met medicatie. Op diverse manieren wordt er aan gewerkt om dat te voorkomen. Ik onderscheid verschillende elementen in mijn beleid ten behoeve van goede farmaceutische zorg.
A. Informatie voor zorgverleners en patiënten
B. Samenwerking tussen zorgverleners
C. Kennis over effectief medicijngebruik
Toegankelijke informatie voor patiënten
Goede informatievoorziening is een onmisbare stap in het juist gebruiken van geneesmiddelen en medicatieveiligheid. Actuele en onafhankelijke informatie voor zorgverleners draagt bij aan doelmatig, gepast en veilig voorschrijven en afbouwen. Betrouwbare en begrijpelijke informatie voor patiënten helpt hen met het gebruiken op zo’n manier dat zij het meeste baat hebben van het medicijn. Het Ministerie van VWS ondersteunt diverse organisaties om informatie te verzamelen en te delen met doelgroepen van patiënten en zorgverleners.
Eind 2018 heeft mijn ambtsvoorganger het startschot gegeven voor het Netwerk Patiënteninformatie (NPI). Dit netwerk bestaat uit vier websites met medicijninformatie: apotheek.nl (KNMP), thuisarts.nl (NHG), geneesmiddeleninformatiebank.nl (CBG) en lareb.nl (Bijwerkingencentrum Lareb). Het onderzoeksinstituut Nivel, Expertisecentrum gezondheidsverschillen Pharos en Patiëntenfederatie Nederland geven het netwerk advies. Inmiddels zijn de verschillende websites onderling met elkaar verbonden. Daarnaast heeft het NPI een handleiding gemaakt om informatie over medicijnen zo begrijpelijk mogelijk op te schrijven. Deze schrijfwijzer is voor iedereen die zich bezighoudt met het schrijven van medicijninformatie en gepubliceerd op de website van het CBG. Al voor de uitbraak van Covid-19 is verkend hoe de informatievoorziening vanuit het netwerk over vaccinaties verder verbeterd kan worden. Inmiddels is het Netwerk ook daarmee aan de slag en zijn de eerste resultaten opgeleverd, waaronder informatie over de toegelaten Covid-19-vaccins.
Daarnaast heeft het CBG samen met de KNMP als aanvulling op de bijsluiter voor bijna 100 verschillende toepassingen een «medicijn in het kort» ontwikkeld. Dit is een korte en digitale vorm van medicijninformatie, ondersteund door pictogrammen. Er is een «medicijn in het kort» beschikbaar voor medicijnen die veel worden gebruikt of waarover veel informatie wordt gezocht, zoals cholesterolmedicijnen en oxycodon.
Ik geef binnenkort opdracht voor een onderzoek om inzicht krijgen in hoe het nu staat met de effectiviteit en het bereik van de objectieve informatie over farmacotherapie aan professionals en patiënten in Nederland. Daarmee wil ik bekijken welke informatievoorziening het meest effectief is en op welke manier deze verder kan worden verbeterd, rekening houdend met de behoefte van de patiënt en zorgverlener. Ik verwacht de resultaten van het onderzoek na de zomer.
Oneigenlijk gebruik van opioïden en andere geneesmiddelen
Een gebrek aan informatie over risico’s en juist gebruik kan leiden tot problemen, oneigenlijk gebruik of misbruik, zoals is gebeurd bij opioïden. We zagen in Nederland een sterke groei van het voorschrijven en gebruiken van sterkwerkende opioïden. In de VS en Canada heeft het onnodig en/of onverantwoord gebruik van opioïden de samenleving ontwricht, iets wat we in Nederland door tijdig ingrijpen hebben weten te voorkomen. In 2019 is op verzoek van mijn ambtsvoorganger de taakgroep «Gepast gebruik van opioïden» onder leiding van het Instituut voor Verantwoord Medicijngebruik (IVM) opgericht. Deze groep van artsen, apothekers en patiënten werkt onder meer aan het vergroten van (wetenschappelijke) kennis en bewustzijn over de (bij)werkingen en risico’s, en het verbeteren van standaarden en richtlijnen en begeleiding van patiënten. Inmiddels is de jarenlange stijging van het gebruik van opioïden doorbroken. Na een afvlakking in 2018 is nu een daling ingezet van het aantal voorschriften en van het aantal gebruikers van deze sterke pijnstillers. Dit blijkt uit de monitor Opioïden van de Taakgroep Gepast gebruik van opioïden (in samenwerking met IVM en de Stichting Farmaceutische Kengetallen (SFK).

Onderzoek van Nivel naar redenen van voorschrijven is in 2020 afgerond en er is meer zicht op voorschrijfgedrag door artsen. Met de opgedane kennis is communicatie voor patiënten verbeterd en zijn materialen ontwikkeld voor zorgverlen ers, zoals de website www.opiaten.nl, e-learning, en een FTO-module. Ik vind het goed om te zien dat die veel worden gebruikt.
Binnen de actie-agenda gepast gebruik opioïden is er speciale aandacht voor de patiënten die lange tijd opioïden gebruiken en waar sprake kan zijn van een verslavingssituatie. Veel van deze patiënten willen het gebruik afbouwen, maar slagen daar niet vanwege pijnklachten, onttrekkingsverschijnselen of verslavingsproblematiek. Verslavingsartsen geven aan dat hun klassieke afbouwmethoden onvoldoende werken bij mensen met verslaving aan opioïde pijnstillers, waarmee ze zijn begonnen vanwege ernstige pijnklachten. De taakgroep heeft samen met onderzoekers uit de verslavingszorg een handreiking ontwikkeld om de groep langdurige gebruikers in de eerste lijn te ondersteunen bij het afbouwen. Een werkgroep binnen de beroepsvereniging heeft zich gebogen over dit dilemma en heeft speciaal voor deze groep patiënten een effectief afbouwprotocol ontwikkeld. De taakgroep gepast gebruik opioïden gaat ook in 2021 onverminderd door met stimuleren van het verantwoord voorschrijven en gebruik van opioïden.

Ook oneigenlijk en onverantwoord gebruik van andere geneesmiddelen, zoals antidepressiva en ADHD-medicatie, is onwenselijk. Er lopen verschillende onderzoeken op dit terrein, onder meer naar de mentale gezondheid en middelengebruik onder studenten. Gelukkig zie ik bij andere middelen niet de ernstige situatie zoals die bij opioïden was ontstaan, ook omdat de werking van deze middelen van heel andere aard is. In het voorkomen van oneigenlijk gebruik is een belangrijke rol weggelegd voor voorschrijvers, apothekers en andere betrokken zorgverleners. Goede kennis over de werking van geneesmiddelen zoals hierboven is beschreven, maar ook door de beroepsgroepen zelf ontwikkelde richtlijnen, standaarden en protocollen. Ik onderzoek of ik professionals hierbij nog zinvol kan ondersteunen.
Therapietrouw
Of medicijnen goed werken, hangt af van verschillende factoren. Een van die factoren is de therapietrouw: gebruikt iemand de medicatie op de manier zoals is afgesproken met de zorgverlener. Dat is helaas lang niet altijd het geval. Mensen wijken soms bewust, soms onbewust af. Omdat ze hun medicatie vergeten, omdat ze eigenlijk liever helemaal geen geneesmiddel willen gebruiken, of omdat ze last hebben van (ervaren) bijwerkingen. Dat kan vervelende gevolgen hebben voor patiënten: een slechtere gezondheid of kwaliteit van leven, en uiteindelijk zelfs een (vermijdbare) ziekenhuisopname. En dat leidt uiteindelijk ook tot hogere zorgkosten.
Er is al veel kennis over therapietrouw. Het is immers al jaren een aandachtspunt. Er zijn talloze manieren waarop mensen hulp kunnen krijgen bij het beter gebruiken van hun medicijnen. Op www.interventienet.nl, ontwikkeld door het Nivel met subsidie van VWS, worden manieren gedeeld om therapietrouw te verbeteren. Die interventies en innovaties werken vaak goed, maar vinden niet altijd hun weg naar de dagelijkse praktijk. Daarom is het goed dat nu binnen het ZonMW-programma Goed Gebruik Geneesmiddelen wordt onderzocht hoe de implementatie van die interventies het beste plaats kan vinden. Met enige vertraging vanwege de COVID-19 uitbraak, zijn er nu vier «proeftuinen» gestart.59 In die proeftuinen gaan regio’s aan de slag met het verbeteren van het medicijngebruik, waarbij er speciale aandacht is voor alle aspecten die van belang zijn bij een goede en duurzame implementatie. Niet alleen de zorgkant komt aan bod, maar ook communicatie, psychologische en sociale aspecten. Gemene delers in die proeftuinen zijn de samenwerking tussen verschillende zorgverleners, begrijpelijke informatie en een persoonlijke benadering zodat de zorg aansluit bij de behoeften en wensen van patiënten.
Het is de bedoeling dat er in de toekomst meer proeftuinen volgen, en dat uiteindelijk met de geleerde lessen de implementatie van therapietrouw interventies op meer plaatsen succesvol gaat verlopen.
Mensen hebben meestal niet te maken met één zorgverlener. In het geval van farmaceutische zorg zeker niet. Goede farmaceutische zorg is een samenspel tussen patiënt, arts en verpleging, apotheker en het team; soms zijn ook thuiszorg en mantelzorg daarbij betrokken. Uiteindelijk komt alles bij elkaar in de apotheek. Daarmee heeft de apotheker een unieke en centrale positie in de farmaceutische zorgverlening. We moeten ervoor waken dat apothekers die taak ook kunnen uitvoeren. Zij moeten beschikken over actueel medicatieoverzicht en goede overdracht van alle benodigde gegevens.
Programma Medicatieoverdracht
In de Geneesmiddelenvisie is aangekondigd dat de richtlijn Medicatieoverdracht zou worden aangepast. Die richtlijn is er inmiddels. Het programma Medicatieoverdracht, dat in 2020 is gestart, richt zich op de implementatie van de vernieuwde Richtlijn overdracht van medicatiegegevens in de gehele zorgketen. Hiermee gaan we een grote bijdrage leveren aan het terugdringen van het aantal vermijdbare ziekenhuisopnames (ca. 25.000 per jaar) en slachtoffers (naar schatting 1000 per jaar) die ontstaan door medicatieproblemen. De elektronische gegevensuitwisseling draagt bij aan een vermindering van administratieve lasten voor zorgverleners en een verbetering van de ontsluiting van patiëntgegevens in een Persoonlijke Gezondheidsomgeving (PGO).
Heel veel zorgverleners hebben te maken met medicatie en aan dit omvangrijke programma nemen dan ook alle betrokken koepels deel. Inmiddels maken we met elkaar de stap van de voorbereiding naar de eerste fase van de uitvoering. De sectoren zijn gestart met het vormgeven van de vernieuwing van hun zorgprocessen. En onder de naam Kickstart wordt de komende maanden een stevige praktijktest opgezet met als doel om de bij de richtlijn behorende informatiestandaard in de basis van een aantal zorginformatiesystemen in te bouwen en in de keten te beproeven. Dit zal uiteindelijk leiden tot een eerste begeleide uitrol bij een selectie van zorgaanbieders. Daarnaast worden aan het eind van het eerste kwartaal van 2021 een Business Impact Analyses per sector en een overkoepelende Maatschappelijke Kosten Baten Analyse Medicatieoverdracht opgeleverd. Deze vormen de basis om de financiering van het brede programma vorm te gaan geven. Om over een aantal jaren een beeld te kunnen vormen over de impact van de implementatie van de richtlijn laat ik komend jaar een nulmeting uitvoeren.
Transmurale zorg
De implementatie van de richtlijn medicatieoverdracht en de informatiestandaarden gaat de soms kwetsbare «oversteek» van de ene zorgverlener naar de andere makkelijker maken. Het gaat daarbij echter niet alleen over de beschikbaarheid van de informatie, maar ook over een goede begeleiding van patiënten. Deze transmurale zorg kwam ook aan de orde in het Algemeen Overleg Pakketbeheer in juni 2020 (Kamerstuk 29 689, nr. 1073). Een van de plaatsen waar werk wordt gemaakt van een goede overdracht van het ziekenhuis naar huis is in West-Friesland. Daar doen apothekers huisbezoeken bij (kwetsbare) mensen die recent uit het ziekenhuis zijn ontslagen om te bespreken of het goed gaat met hun medicatiegebruik. Zoals toegezegd heb ik hierover contact gehad met de betrokken zorgverzekeraar. Ik heb begrepen dat er wetenschappelijk onderzoek wordt gedaan naar de effectiviteit van huisbezoeken, en dat de betrokkenen bij een positief resultaat verder gaan kijken naar implementatie. Ik wacht dat onderzoek en mogelijke verdere stappen met belangstelling af.
Wisselen van geneesmiddelen
Zoals eerder aan uw Kamer gemeld heb ik het College ter Beoordeling van Geneesmiddelen (CBG) gevraagd voor het einde van 2020 een lijst op te stellen van geneesmiddelen die bij voorkeur niet gewisseld zouden mogen worden. Deze lijst zal duidelijkheid bieden voor artsen, apothekers en patiënten bij het voorschrijven en verstrekken van geneesmiddelen. De lijst wordt op wetenschappelijke gronden vastgesteld en vervolgens jaarlijks door het CBG worden geëvalueerd en geactualiseerd op basis van nieuwe wetenschappelijke inzichten. De uitbraak van de COVID-19 pandemie heeft echter veel beslag gelegd op zowel de capaciteit van het CBG als op de externe experts die we raadplegen over de samenstelling. Daarom is deze lijst naar verwachting pas in het voorjaar van 2021 beschikbaar.
Naast de juiste informatie over het actuele medicatiegebruik en goede samenwerking, is het ook van belang om een beter beeld te krijgen van wat effectief medicijngebruik is, en wat passende en zinnige zorg is. Daarbij spelen ook brede maatschappelijke thema’s mee zoals verspilling en demedicaliseren. Als de medicijnen die mensen meekrijgen bij hen passen, en zij weten hoe ze gebruikt moeten worden, voorkom je daarmee dat ze verspild worden. Over verspilling heb ik uw Kamer al eerder bericht.60 Zoals toegezegd heb ik het punt rondom de heruitgifte van geneesmiddelen ook Europees geadresseerd61 in een gesprek met Eurocommissaris Kyriakides in november 2021. Zij heeft dit punt genoteerd en ook het belang van het voldoen aan de doelen van de Green deal beaamd. Tegen die achtergrond zullen we, in overleg met de Europese Commissie, bekijken in hoeverre er daadwerkelijk mogelijkheden zijn om heruitgifte van geneesmiddelen mogelijk te maken waarbij we voldoen aan de randvoorwaarden van productkwaliteit en productveiligheid.
Een ander belangrijk thema is demedicaliseren. Medicijnen kunnen een hele goede manier zijn om mensen te helpen, maar ze zijn niet altijd, niet meteen of soms niet meer nodig. Eerder genoemde ontwikkelingen zoals preventie en therapietrouw dragen al bij aan het demedicaliseren. Verdere ontwikkeling van kennis over effectief medicijngebruik, zowel voor groepen patiënten of specifieke medicijnen, als voor individuele patiënten, is nodig. Deze kennis wordt via data en onderzoek opgebouwd en ik vind het belangrijk dat deze ook de weg naar de spreekkamer en de balie van de apotheek vindt. Verschillende trajecten waar het Ministerie van VWS bij betrokken is dragen daar aan bij.
Leefstijlinterventies
Het is belangrijk om als zorgprofessional en als patiënt aandacht te geven aan de mogelijkheden van leefstijlinterventies als onderdeel van de behandeling. Naast het gesprek over het gebruik van een medicijn is het gesprek over leefstijl daarom net zo belangrijk. Leefstijlinterventies kunnen bijdragen aan vermindering van ziektelast en medicatiegebruik, en een verbetering opleveren bij de kwaliteit van leven bij mensen met een chronische ziekte, bijvoorbeeld Diabetes Mellitus Type (dm2). Verkeerde eetgewoontes, te weinig beweging, te veel stress en te weinig slaap veroorzaken ontregeling van de stofwisseling, met name bij die mensen die daar genetisch gevoelig voor zijn. Medicijnen pakken niet de onderliggende oorzakelijke processen aan die in stand worden gehouden door de manier van leven van de patiënt. Door leefstijlinterventies, al dan niet in combinatie met medicatie, een plaats te geven in het gesprek met de patiënt kan dit mogelijk leiden tot geen of minder medicijnengebruik. Daarom is ook vanuit het oogpunt van medicatie goed dat combineerde leefstijlinterventies (GLI) sinds 2019 onderdeel zijn van het verzekerde pakket.
Polyfarmacie bij ouderen
Ouderen, mensen met meerdere aandoeningen en andere kwetsbare patiënten gaan steeds meer geneesmiddelen gebruiken. Dat helpt hen om langer vitaal te zijn, maar kan ook een averechts effect hebben. Bij de zorgverlening aan ouderen is het dus extra belangrijk om alert te zijn op juist en veilig medicijngebruik en bijwerkingen. In de afgelopen kabinetsperiode is er aandacht geweest voor de verbetering van medicijngebruik. Zo draagt beter zicht op medicatie bij aan valpreventie en komen we binnen de Juiste Zorg op de Juiste Plek goede voorbeelden tegen van initiatieven waarin medicatiegebruik bij ouderen een aandachtspunt is. Een goede medicatieoverdracht, samenwerking tussen zorgverleners en bijvoorbeeld het doen van medicatiebeoordelingen zijn middelen waarmee de kwaliteit van zorg voor ouderen met polyfarmacie verbeterd wordt.
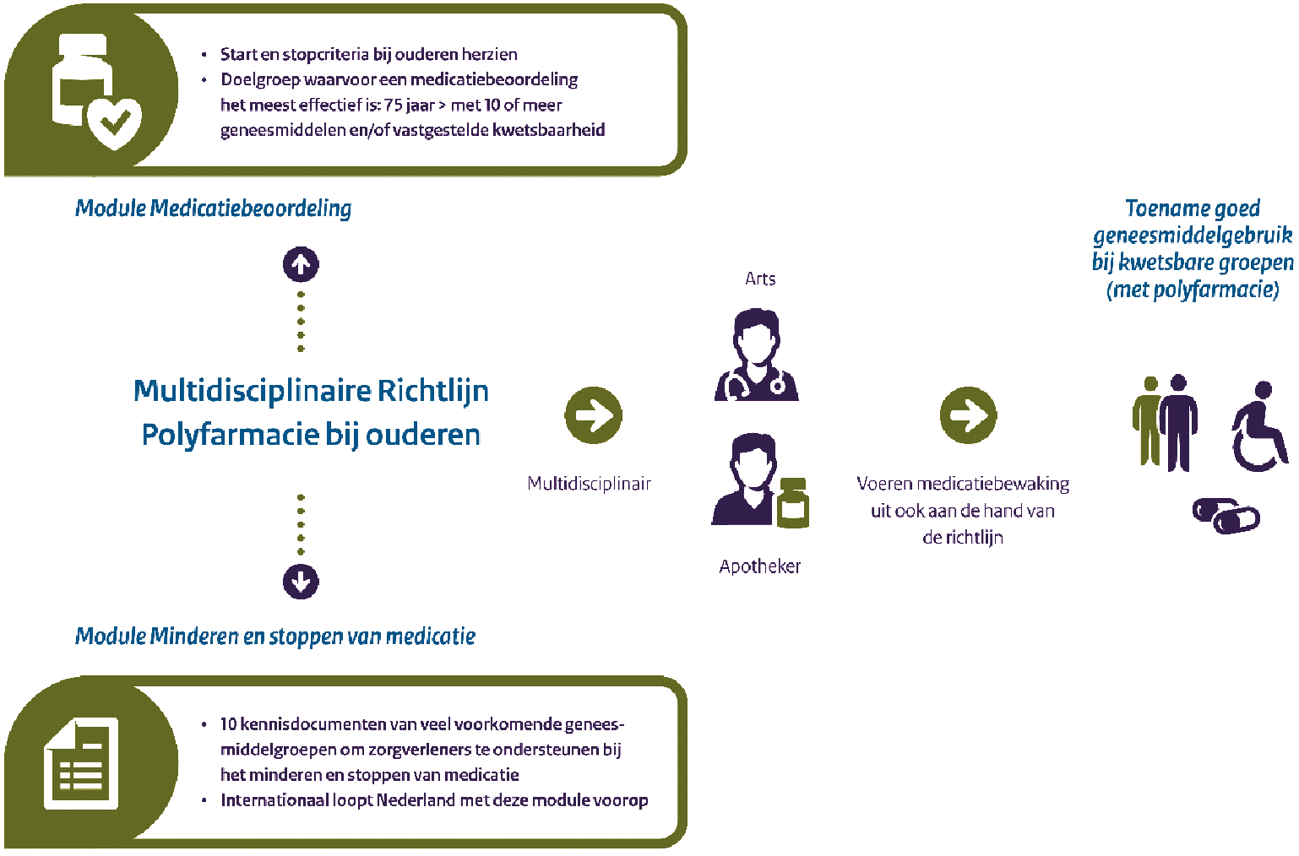
De apotheker en huisarts kijken samen naar wat effectief medicijngebruik is voor een patiënt, een van de instrumenten hiervoor is een medicatiebeoordeling. Op aandringen van VWS hebben de koepels van KNMP, NHG, NVKG, Verenso en Patiëntenfederatie Nederland de module medicatiebeoordeling van de Multidisciplinaire Richtlijn Polyfarmacie bij ouderen herzien, zoals ook door Kamer gevraagd is62. Daarover is uw Kamer eerder bericht. Inmiddels is deze herziening van de richtlijn aangeboden bij het Zorginstituut. Een medicatiebeoordeling is een intensieve doorlichting van het medicijngebruik, waarbij arts, apotheker en patiënt de resultaten samen bekijken en bespreken. Omdat hiervoor persoonlijk contact nodig is, verwacht ik dat vanwege de COVID-19 pandemie het aantal uitgevoerde medicatiereviews in 2020 lager zal liggen dan verwacht. Gelukkig is een medicatiebeoordeling slechts één van de onderdelen van de brede medicatiebewaking die arts en apotheker toepassen. Bij iedere ter hand stelling kijkt een apotheker of er geen problemen kunnen ontstaan met andere middelen of met de bij de apotheek bekende aandoeningen van de patiënt. Ook los van de ter hand stelling houden artsen en apothekers proactief optimale farmacotherapie in de gaten. Bijvoorbeeld door middel van beslissingsondersteunde instrumenten zoals Medisch Farmaceutische Beslisregels (MFB’s). Ook het huisartseninformatiesysteem (HIS) bewaakt ook het veilig geneesmiddelgebruik, door het gebruik van een formularium zoals het NHG-Formularium en medicatiebewaking via de G-Standaard.
Een intensieve medicatiebeoordeling is niet doelmatig voor iedere patiënt. VWS heeft benadrukt bij de betrokken koepels van zorgverleners dat er voor de groepen patiënten waarbij de intensieve medicatiebeoordeling niet zinnig is, andere vormen van medicatie-evaluatie wel belangrijk zijn. Ik verwacht dat deze koepels daar in de loop van 2021 meer over zullen delen.
Het blijkt dat regelmatig mensen zouden kunnen overwegen te stoppen met sommige geneesmiddelen, omdat ze niet langer effectief of nodig zijn. Er is onder zorgverleners niet altijd voldoende aandacht voor medicatie afbouwen en stoppen. Daarom ben ik blij dat op 1 december diverse partijen die betrokken zijn bij ouderenzorg waaronder het NHG, de NVKG en de KNMP, de module «Minderen en stoppen van medicatie» hebben gepubliceerd. Dit nieuwe onderdeel bij de multidisciplinaire richtlijn (MDR) Polyfarmacie bij ouderen, ontwikkeld met subsidie van VWS, biedt handreikingen voor de praktijk. Daarmee kunnen voorschrijvers, apothekers en patiënten het medicijngebruik optimaliseren en zo de kwaliteit van leven, gezondheid en welzijn van de patiënt verbeteren. Met kennisdocumenten gericht op 10 specifieke veel bij ouderen gebruikte geneesmiddelgroepen, scholingsmateriaal en patiënteninformatie op Thuisarts.nl en Apotheek.nl wordt de informatie in de praktijk verspreid en geïmplementeerd. Tevens zijn de STOP-START-NL criteria verschenen, een instrument met aandachtspunten om het geneesmiddelgebruik bij ouderen te optimaliseren.
Farmaceutische zorg in de toekomst
De COVID-19 pandemie heeft impact op alle onderdelen van de zorg, de farmaceutische niet uitgezonderd. Door een afname van het bezoek aan artsen zijn minder recepten uitgeschreven. Mensen bezochten de apotheek minder; apotheken zijn meer medicatie gaan bezorgen of verstrekken via afhaalautomaten. Het contact met patiënten verloopt vaker digitaal en telefonisch, wat een uitdaging kan zijn bij het verlenen van goede gebruiksinstructies. Vragen gaan niet alleen over medicatie, maar ook over persoonlijke beschermingsmiddelen en informatie over vaccins. Met het codewoord «Masker 19» kunnen slachtoffers van huiselijk geweld terecht in de apotheek. Apothekers werken landelijk samen om geneesmiddelen op een goede manier te verdelen.
Maar ook los van COVID-19 is de farmaceutische zorg in verandering. Samenwerking met andere zorgverleners in de regio vernieuwt, zoals in West-Friesland waar apothekers het doen van labcontroles overnemen van huisartsen. Apotheken zoeken naar manieren om logistieke en zorgprocessen gestroomlijnder te laten lopen, al dan niet gescheiden. De wijze waarop apotheekteams zorgverlening verrichten wordt constant verbeterd door de ontwikkeling van richtlijnen en standaarden, zoals de richtlijn consultvoering waar aan wordt gewerkt.
Tegelijkertijd worden patiënten en zorgverleners soms geconfronteerd met taaie problemen, zoals de hierboven beschreven tekorten. Zoeken naar vervanging en het ondersteunen van patiënten bij een geneesmiddelwissel kosten tijd. De behoefte aan begeleiding verschilt tussen groepen patiënten, en de manier waarop we die begeleiding organiseren en bekostigen zou op punten mogelijk beter kunnen aansluiten. Hierover is mijn ministerie voortdurend in gesprek met alle betrokken partijen. Niettemin zie ik voor de toekomst het belang van een bredere dialoog over ontwikkeling en vernieuwing van de farmaceutische zorg. De toekomstvisie die KNMP onlangs heeft uitgebracht, aspecten van het adviesrapport van de NZa en Zorginstituut Nederland, en ook andere ontwikkelingen vormen daar ingrediënten voor.
Het betreft hier de jaren 2015 tot en met 2019. Zie ook de betreffende brief onder Kamerstuk 29 477, nr. 691
Kamerstuk 29 477, nr. 654. Het cijfer voor 2018 in de Monitor geneesmiddelen in de medisch specialistische zorg is gebaseerd op nog niet complete data. Zie voor meer toelichting in de NZa-monitor.
(Kamerstuk 29 477, nr. 653). Onderzoek Algemene Rekenkamer, Paardenmiddel of noodverband?, april 2020.
Het derde verzoek in de motie gaat over prikkels voor het MKB vergelijkbaar met die van het EMA, maar daarin wordt al voorzien door het CBG.
RIVM trendscenario Volksgezondheid Toekomstverkenning 2018: www.vtv2018.nl/trendscenario. (Kamerstuk 32 793, nr. 274)
Zie ook het nieuwsbericht over de gewijzigde regelgeving van 23 december 2020: Van Nieuwenhuizen versnelt vergunningprocedure gentherapie | Nieuwsbericht | Rijksoverheid.nl
Amvb, Staatsblad 2018, 131 | Overheid.nl > Officiële bekendmakingen (officielebekendmakingen.nl)
de Nederlandse Vereniging van Ziekenhuizen (NVZ), Zorgverzekeraars Nederland (ZN), de Nederlandse federatie van Universitair Medische Centra (NFU), Patiëntenfederatie Nederland, Zelfstandige Klinieken Nederland (ZKN), Verpleegkundigen en Verzorgenden Nederland (V&VN) en de Federatie Medisch Specialisten (FMS)
Kosteneffectiviteitgegevens maken duidelijk hoe de betere gezondheid die een nieuwe behandeling voor de patiënt oplevert, opweegt tegen de kosten ervan. De kosteneffectiviteit van de nieuwe behandeling wordt bepaald op basis van de extra gezondheidswinst en de extra kosten die deze met zich meebrengt ten opzichte van de bestaande, gangbare behandeling.
Kosten van mislukkingen kunnen hierin ook een rol spelen. Dit is immers van belang om de toekomstige bereidheid te investeren in nieuw onderzoek te waarborgen.
Rapportage meldpunt geneesmiddelentekorten en -defecten 2019 (Bijlage bij Kamerstuk 29 477, nr. 562)
Duitsland: Kamerstuk 29 477, nr. 400; Kamerstuk 29 477, nr. 507; Kamerstuk 29 477, nr. 608.
Italië: Kamerstuk 29 477, nr. 479; Kamerstuk 29 477, nr. 529.
Kopieer de link naar uw clipboard
https://zoek.officielebekendmakingen.nl/kst-29477-696.html
De hier aangeboden pdf-bestanden van het Staatsblad, Staatscourant, Tractatenblad, provinciaal blad, gemeenteblad, waterschapsblad en blad gemeenschappelijke regeling vormen de formele bekendmakingen in de zin van de Bekendmakingswet en de Rijkswet goedkeuring en bekendmaking verdragen voor zover ze na 1 juli 2009 zijn uitgegeven. Voor pdf-publicaties van vóór deze datum geldt dat alleen de in papieren vorm uitgegeven bladen formele status hebben; de hier aangeboden elektronische versies daarvan worden bij wijze van service aangeboden.
