Kamerstuk
| Datum publicatie | Organisatie | Vergaderjaar | Dossier- en ondernummer |
|---|---|---|---|
| Tweede Kamer der Staten-Generaal | 2020-2021 | 29477 nr. 682 |
Zoals vergunningen, bouwplannen en lokale regelgeving.
Adressen en contactpersonen van overheidsorganisaties.
U bent hier:

| Datum publicatie | Organisatie | Vergaderjaar | Dossier- en ondernummer |
|---|---|---|---|
| Tweede Kamer der Staten-Generaal | 2020-2021 | 29477 nr. 682 |
Vastgesteld 22 oktober 2020
De vaste commissie voor Volksgezondheid, Welzijn en Sport heeft een aantal vragen voorgelegd aan de Minister voor Medische Zorg over de brief van 7 juli 2020 inzake de aanpak geneesmiddelentekorten en ijzeren voorraad (Kamerstuk 29 477, nr. 660).
De Minister voor Medische Zorg heeft deze vragen beantwoord bij brief van 21 oktober 2020. Vragen en antwoorden zijn hierna afgedrukt.
De voorzitter van de commissie, Lodders
De adjunct-griffier van de commissie, Bakker
1.
Hoeveel daadwerkelijke tekorten aan geneesmiddelen zijn er geweest de afgelopen vijf jaar en hoelang duurde het tekort gemiddeld?
Het meldpunt geneesmiddelentekorten en -defecten bestaat sinds 1 januari 2017. Bij het Meldpunt melden bedrijven verwachte leveringsproblemen. In 2017 zijn 536 meldingen van verwachte leveringsproblemen ontvangen, in 2018 waren dat er 1390 en in 2019 3017.1 Een melding wil niet altijd zeggen dat er ook daadwerkelijk een tekort aan het medicijn ontstaat. Voor de meeste medicijnen met leveringsproblemen zijn er voldoende alternatieven beschikbaar met dezelfde werkzame stof, dosering en toediening. Door op tijd te melden kan in veel gevallen tijdig een oplossing worden gevonden. Dat is de afgelopen jaren in bijna alle gevallen gebeurd.
Sinds 2017 zijn daadwerkelijke tekorten ontstaan voor een beperkt aantal geneesmiddelen, waarbij niet direct een alternatief was. Dit zijn: levothyroxine, levodopa/carbidopa, Bactroban, smal-spectrum antibiotica, anticonceptiemiddelen, fenprocoumon en bupropion.
Ongeveer 75% van de tijdelijke tekorten duurt maximaal vier maanden.2
2.
Voor welke geneesmiddelen worden er de komende vijf jaar tekorten verwacht?
Dat is moeilijk te voorspellen. Er zijn wel enkele geneesmiddelen waarvoor regelmatig een leveringsprobleem gemeld is, maar dat betekent niet automatisch dat voor die geneesmiddelen een tekort gaat optreden in de komende vijf jaar.
3.
Hoeveel klachten over geneesmiddeltekorten zijn er bij de IGJ binnengekomen de afgelopen vijf jaar?
Er zijn geen formele klachten specifiek over tekorten ingediend bij IGJ. Wel wordt er regelmatig melding gedaan door veldpartijen (met name (ziekenhuis)apothekers, soms burgers) van tekorten en problemen die (zijn) ontstaan in de praktijk.
4.
Zijn er calamiteiten gemeld bij de IGJ als gevolg van geneesmiddeltekorten?
Nee. Hoewel er geen calamiteiten zijn gemeld, kunnen geneesmiddelentekorten wel degelijk vervelende consequenties hebben voor patiënten en zorgverleners. Denk hierbij aan de recente tekorten van de orale anticonceptiepil en problemen rondom beschikbaarheid van Thyrax (schildklierhormoon).
5.
Is er een verschil tussen tekorten voor generieke geneesmiddelen en zogenaamde spécialité geneesmiddelen? Zo ja, kunt u dit toelichten?
In 2018 is gekeken in welke mate verwachte leveringsproblemen voor generieke en spécialité geneesmiddelen worden gemeld.3 Het blijkt dat ongeveer 40% van de geneesmiddelen waarvoor een verwacht leveringsprobleem is gemeld een spécialité geneesmiddel betreft. In 60% van de gevallen betreft het een generiek geneesmiddel. Dit laat zien dat de problematiek meerdere aspecten kent. Zoals beschreven in het antwoord op vraag 1 is van belang in hoeverre er een alternatief beschikbaar is. De mate waarin een alternatief beschikbaar is, is afhankelijk van diverse factoren.
Uiteraard van het aantal beschikbare identieke geneesmiddelen, maar ook de beschikbare andere sterktes en de breedte van de farmaceutische groep waartoe het middel behoort. Bij een groot deel van de generieken zijn er regelmatig ook andere identieke geneesmiddelen op de markt, bij spécialités vaak niet. Daarnaast dienen de alternatieven wel in voldoende hoeveelheid beschikbaar te zijn om het tekort op te kunnen vangen.
6.
Is er rekening gehouden met geneesmiddelen die maar kort houdbaar zijn? Zo ja, hoe? Zo nee, waarom niet?
Ja, bij de uitwerking van de implementatie van de ijzeren voorraad is aandacht voor de omgang met producten met een korte houdbaarheid. Dit wordt de komende tijd verder uitgewerkt.
7.
Is er rekening gehouden met geneesmiddelen die speciaal maatwerk vergen voor een kleine groep patiënten? Zo ja, hoe? Zo nee, waarom niet?
Ja, hier is aandacht voor. Ook voor geneesmiddelen voor kleine patiënten aantallen is het belangrijk dat problemen in de keten opgevangen kunnen worden door de aanwezigheid van voorraad. Tegelijkertijd begrijp ik dat aan deze geneesmiddelen weer specifieke uitvoeringsvraagstukken verbonden zijn.
8.
Er wordt gesproken over een ijzeren voorraad van vijf maanden. Welke voorraadperiode houden andere Europese landen aan? Kunt u een overzicht verstrekken?
Op dit moment loopt er een inventarisatie van het voorraadbeleid in andere Europese landen. Een volledig overzicht kan ik daarom nog niet verstrekken. Wel blijkt inmiddels dat er ook in andere Europese landen bestaande of nieuwe initiatieven lopen ten aanzien van voorraadvorming.
9.
Kan het voorkomen dat een ander EU-land met een tekort aan een geneesmiddel een beroep doet op aanwezige voorraad in Nederland of is deze voorraad exclusief voor Nederlanders?
De ijzeren voorraad is bestemd voor de Nederlandse markt en patiënten. Het is denkbaar dat bijvoorbeeld een buitenlands (hoofd)kantoor aan de Nederlandse vergunninghouder vraagt om een deel van de voorraad beschikbaar te stellen om een tekort elders op te lossen. Ik wil met partijen bespreken hoe hiermee in de praktijk omgegaan kan worden. Immers, het omgekeerde is ook waar dat Nederland soms geholpen wordt met geneesmiddelen uit andere landen indien er bij ons een tekort is.
10.
Hoe wordt voorkomen dat fabrikanten of groothandels zich uit Nederland terugtrekken en geen geneesmiddelen meer willen leveren omdat ze de kosten van de ijzeren voorraad te hoog vinden?
Ik werk op dit moment met partijen de wijze van financiering nader uit. De kosten van de ijzeren voorraad zullen naar verwachting op zichzelf niet een reden zijn voor terugtrekking van de Nederlandse markt, maar in combinatie met andere marktomstandigheden kan de Nederlandse markt mogelijk onvoldoende aantrekkelijk blijven voor sommige fabrikanten en groothandels. Dit is met name een risico aan de «onderkant van de geneesmiddelenmarkt». Dit licht ik nader toe in het antwoord op vraag 114.
11.
Welk percentage van de geneesmiddelen wordt in Nederland gefabriceerd? Welke plannen zijn er om dit percentage op te hogen? Er bestaat een beeld van het aantal fabrikanten dat in Nederland gevestigd en geregistreerd als vergunninghouder is, maar niet van de beschikbare Nederlandse productiecapaciteit. Samen met de Europese Commissie en mijn Europese collega’s probeer ik voor actieve bestanddelen de productiecapaciteit in beeld te brengen, maar dit beeld kan door marktomstandigheden veranderen. Ik zal hierbij ook naar de productiecapaciteit in Nederland kijken.
Het is hierbij van belang om niet alleen naar de productie van eindproducten te kijken, maar ook naar de benodigde grondstoffen, werkzame bestanddelen, hulpstoffen en halffabricaten. Voor de plannen om onze leveringszekerheid te borgen, waaronder door middel van productie, verwijs ik u naar het antwoord op vraag 122.
12.
In hoeverre kunnen eigen apotheekbereidingen een oplossing zijn voor geneesmiddeltekorten en hoe kan dit worden gefaciliteerd?
In sommige specifieke gevallen is het mogelijk dat een bereiding (veelvuldiger) ingezet kan worden om een tekort tijdelijk te overbruggen. Het is nu al zo dat de z.g. doorgeleverde bereidingen ook zijn toegestaan op het moment dat er een tekort is aan een geregistreerd geneesmiddel. Deze bereidingen worden ook vergoed.
13.
Welke andere maatregelen worden er genomen om tekorten aan geneesmiddelen op te lossen?
Zoals beschreven in de kamerbrief d.d. 7 juli 2020 is Europese samenwerking belangrijk om de complexe oorzaken van geneesmiddelentekorten te adresseren.4. Zo wordt er door de Europese Commissie – mede op aandringen van Nederland – onderzoek gedaan naar de afhankelijkheden van Europa en de oorzaken van (toenemende) geneesmiddelentekorten. Daarnaast zet Nederland zich Europees in voor een stevige farmaceutische strategie die gepland staat voor eind dit jaar. Nationaal werken we zoveel mogelijk aan het adresseren van de gevolgen geneesmiddelentekorten, onder andere door de werkzaamheden van het in 2017 opgerichte meldpunt geneesmiddelentekorten en -defecten en de samenwerking in de werkgroep geneesmiddelentekorten.
14.
Kunt u toelichten waarom het aantal medicijnen waarvoor er dreigende leveringsonderbrekingen zijn gemeld in 2019 bijna verdubbeld is ten opzichte van 2018?
We zien dat wereldwijd het aantal leveringsonderbrekingen en dreigende tekorten toeneemt. Zo ook in Nederland. Dit heeft onder andere te maken met een internationale keten die steeds kwetsbaarder wordt, door afname van productieplaatsen en een verkleining van het aantal voorraden in de keten.
Een (beperkt) deel van de stijging van de nationale meldingen is mogelijk ook te verklaren door meer bekendheid met het in 2017 opgerichte Meldpunt geneesmiddelentekorten en -defecten en dat meer fabrikanten actiever zijn gaan melden.
15.
Kunt u toelichten waarom er voor is gekozen om te ambiëren de ijzeren voorraden voor de tijdsperiode van vijf maanden (en niet langer of korter) aan te leggen?
Er is een onderzoek uitgevoerd naar de verwachte effecten van het aanleggen van een ijzeren voorraad van 5 maanden in Nederland, hieruit bleek dat naar verwachting circa 85% van de kortdurende tekorten hiermee ondervangen kan worden.5 Met een minder grote voorraad kon een (significant) minder groot deel van de kortdurende tekorten overbrugd worden. Mede op basis van dit rapport is besloten deze oplossingsrichting nader uit te werken.
16.
Kunt u toelichten of er consequenties zullen zijn voor leveranciers en groothandels die volgens het op pagina 2 beschreven monitorsysteem na 1 juli 2022 niet de voorgeschreven ijzeren voorraad aanhouden?
De beleidsregel gaat uiterlijk per 1 juli 2022 gelden. De IGJ kan, bij het afwijken van de beleidsregel, passende maatregelen treffen. Echter, de wijze van monitoring, inclusief de grondslag en welke partijen wel of geen toegang hebben tot de monitor, moet nog nader uitgewerkt worden.
17.
Zijn er medicijnen die korter dan vijf maanden houdbaar zijn en gaat voor deze medicijnen ook de ijzeren voorraad van vijf maanden gelden?
Zie antwoord vraag 6.
18.
Welke medicijnen zijn u bekend die korter dan vijf maanden houdbaar zijn?
Radiofarmaca hebben over het algemeen een houdbaarheid korter dan 6 maanden.
19.
Kunt u toelichten hoe de ijzeren voorraad gemonitord en gehandhaafd kan worden bij leveranciers en groothandelaren in het buitenland?
De wettelijke verplichtingen voor handelsvergunninghouders, zoals gesteld in artikel 49 lid 7 (meldingsplicht) en artikel 49 lid 9 (zorgdragen voor voldoende voorraden) Geneesmiddelenwet, gelden voor houders van een handelsvergunning van een tot de Nederlandse markt toegelaten geneesmiddel. Handelsvergunninghouders, gevestigd in het buitenland die een Nederlandse handelsvergunning voeren, zijn zodoende gebonden aan de Geneesmiddelenwet en vallen daarmee onder het toezicht van de IGJ. De IGJ houdt geen toezicht op groothandels die in het buitenland gevestigd zijn.
20.
Kunt u toelichten waarom ervoor gekozen is één tijdsduur voor de ijzeren voorraad te handhaven voor alle medicijnen, in plaats van te differentiëren voor verschillende medicijnen?
Tekorten zijn onvoorspelbaar en kunnen optreden voor elk soort geneesmiddel, daarom is het belangrijk tekorten voor zoveel mogelijk producten te kunnen opvangen door middel van voldoende extra voorraad in de keten. Hiermee creëren we een buffer om (leverings)problemen beter te kunnen opvangen. Zo verkleinen we de negatieve gevolgen voor patiënten aan de balie zoveel als mogelijk.
Hoewel het uitgangspunt voor het aanleggen van de ijzeren voorraad 5 maanden is voor alle geneesmiddelen begrijp ik van veldpartijen dat dit voor sommige geneesmiddelen niet mogelijk is (bijvoorbeeld vanwege korte houdbaarheid). Hierover ben ik met partijen nog in gesprek.
21.
Kunt toelichten of er onderzocht is dat de leveranciers en groothandels ermee akkoord zullen gaan € 55 miljoen van de € 100 miljoen die er jaarlijks nodig is om de ijzeren voorraad aan te houden te bekostigen?
Sommige leveranciers en groothandels hebben aangegeven dat een volledige financiering van de ijzeren voorraad door de overheid c.q. zorgverzekeraar verwachten. Ik ben met partijen nog in gesprek over de definitieve vormgeving van de financiering.
22.
Kunt u toelichten of het wettelijk verplicht gaat worden voor de leveranciers en groothandels om de ijzeren voorraad aan te houden?
Het is nu al wettelijk verplicht voor handelsvergunninghouders en groothandels om voldoende voorraad aan te houden. Vanaf 1 juli 2022 wordt het begrip «voldoende voorraad» in de beleidsregel nader geconcretiseerd.
23.
Kunt u toelichten welke opties er zijn voor eventuele handhaving als een ijzeren voorraad verplicht wordt?
De IGJ heeft nu al de bevoegdheid om handhavend op te treden op de wettelijke verplichting om voldoende voorraad aan te houden en zorg te dragen voor voldoende voorraden voor groothandelaren of apothekers om in de behoeften van patiënten te kunnen voorzien. Daarnaast zal de IGJ vanaf 1 juli 2022 in lijn met de beleidsregel handhavend kunnen optreden als blijkt dat deze voorraden niet of onvoldoende worden aangehouden.
24.
Kunt u toelichten in hoeverre het implementeren van de vier verschillende modellen zal leiden tot hogere premies?
De kosten van de ijzeren voorraad werken in de vier modellen (deels) door in hogere prijzen en daarmee ook in de hoogte van de premie. Wat per model naar verwachting de doorwerking zal zijn is niet expliciet doorgerekend in het rapport.
25.
Op welke manier zal bij de vier verschillende modellen de € 45 miljoen publiek geld dat jaarlijks nodig is voor het bekostigen van de ijzeren voorraad precies gefinancierd worden?
Dit bedrag is toegevoegd aan het budgettair kader farmaceutische zorg. De wijze van financiering van de ijzeren voorraad in de keten wordt op dit moment nader uitgewerkt.
26.
Kunt u toelichten met het vermijden van welke duurdere alternatieven er € 20 miljoen per jaar bespaard zal worden?
Apothekers maken extra kosten voor substituut geneesmiddelen als het oorspronkelijk voorgeschreven middel niet beschikbaar is. De alternatieven die ingezet worden, hangen af van het tekort dat is opgetreden. Gupta concludeerde in 2019 op basis van interviews met apothekers dat het verschil tussen de prijzen van de substituut geneesmiddelen en de AIP in de ordegrootte 25–50% is.6
27.
Kunt u toelichten wat, naast de eenvoud van het model, de reden is dat model 1 (AIP) verder zal worden uitgewerkt?
Het model kan sneller uitgewerkt worden, zorgt naar verwachting voor minder administratieve lasten en had van de uitgewerkte modellen het meeste draagvlak.
28.
Welke andere Europese landen nemen ook maatregelen zoals het aanleggen van een ijzeren voorraad? Welke andere maatregelen treffen ze?
Zie antwoord vraag 8.
29.
Hoelang duurt de opbouw van een ijzeren voorraad?
Zoals aangegeven in de kamerbrief van 3 november 2019 heeft het aanleggen van de ijzeren voorraad tijd nodig – circa 1,5 tot 2 jaar.7
30.
Hoeveel medicijngebruikers zijn er in Nederland?
Uit de GIP-databank blijkt dat er in 2019 ca 11,3 miljoen gebruikers van receptgeneesmiddelen waren, ongeveer even veel als in 2018.
31.
Hoeveel medicijnen gebruikt de medicijngebruiker in Nederland gemiddeld?
Volgens de GIP-databank gebruikte in 2019 ca 75% van de gebruikers 1 tot 5 medicijnen. Ongeveer 18% gebruikte 6–10 medicijnen en ongeveer 5% gebruikte 11–15 medicijnen. Iets meer dan 1% van de gebruikers gebruikte 16 of meer medicijnen. (zie vraag 30).
32.
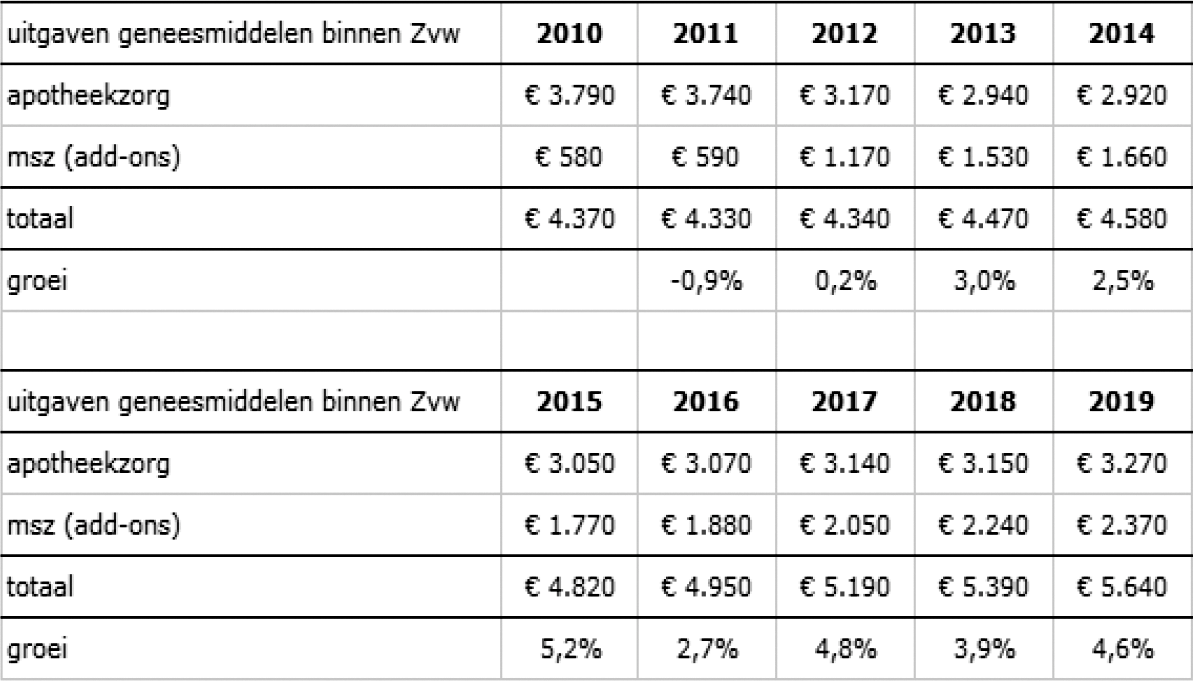
Hoeveel geld werd er de laatste 25 jaar door Nederlandse medicijngebruikers uitgegeven aan medicijnen?
Op basis van de gegevens die op korte termijn beschikbaar waren, komen de uitgaven binnen de Zvw aan geneesmiddelen (vallend onder de apotheekzorg en de «add-ons» binnen de medisch specialistische zorg) in de periode 2004 t/m 2019 op rond de € 72 miljard (dit is exclusief medicijnen die buiten de zorgverzekering worden gebruikt en bijvoorbeeld ook exclusief medicijnen die binnen de WLZ worden gebruikt).
33.
Hoe groot is de huidige medicijnvoorraad?
De hoeveelheid aan aangehouden voorraad verschilt per geneesmiddel, firma en groothandel.
34.
Hoeveel wordt er uitgegeven aan geneesmiddelen en wat is het historisch overzicht daarvan in de afgelopen tien jaar?
Uitgaande van de uitgaven binnen de Zvw aan geneesmiddelen die vallen onder apotheekzorg («extramuraal») en de «add-ons» binnen de medisch
specialistische zorg («intramuraal») is het overzicht, bedragen in miljoenen:
35.
Zijn er specifieke medicijnen waarvoor het aanleggen van een ijzeren voorraad geen realistische optie is, bijvoorbeeld medicijnen die voor een enkele patiënt zijn ontworpen?
Zie antwoord vraag 20.
36.
Hoe verhoudt de opbouw van een ijzeren voorraad zich tot de GVS herberekening? Bestaat er een risico dat een ijzeren voorraad word opgebouwd voor medicijnen waar na de GVS herberekening vrijwel geen vraag naar is?
Door de herberekening van de vergoedingslimieten, daalt voor veel producten de vergoedingslimiet. Voor een deel van de geneesmiddelen ontstaat daardoor een bijbetaling voor de patiënt op het middel. Hiermee worden fabrikanten van de relatief dure spécialité geneesmiddelen gestimuleerd de prijzen voor die geneesmiddelen in lijn te brengen met de goedkopere vergelijkbare geneesmiddelen. In het geval de prijzen worden verlaagd tot aan de vergoedingslimiet, ontstaat er geen bijbetaling voor de patiënt. Indien fabrikanten hun prijzen niet verlagen, kan de patiënt de bijbetaling ontlopen
door te wisselen naar een vergelijkbaar geneesmiddel zonder bijbetaling.
De herberekening zorgt er immers voor dat in elk cluster van onderling vervangbare geneesmiddel tenminste één geneesmiddel zonder bijbetaling beschikbaar is. Volumeverschuivingen als gevolg van de herberekening, en dus ook effecten op de voorraad, zijn dus allereerst afhankelijk van het prijsgedrag van de fabrikant en daarna van het gedrag van voorschrijvers en patiënten. De nieuwe vergoedingslimieten worden tijdig voorgehangen, zodat de verschillende partijen hierop kunnen anticiperen.
De implementatie van de ijzeren voorraad wordt op dit moment nader uitgewerkt. Ik bespreek dit punt met partijen in de verdere uitwerking.
37.
Zou het een mogelijkheid zijn om producenten te compenseren wanneer zij de ijzeren voorraad hebben aangelegd?
Ik ben er voorstander van om die partijen die het voortouw nemen ook te belonen maar ik ben met partijen nog in gesprek over de definitieve vormgeving van de financiering.
38.
Wat zijn de mogelijke effecten van extra medicijnspillage voor het milieu?
Uit onderzoek is gebleken dat 95% van de medicijnresten in water daar komen via urine en ontlasting en dus niet door verspilling van medicijnen.
Medicijnresten komen ook in het milieu als overgebleven geneesmiddelen door het toilet worden gespoeld, in plaats van dat deze via het restafval worden afgevoerd of bij de apotheker worden ingeleverd. Als overgebleven medicatie op de juiste wijze wordt afgevoerd, is er geen effect op het milieu. Het Ministerie van IenW heeft een «Ketenaanpak Medicijnresten uit Water» opgezet. Een samenwerking met de departementen VWS, LNV en decentrale overheden en met een brede vertegenwoordiging van stakeholders uit de zorg-, de farmaceutische- en de watersector om dit probleem aan te pakken.
Het effect van extra medicijnspillage op het milieu is niet groot, maar desondanks vind ik het van belang om hier aandacht voor te houden.
39.
Hoe verhoudt de eventuele hogere AIP prijs zich tot alle andere Europese landen?
Dit hangt onder andere af van de definitieve vormgeving van de financiering, hierover ben ik nog in gesprek met veldpartijen.
40.
Hoeveel winst maken producenten op de medicijnen waarvoor een ijzeren voorraad word aangelegd?
Er is geen overzicht van de winstpercentages per geneesmiddel. De verschillen zijn naar verwachting erg groot. Zo zijn de winstmarges bij generieke, goedkope geneesmiddelen aanzienlijk lager dan bij innovatieve patentgeneesmiddelen.
41.
Kunt u toelichten voor welke medicijnen de afgelopen 20 jaar een dreigend tekort of een feitelijk tekort ontstond?
Het meldpunt geneesmiddelentekorten en -defecten bestaat sinds 1 januari 2017. Voor informatie over de dreigende en feitelijke tekorten sindsdien verwijs ik u naar mijn antwoord op vraag 1.
42.
Wat is de definitie van vijf maanden voorraad? Kijkt u terug naar de afgelopen periode of kijkt u vooruit naar de verwachte vraag?
Deze definitie, inclusief terug en vooruitkijken, zal worden verduidelijkt in de beleidsregel die op dit moment wordt uitgewerkt. Uitgangspunt daarbij is «pas toe of leg uit».
43.
Leggen andere Europese landen ook een ijzeren voorraad aan? Zo ja, wat zijn hiervoor de constructies met betrekking tot de financiering?
Ja, uit de eerste resultaten van de inventarisatie blijkt dat ook sommige andere lidstaten gekwantificeerde voorraadverplichtingen hebben verankerd. De financiële constructies zullen verschillen, onder andere omdat landen een andere wijze van inkoopbeleid hanteren.
44.
U wil een ijzeren voorraad voor alle in Nederland beschikbare geneesmiddelen. Zijn er ook geneesmiddelen denkbaar waarbij het niet mogelijk is om een voorraad voor op te bouwen?
Zie antwoord vraag 20.
45.
Hoe gaat u om met een voorraad voor producten die in een jaarcyclus gemaakt worden met een houdbaarheid van bijvoorbeeld 18 maanden (12 maanden voorraad in verband met jaarproductie, 5 maanden extra voorraad is 17 maanden voorraad, houdbaarheid is 18 of 24 maanden)? Maakt u uitzonderingen en hoe?
Er zijn nog verschillende elementen die nadere uitwerking behoeven die binnen de werkgroep geneesmiddelentekorten worden besproken. Er is aandacht voor producten die in een jaarcyclus worden geproduceerd en een relatief korte houdbaarheid hebben.
46.
Wat is uw analyse van de impact van de aanpassing Wgp en GVS op het houden van voorraad? Op welke wijze heeft dat invloed bij het moment van invoeren van de ijzeren voorraad?
Ik verwijs hier naar mijn antwoord op vraag 36 (over het GVS) en vraag 49 (over de Wgp).
47.
De besparing van het GVS is 2% van het geneesmiddelenbudget. Hoeveel patiënten verwacht u moeten gaan bijbetalen bij de aanpassing GVS en hoeveel kost dat extra per patiënt? Hoeveel van deze patiënten hebben een chronische ziekte, twee chronische ziektes of meer chronische ziektes?
48.
Indien de patiënt niet kan bijbetalen, hoeveel wisselingen verwacht u dan naar een volledig vergoed product en wat betekent dat voor de voorraad bij leveranciers?
Antwoord vragen 47 en 48
Eén van de uitgangspunten van de voorgenomen modernisering van het GVS is dat de patiënt altijd kan kiezen voor een geneesmiddel zonder bijbetaling, ook na een herberekening van de vergoedingslimieten. Dit kan allereerst doordat fabrikanten hun prijzen verlagen naar de hoogte van de vergoedingslimiet, waardoor de bijbetaling vervalt. Indien fabrikanten hun prijzen niet (voldoende) verlagen, kan de patiënt, waar nodig onder begeleiding van de voorschrijver en/of de apotheker, wisselen naar een vergelijkbaar geneesmiddel zonder bijbetaling.
De herberekening herstelt namelijk het uitgangspunt dat in elk cluster van onderling vervangbare geneesmiddelen tenminste één geneesmiddel zonder bijbetaling beschikbaar is. In de situatie dat een patiënt om medische redenen alleen een geneesmiddel met een bijbetaling kan gebruiken, dan wordt met de modernisering van het GVS geregeld dat, door toepassing van het instrument «medische noodzaak», de patiënt deze bijbetaling niet verschuldigd is. Ik heb u begin van dit jaar8 geïnformeerd over het aantal patiënten met een bijbetaling in het uiterste scenario dat fabrikanten hun prijzen niet verlagen, patiënten niet wisselen naar een geneesmiddel zonder bijbetaling en zonder toepassing van het instrument «medische noodzaak». Ik zal u, zoals toegezegd, voor het einde van dit kalenderjaar informeren over de stand van zaken van de GVS modernisering en daarin ook een update geven van deze aantallen (t.a.v. patiënten met een bijbetaling en wisselingen).
Daarnaast treed ik in de voorbereiding van de uitvoering van de GVS modernisering ook in gesprek met leveranciers en groothandels over de beschikbaarheid van geneesmiddelen gedurende de periode rondom het moment van herberekening.
49.
Wat is de impact van de zesmaandelijkse Wgp-herberekening op de aanwezige voorraadwaarde voor fabrikanten? Vindt u dat er met deze extern opgelegde voorraadwaardeverlaging rekening gehouden dient te worden? Indien nee, wat verwacht u dan van fabrikanten?
Bij iedere herijking van de wettelijke maximumprijzen op grond van de Wgp kunnen er wijzigingen optreden in de hoogte van de wettelijke maximumprijzen, onder meer door ontwikkelingen in prijsstelling in de vier referentielanden. Of een prijsschommeling ook effect heeft op de waarde van de voorraad en of dat effect dan waardeverlagend of waardeverhogend is, hangt af van verschillende factoren, bijvoorbeeld of het gaat om een prijsstijging of -daling. Bovendien geldt dat de Wgp niet voor gehele markt een prijsregulerend effect heeft (als de apotheek inkoopprijs (ruim) onder de Wgp maximumprijs ligt, heeft een eventuele prijsschommeling bij een herijking geen effect op de voorraadwaarde). Kijken we naar aantallen pakjes, dan geldt dat voor ongeveer twee derde van alle pakjes geneesmiddelen (het merendeel generieke middelen) in Nederland de maximumprijs vanuit de Wgp als prijsinstrument geen rol speelt (zie ook mijn antwoord op vraag 115). Dit betekent dat voor die groep middelen een prijsschommeling geen effect heeft op de voorraadwaarde.
Voor de groep geneesmiddelen waar een eventuele prijsdaling wel effect kan hebben op de voorraadwaarde, kan een prikkel uitgaan van de herijking voor het verminderen van voorraden. Dit hangt ook af van op welke manier marktpartijen hiermee omgaan in onder meer de contractering. Sommige partijen geven aan zorgen te hebben over de herijking van de Wgp in de relatie tot de opbouw van voorraad tot 1 juli 2022 en het continue behoud van voorraad daarna. Ik bespreek dit met partijen in de verdere uitwerking.
50.
Kunt u aangeven hoeveel producten er jaarlijks van de Nederlandse markt teruggetrokken worden? Hoeveel extra terugtrekkingen verwacht u door de ijzeren voorraad eis?
In 2019 waren er 325 medicijnen die definitief uit de handel werden genomen.9
In 2018 waren dat er 316. In deze gevallen blijft de handelsvergunning wel bestaan. In 2018 is voor 1208 producten de handelsvergunning ingetrokken. In 2019 waren dat er 1385.10
Ik kan op dit moment geen concrete inschatting maken van het aantal terugtrekkingen dat verband zou hebben met de ijzeren voorraad. Zie ook de antwoorden op vraag 10 en 114.
51.
Welke (financiële voorraad) risico’s (hoe hoog) gaan fabrikanten en groothandelaren lopen als gevolg van de voorraadverplichting?
Er is aandacht voor deze risico’s. Deze worden betrokken in de nadere uitwerking.
52.
Hoe gaat u fabrikanten en groothandels compenseren voor deze door u opgelegde maatregelen, zoals prijsregulering/beleidsrisico’s? Hoe gaat u deze compensatie/ kosten vergoeden?
Ik ben nog in gesprek met partijen over de vormgeving van de financiering.
53.
Verwacht u meer spillage/vernietiging door houdbaarheid of tenderaanwijzingen van geneesmiddelen door de extra voorraad bij fabrikanten? Indien ja, hoeveel meer?
Het aanleggen van de ijzeren voorraad kan extra verspilling van geneesmiddelen veroorzaken, ondanks onze specifieke aandacht voor dit negatieve bijeffect. Ik vind dit risico tot op zekere hoogte acceptabel, gezien het grote belang voor de continuïteit van de farmaceutische zorg. We bekijken welke afspraken gemaakt kunnen worden om de aanvullende verspilling zo klein mogelijk te houden. Daarbij kan onder andere gedacht worden aan afspraken die partijen onderling maken over minimale houdbaarheidstermijnen.
In het Gupta rapport over de gevolgen van het aanleggen van een ijzeren voorraad is een inschatting van spillage gemaakt op basis van interviews.11 Hieruit blijkt dat door een ijzeren voorraad van 5 maanden het huidige spillageratio zal toenemen met maximaal 30%. De totale spillage als wordt vervolgens geschat op 0,1% bij de groothandel (met 30% toename blijft dit 0,1%) en 2–3% bij leverancier.
54.
Hoe hoog wordt de extra werkbelasting en door welke partij?
De precieze verandering in werkbelasting is lastig te bepalen doordat het van meerdere facetten afhankelijk is. Er is mogelijk meer mankracht nodig voor voorraadbeheer en monitoring, tegelijkertijd is er minder capaciteit nodig voor het oplossen van tekorten.
Door de aanwezigheid van een ijzeren voorraad zullen apothekers minder vaak op zoek hoeven naar een alternatief geneesmiddel voor patiënten. Uit het Gupta onderzoek naar de gevolgen van een ijzeren voorraad blijkt uit interviews dat een gemiddelde apotheek op dit moment een halve tot een dag per week kwijt is aan het omgaan met tekorten (~0,2 fte).
Uit de interviews blijkt ook dat farmaceuten en groothandels doorgaans ook één of meer FTE hebben om tekorten te registreren en om te gaan met de gevolgen. Dit zal waarschijnlijk teruggeschroefd kunnen worden, hoewel er tegelijkertijd mogelijk mankracht nodig zal zijn voor voorraadbeheer.
55.
Indien u handhavingsboetes overweegt: kunt u modellen bedenken waarbij u niet een statische boete oplegt maar een dynamische, bijvoorbeeld gerelateerd aan de omzet van het betreffende product?
De Minister heeft reeds beleidsregels opgesteld, waarmee de hoogte van een bestuurlijke boete wordt gedifferentieerd (Beleidsregels bestuurlijke boete Ministerie Volksgezondheid Welzijn en Sport 2019). In deze boetebeleidsregels worden diverse factoren meegewogen in het bepalen van de uiteindelijke boete, waaronder de grootte van de organisatie maar ook de omvang van de overtreding. De IGJ past deze beleidsregels in de regel standaard toe wanneer zij namens de Minister een bestuurlijke boete oplegt.
56.
Kunt u toelichten in welke mate de teruglopende voorraden de afgelopen jaren precies hebben bijgedragen aan de leveringsonderbrekingen van geneesmiddelen in ons land, uitgesplitst per jaar? Kunt u daarbij de vergelijking trekken met de bijdrage van externe factoren aan leveringsonderbrekingen, zoals exportrestricties, productiefouten en andere obstakels in de supply chain van producent naar patiënt?
Tekorten ontstaan door vele verschillende factoren en ook door een interactie van factoren. Het meldpunt rapporteert ieder jaar over de redenen van een gemelde verwachte leveringsonderbreking. In 2019 is vertraging van de productie of vrijgifte van het eindproduct de meest genoemde oorzaak (58%), gevolgd door leveringsproblemen door een toegenomen vraag (21%). Voor de overige uitsplitsing verwijs ik u naar het rapport.12 Doordat er sprake is van teruglopende voorraden zijn er wereldwijd steeds minder buffers in de keten aanwezig om tijdelijke problemen goed op te vangen. Dit zorgt ervoor dat een tijdelijk probleem sneller kan leiden tot een daadwerkelijk tekort waar de patiënt aan de balie hinder van ondervindt.
57.
Is er een verschil tussen generieke geneesmiddelen en spécialité geneesmiddelen in het aantal tekorten, de mate waarin bij tekorten een substituut voorhanden is en de financiële gevolgen van de tekorten? Is in dit licht een gedifferentieerde aanpak voor de ijzeren voorraad overwogen?
Zie antwoorden vraag 5 en 20.
58.
Kunt u ingaan op de verschillen in verspilling tussen een generieke ijzeren voorraad en een ijzeren voorraad waartoe slechts essentiële geneesmiddelen behoren of waarbij wordt gedifferentieerd tussen generiek en spécialité?
Dit is niet in detail geanalyseerd. Het is aannemelijk dat het risico op verspilling hoger is bij een bredere verplichting.
59.
Wat scheelt iedere maand aan (generieke) ijzeren voorraad aan extra verspilling?
In het Gupta rapport wordt ingeschat dat elke maand extra voorraad bovenop de huidige safety stock van gemiddeld 2 maanden zal leiden tot een toename in verspilling van ongeveer 10%.13
60.
Zou de tijdige inzameling van (deels) ongebruikte, houdbare medicijnen op een veilige manier zo kunnen worden vormgegeven dat dit bijdraagt aan het tegengaan van verspilling en tekorten?
Mijn ambtsvoorganger heeft eerder uw Kamer geïnformeerd over het proces van heruitgifte van medicijnen, dat dit in de praktijk weerbarstig is en het niet zomaar mogelijk is om deze opnieuw uit te geven. Er zijn strenge waarborgen ingebouwd om de veiligheid van een medicijn te garanderen. Daarnaast wegen bij een groot deel van de medicijnen de logistieke en administratieve handelingen niet op tegen mogelijke besparingen in euro’s. In 70 procent van de gevallen kosten deze medicijnen namelijk minder dan ongeveer € 2,50 per patiënt per maand. Alleen bij dure medicatie is heruitgifte dus opportuun. Het Radboudumc is samen met de Universiteit Utrecht gestart met een onderzoek gesubsidieerd door ZonMW naar het opnieuw uitgeven van (dure) orale kankermedicijnen (oncolytica). In mijn brief van 8 oktober (Kamerstuk 29 477, nr 663) met best practices die verspilling van geneesmiddelen helpen voorkomen, informeer ik u verder over de status van dit onderzoek.
61.
Kunt u nader toelichten in hoeverre de teruglopende voorraden de afgelopen jaren tot hogere winst(marges) hebben geleid bij leveranciers, groothandels en apotheken? Kunt u daarbij ingaan op het aandeel van «just-in-time delivery» en «central filling»?
Het aanhouden van voorraad kost geld. Hoe minder voorraad en hoe meer «just-in-time», hoe groter de kostenbesparing. Bij het gelijk blijven van andere factoren zorgt dit voor een hogere omzet. Central filling houdt in dat de geneesmiddelen bij de groothandel gereed worden gemaakt voor de patiënt (d.w.z. hoeveelheid afgemeten voor de patiënt, en sticker met patiënten informatie toevoegen). Dit wordt bijvoorbeeld gedaan bij herhaalrecepten.
Deze handelingen vinden normaliter plaats bij de apotheek. Uit het eerder benoemde onderzoek van Gupta blijkt dat voor deze geneesmiddelen de apotheek vrijwel geen voorraden meer aanhoudt. De afname in de voorraad bij de apotheek van deze geneesmiddelen wordt niet gecompenseerd door een grotere voorraad bij de groothandel.
62.
Hoe is de financiële verdeling van de extra kosten voor de ijzeren voorraad tussen de ketenpartijen en de collectieve zorguitgaven tot stand gekomen? Is deze gelieerd aan de (mogelijk) hogere winst(marges) of komt de verdeling simpelweg voort uit hetgeen de ketenpartijen hierna maximaal kunnen doorberekenen in hogere prijzen op grond van de wettelijke kaders?
Ik ben op dit moment nog in overleg met veldpartijen over de vormgeving van de financiering.
63.
Heeft de aanleg van de ijzeren voorraad slechts betrekking op leveranciers, groothandels en apotheken in Nederland? Of gaat dit ook worden verplicht voor partijen over de grens met een voor Nederland geoormerkt deel? Als dat het geval is, hoe wilt u dit juridisch vormgeven?
De ijzeren voorraad heeft betrekking op houders van een handelsvergunning van een tot de Nederlandse markt toegelaten geneesmiddel (al dan niet gevestigd in het buitenland) en Nederlandse groothandels als eigenaar van geneesmiddelen die ook fysiek in het buitenland kunnen zijn opgeslagen.
64.
Kunt u nader onderbouwen dat door de maatregel naar verwachting gemiddeld 85% van de kortdurende tekorten wordt opgevangen? Hoe zit dit met de langlopende tekorten?
Gupta Strategistst heeft eind 2019 een onderzoek opgeleverd waarin zij, gebaseerd op historische data, hebben onderzocht wat de effecten van verschillende grootte aan voorraden zouden zijn. Zij keken daarbij naar de duur van kortdurende tekorten in het verleden en hoeveel van deze tekorten «overbrugd» hadden kunnen worden met de aanwezigheid van een ijzeren voorraad. Langlopende tekorten zijn niet meegenomen in dit onderzoek.
65.
Wanneer komt het Europese onderzoek naar de oorzaken van geneesmiddelentekorten beschikbaar?
66.
Kunnen de uitkomsten van dit Europese onderzoek van invloed zijn op de voorgestelde Nederlandse aanpak?
67.
Kunt u toelichten of, en zo ja wanneer, er een afgestemde Europese aanpak komt om tekorten aan geneesmiddelen tegen te gaan? In hoeverre is het voornemen van een ijzeren voorraad in Nederland in lijn met een Europese aanpak of in hoeverre kan deze de Europese aanpak juist doorkruisen?
68.
Ziet u het risico dat landen elkaar onderling gaan beconcurreren op het aanleggen van steeds grotere voorraden? Zo ja, ziet u mogelijkheden om dit risico te mitigeren door middel van goede, eenduidige Europese afspraken?
69.
In hoeverre bent u bereid in te zetten op harmonisatie op Europees niveau met betrekking tot het aanleggen van voorraden en monitoring?
Antwoord vragen 65 t/m 69
De eindresultaten van het onderzoek van de Europese Commissie verwacht ik september 2021. Ik vind het belangrijk om de complexe oorzaken van geneesmiddelentekorten op Europees niveau zo geharmoniseerd als mogelijk te bestrijden. Echter zijn dit acties van de lange adem. Nationaal wil ik me daarom inzetten om de gevolgen van ontstane problemen voor de patiënten op de korte- en middellange termijn zoveel mogelijk te verkleinen. Het is niet ondenkbaar dat als er op enig moment een geharmoniseerde Europese aanpak is uitgekristalliseerd, de nationale oplossingsrichtingen (deels) wordenaangepast.
70.
Welke ijzeren voorraden worden aangehouden in andere EU-lidstaten of welke plannen voor een ijzeren voorraad hebben zij in de maak?
Kan daarbij tevens een vergelijking worden getrokken tussen de tekorten in de betreffende lidstaten en de tekorten in Nederland? Zie antwoord vraag 8.
71.
In welke landen wordt niet voor alle geneesmiddelen, maar voor een beperkt aantal – een essentiële lijst – een voorraad aangehouden?
Zie antwoord vraag 8.
72.
Zijn er wezenlijke verschillen in tekorten tussen EU-lidstaten onderling en zo ja, wat is daarvan de oorzaak?
Er zijn niet zozeer wezenlijke verschillen in de tekorten tussen de lidstaten, maar wel in de impact van de tekorten als gevolg van de verschillen in de plaats van een middel in de behandeling. De medische behandelpraktijk is verschillend tussen de EU-lidstaten.
73.
Ziet u op dit moment nog praktische problemen bij de geplande uitrol van de aanleg van de ijzeren voorraad of verwacht u dat dit zonder noemenswaardige problemen zal verlopen?
Ik zie nog veel vraagstukken die ik samen met partijen op een goede manier wil en moet adresseren, onder andere rondom de financiering.
74.
Kunt u nader toelichten hoe u de monitoring met handhaving onder het principe «pas toe of leg uit» precies wil vormgeven? Welke waarborgen zijn in deze monitoring inbegrepen?
Dit wordt op dit moment nader uitgewerkt.
75.
Kunt u nadere informatie geven over de laatste stand van zaken van de groothandel die onlangs aangaf dat hij zijn voorraden voor de Nederlandse markt gaat afbouwen als gevolg van de aanscherping van de Wgp?
Naar aanleiding van de eerdere uitingen in de media heeft IGJ contact opgenomen met de betreffende groothandel en navraag gedaan naar de exacte handelwijze. De betreffende groothandel heeft aangegeven dat de voorraden normaal gesproken worden afgebouwd in de weken voorafgaand aan de prijsverlagingen en direct daarna weer worden opgebouwd. Dit is een handelwijze die door meerdere groothandelaren gebezigd wordt. De groothandel heeft daarbij de continuïteit van zorg richting patiënten in ogenschouw genomen.
76.
Over welk instrumentarium beschikt de Inspectie voor Gezondheid en Jeugd in geval een fabrikant zich niet aan de afspraken houdt? Kunt u een indicatie geven of en wanneer dit zal worden ingezet?
De IGJ houdt toezicht op naleving van de Geneesmiddelenwet. Op basis van de Geneesmiddelenwet is een handelsvergunninghouder verplicht om behoudens uitzonderlijke omstandigheden zorg te dragen voor voldoende voorraden voor groothandelaren of apothekers om in de behoeften van patiënten te kunnen voorzien. In de nieuwe beleidsregel concretiseren we wat voldoende voorraad inhoudt. Dit wordt op dit moment nader uitgewerkt. De IGJ zal dan in lijn met de beleidsregel toezicht houden.
Verder is de houder van de handelsvergunning verplicht de betrokken autoriteiten onverwijld, maar tenminste twee maanden van tevoren, op de hoogte te stellen van mogelijke handelsonderbrekingen. Wanneer een handelsvergunninghouder deze verplichtingen niet nakomt is mogelijk sprake van een wettelijke overtreding. De IGJ kan vervolgens overwegen om een passende maatregel op te leggen, waarbij de IGJ de Beleidsregels bestuurlijke boete Ministerie Volksgezondheid Welzijn en Sport 2019 in acht neemt.
77.
Op welke wijze is de op het hoogtepunt van de coronacrisis opgetuigde samenwerking tussen de betrokken leveranciers, groothandels, zorgverzekeraars, apothekers en overheidspartijen thans nog van kracht?
Tijdens het hoogtepunt van de coronacrisis is er veelvuldig contact geweest tussen leveranciers, groothandels, zorgverzekeraars, apothekers en overheidspartijen, o.a. in het Coronaberaad maar ook buiten dit overleg om. Daarnaast is het Landelijk Coördinatiecentrum Geneesmiddelen (LCG) opgericht, het LCG heeft veel contact met leveranciers en groothandels. Deze contacten zijn er nog steeds, maar met een wisselende frequentie.
78.
Tot wanneer zal het Landelijk Coördinatiecentrum Geneesmiddelen (LCG) zijn werkzaamheden voortzetten?
Het bekrachtigingsdocument tussen VWS en het LCG is verlengd tot 31 december 2020. Ik wil de opdracht aan het LCG verlengen na 31 december voor een periode van twee jaar, in aangepaste vorm. Het is mijn inzet om de ziekenhuizen een voorraad van Corona gerelateerde IC-medicatie aan te laten leggen, die gemonitord wordt door het LCG. Het LCG zal op basis van de verdeling van IC-bedden voor ieder ziekenhuis berekenen welke hoeveelheden van deze geneesmiddelen nodig zijn voor het opschalen van de IC-capaciteit om zo een tweede piek van IC-opnames goed op te vangen. In overleg met leveranciers en groothandels worden afspraken gemaakt over hoe deze benodigde hoeveelheden als voorraad voor de Nederlandse ziekenhuizen opgebouwd zal worden.
79.
Tot wanneer zal het Coronaberaad zijn werkzaamheden voortzetten? Het overleg in het Coronaberaad zal voortduren zolang de Covid-crisis voortduurt. De frequentie van het overleg wordt wel aangepast aan de situatie.
80.
Welke instrumenten zijn succesvol ingezet om de leveringszekerheid te garanderen?
Er is een aantal instrumenten succesvol ingezet. Over deze instrumenten heb ik u geïnformeerd in de Kamerbrieven van 20 maart, 31 maart, 7 april, 16 april, 22 april en 6 mei.14 Het is niet mogelijk om per instrument het effect te bepalen.
81.
Bent u voornemens om succesvolle initiatieven om leveringszekerheid te garanderen ook regulier in te zetten om geneesmiddelentekorten te voorkomen?
Tijdens de Covid-crisis is het uitgangspunt altijd geweest dat ik de markt en het bestaande stelsel zoveel mogelijk in tact heb willen houden, maar op een aantal punten heb ik hier wel concessies in gedaan (bijvoorbeeld bij de aanleg van de Covid crisisvoorraad). Ik ben voornemens om succesvolle initiatieven om leveringszekerheid te garanderen die passen in de bestaande structuur en stelsel ook in te zetten om reguliere geneesmiddelentekorten te voorkomen, maar alleen waar dit ook mogelijk en proportioneel is. Ik zal dit bespreken met de leden van de werkgroep geneesmiddelentekorten.
82.
Worden succesvolle elementen uit het coronaberaad ook ingezet bij het monitoringssysteem van de ijzeren voorraad? Zo ja, welke? Zo nee, waarom niet?
De vrijwillige, tijdelijke monitor die in het kader van de Covid-crisis door fabrikanten en groothandels is gestart, wordt geëvalueerd. Bruikbare lessen uit deze evaluatie zal ik ook gebruiken bij de nadere uitwerking van een monitoringssysteem in het kader van de ijzeren voorraad.
83.
Waarom is de corona-monitor vrijwillig en niet verplicht. Klopt het dat er zonder verplichting geen integraal overzicht kan zijn?
Ik ben blij dat fabrikanten en groothandels in het kader van het borgen van de beschikbaarheid van kwetsbare geneesmiddelen het initiatief zijn gestart om een risicogerichte lijst met geneesmiddelen vrijwillig gezamenlijk te monitoren. Aangezien dit initiatief vrijwillig is gestart, zie ik ook geen aanleiding tot een andere inrichting van de monitor.
84.
Hoe functioneert het LCG op dit moment? Wanneer is berekend hoeveel geneesmiddelen er nodig zijn voor een eventuele tweede golf? Kunnen die dan nog wel op tijd worden ingekocht?
Het LCG monitort op dit moment de voorraden van de corona gerelateerde IC- geneesmiddelen bij groothandels, firma’s en ziekenhuizen en rapporteert mij hier wekelijks over. Op dit moment zijn er voldoende voorraden aanwezig van deze middelen. Het LCG heeft al berekend welke hoeveelheid van de geneesmiddelen nodig is voor de opschaling van de IC-capaciteit, en deze hoeveelheid geneesmiddelen is aanwezig in Nederland bij groothandels, firma’s en leveranciers. Het LCG is op dit moment actief betrokken bij de opbouw van een noodvoorraad van deze medicatie en zal per ziekenhuis berekenen (o.a. op basis van de beddenverdeling) welk deel van deze voorraad de ziekenhuizen moeten inkopen bij de groothandels en firma’s.
De benodigde voorraden van het nieuwe middel remdesivir worden niet door het LCG berekend of gemonitord omdat de verdeling en distributie plaatsvindt via de EU. Wel heeft het LCG in verband met de huidige schaarste aan remdesivir onlangs samen met de SWAB en de beroepsgroepen remdesivir besparend voorschrijfbeleid gecommuniceerd naar de ziekenhuizen.
85.
Ten aanzien van: «Dit komt mede door een snelle en efficiënte samenwerking tussen de betrokken leveranciers, groothandels, zorgverzekeraars, apothekers en overheidspartijen. Door korte lijnen te houden, boven de eigen belangen uit te stijgen en snel te handelen kon voor wat betreft COVID-19 goed worden ingespeeld op de ontwikkelingen en konden daadwerkelijke tekorten aan het bed worden voorkomen.» (pagina 1). Welke instrumenten zijn succesvol ingezet om de leveringszekerheid te garanderen?
Bent u voornemens om deze ook regulier in te zetten om geneesmiddelentekorten te voorkomen?
Zie antwoorden vraag 80 en 81.
86.
U schrijft dat uit het coronaberaad onder andere het initiatief voortkwam om een vrijwillige, tijdelijke risico-gerichte monitor in te stellen waarbij aanbod en gebruik van een aantal kritische geneesmiddelen gekoppeld worden. Worden succesvolle elementen hieruit ook ingezet bij het monitoringssysteem van de ijzeren voorraad? Zo ja, welke? Zo nee, waarom niet?
Zie antwoord vraag 82.
87.
Kunt u aangeven of het aantal medicijnen waarvoor dreigende leveringsonderbrekingen zijn gemeld in 2019, in andere Europese landen ook gestegen is ten opzichte van het aantal medicijnen in 2018? In welke Europese landen is dit nog meer het geval en gaat het hierom dezelfde medicijngroepen? Hoeveel van deze meldingen zijn specifiek voor Nederland en niet voor andere landen?
De toename in leveringsonderbrekingen speelt ook in de andere lidstaten en zelfs wereldwijd. Indien er leveringsproblemen zijn voor een middel dat ook gebruikt wordt in andere landen, dan geldt dat ook daar problemen optreden met de beschikbaarheid. De impact van het leveringsprobleem kan verschillen tussen de lidstaten, bijvoorbeeld door een verschil in de hoeveelheid beschikbare alternatieven of door een verschil in de plaats dat het middel heeft in de behandeling.
88.
Kunt u aangeven bij hoeveel van deze meldingen van dreigende leveringsonderbrekingen er niet tijdig een alternatief is gevonden?
Zie antwoord vraag 1.
89.
Kunt u aangeven waarom er niet voor gekozen is om een essentiële lijst met geneesmiddelen te hanteren waarvoor een voorraad moet worden gehouden?
Zie antwoord vraag 20.
90.
Kunt u aangeven in welke andere Europese landen ook een ijzeren voorraad is afgesproken? Welke andere Europese landen hanteren een ijzeren voorraad van vijf maanden, en welke landen hanteren een ijzeren voorraad van kortere of langere duur?
Zie antwoord vraag 8.
91.
Wat is het effect van de parallelhandel (import en export) in geneesmiddelen op de verschillende voorraadregimes in de EU-landen?
Parallelhandel kan een rol spelen bij zowel het ontstaan als het oplossen van tekorten. Parallelhandel is onderdeel van de vrije markt en is daarmee in beginsel toegestaan in alle Europese lidstaten. In sommige landen geldt een meldingsplicht voor parallelexport van bepaalde geneesmiddelen op het moment dat er sprake is van (dreigende) tekorten. Het is mij onbekend of er een effect is op de verschillende voorraadregimes. De verschillende
voorraadregimes worden op dit moment in kaart gebracht.
92.
Bent u bereid een impactanalyse te maken naar de gevolgen van verschillende voorraadregimes in Europese landen die onderling verweven zijn, waarbij is gekeken naar de kosten en beschikbaarheid van geneesmiddelen?
Ik ga niet zelf een dergelijke impactanalyse maken, omdat de Europese Commissie op dit moment bezig is met een uitgebreid onderzoek naar de oorzaken van tekorten in Europa. Hierin wordt ook gekeken naar de aanpak in verschillende lidstaten.
93.
Kunt u aangeven wanneer het ontwikkelen van een Europees monitoringssysteem door u opportuun wordt geacht?
Ik begrijp dat de voorkeur van sommige veldpartijen uitgaat naar een geharmoniseerd monitoringssysteem. Ik sta hier ook voor open, mits dit haalbaar blijkt. Er loopt op dit moment een pilot voor een Europees monitoringssysteem met vijf Covid-gerelateerde geneesmiddelen, Nederland neemt ook deel aan deze pilot.
94.
Kunt u aangeven wat de acties zullen zijn indien de ijzeren voorraad niet volledig beschikbaar is op 1 juli 2022? Zullen er bepaalde geneesmiddelen prioritair worden verklaard?
Het uitgangspunt is dat de ijzeren voorraad per 1 juli 2022 gereed moet zijn. De exacte implementatie en wijze van handhaving nadat de beleidsregel van kracht is, wordt nog uitgewerkt.
95.
Heeft u ook de mogelijkheid onderzocht om de ijzeren voorraad enkel te voorzien voor bepaalde productgroepen of om een kortere termijn op te leggen voor productgroepen waarvan de voorraad beperkt is?
Zie antwoord vraag 20.
96.
Waarom is gekozen voor een voorraad van vier maanden bij de leveranciers en een maand bij de groothandels?
De redenen hiervoor staan beschreven in de Kamerbrief d.d.7 juli 2020.15
Meerdere partijen hadden mij hierom verzocht. Met deze verdeling ontstaat (ook volgens de meeste veldpartijen) een eenvoudiger model, met lagere kosten, dat ook makkelijker controleerbaar en handhaafbaar is.
97.
Welke rol spelen fabrikanten bij het opbouwen van deze voorraad?
Op dit moment is er een wettelijke verplichting voor onder andere fabrikanten (zijnde Nederlandse vergunninghouder) om «voldoende voorraad» geneesmiddelen aan te houden. Fabrikanten dienen te borgen dat zij voldoen aan de eisen omtrent voldoende voorraad.
98.
In welke mate komt bij de verschillende financieringsvormen de rekening bij de patiënt te liggen?
Zie antwoord vraag 24.
99.
In welke mate worden veldpartijen betrokken bij het eventueel tussentijds aanscherpen van beleidsregels?
Veldpartijen worden geconsulteerd bij het opstellen en aanscherpen van de beleidsregel.
100.
Uiterlijk 1 juli 2022 moet de ijzeren voorraad gereed zijn. Kan nader worden gespecificeerd hoe de opbouw is in de komende twee jaar en hoe gemonitord gaat worden of het juiste pad wordt bewandeld om de doelstellingen te halen?
Zoals beschreven in de kamerbrief van 7 juli jl. wordt gewerkt met een gefaseerde aanpak. In de Werkgroep geneesmiddelentekorten is een voorstel over de nadere operationalisering van deze gefaseerde aanpak besproken. Dit wordt nu verder uitgewerkt.
Er zijn vier gezamenlijke evaluatiemomenten (januari 2021, juni 2022, januari 2022 en juni 2022) ingesteld om de voortgang te monitoren en te identificeren waar eventuele knelpunten ontstaan. Deze evaluaties zullen ook gebruikt worden om waar nodig afspraken te verscherpen, de concept beleidsregels te actualiseren of andere maatregelen te treffen. Uw Kamer wordt na ieder evaluatiemoment geïnformeerd over de voortgang.
101.
Waarom wordt de wettelijke verplichting om voldoende voorraad te hebben niet gehandhaafd, maar wordt ruimte geboden deze wettelijke verplichting niet na te komen tot 1 juli 2022?
Het klopt niet dat de huidige wettelijke verplichting om voldoende voorraad te hebben niet gehandhaafd wordt. De aanvullende beleidsregel treedt per 1 juli 2022 in werking.
102.
Kan worden aangegeven voor hoeveel en welke geneesmiddelen geldt dat er gedreigd werd met een tekort en er ook daadwerkelijk een tekort is opgetreden in 2019 en 2020?
Zie antwoord vraag 1.
103.
Waarom wordt gekozen voor een voorraad van vijf maanden, terwijl de wet «voldoende voorraad» voorschrijft? Is vijf maanden voorraad in alle gevallen voldoende?
104.
Waarom worden de minimale voorraden niet in de wet vastgelegd? Zou dit de toezichtstaak van de IGJ vergemakkelijken?
Antwoord vraag 103 en 104
Voldoende voorraad is een open begrip. Met de beleidsregel scheppen we helderheid over wat in beginsel beschouwd wordt als voldoende voorraad.
105.
Hoe is het streven naar een ijzeren voorraad per 1 juli 2022 te rijmen met het handhaven van een reeds bestaande wettelijke verplichting?
De reeds bestaande wettelijke verplichting wordt nog steeds gehandhaafd zoals deze ook tot nu toe is gehandhaafd door de IGJ.
106.
Waarom gaat de IGJ pas vanaf 1 juli 2022 toezicht houden op de gekwantificeerde verplichting en waarom niet eerder tenminste al toezicht op de voortgang van de opbouw?
De houder van een handelsvergunning is volgens de Geneesmiddelenwet nu al verplicht zorg te dragen dat het geneesmiddel waarop de handelsvergunning betrekking heeft, in voldoende mate voorradig is voor groothandelaren of apothekers teneinde in de behoeften van patiënten te kunnen voorzien. IGJ houdt reeds toezicht op het zorgdragen voor voldoende voorraden. Voor het specifiek toezicht houden op het aanleggen van een ijzeren voorraad bestaat
op dit moment (nog) geen (juridische) grondslag.
107.
Hoe ziet het toezicht door de IGJ op de reeds bestaande niet gekwantificeerde verplichting er op dit moment uit? Kan precies worden aangegeven wat in de afgelopen twee jaar aan activiteiten in het kader van dit toezicht is uitgevoerd, hoeveel controles zijn uitgevoerd en waar, hoeveel boetes zijn opgelegd en aan wie?
IGJ heeft tot op heden twee keer een maatregel getroffen naar aanleiding van onderzoeken naar leveringsproblemen met geneesmiddelen. Daarnaast lopen er momenteel nog meerdere onderzoeken. Deze hebben deels betrekking op de meldingsverplichting, deels op de voorraadverplichting. Afronding van deze onderzoeken wordt eind oktober verwacht. De toezichtrapporten zullen dan conform het huidige openbaarmakingsbeleid openbaar gemaakt worden en worden gepubliceerd op de IGJ website. Boetes maakt IGJ conform het openbaarmakingsbeleid (Gezondheidswet/Jeugdwet) niet actief openbaar.
108.
U schrijft dat de gemaakte afspraken en de concept beleidsregels tussentijds aangescherpt worden. Worden daarbij veldpartijen betrokken?
Ja, partijen worden geconsulteerd.
109.
Welke geneesmiddelen zijn ten gevolge van de COVID-19 crisis onvoldoende beschikbaar geweest? Voor welke geneesmiddelen is gewaarschuwd voor een tekort en voor welke geneesmiddelen geldt dat daadwerkelijk een tekort is opgetreden?
Er is enige tijd bijzondere aandacht geweest voor de beschikbaarheid van noradrenaline en propofol.16 Door de inzet van verschillende acties en maatregelen is in alle dreigende situaties tijdig een alternatief gevonden. Alleen recent voor het nieuwe middel remdesivir is er niet constant genoeg voorraad. Dit is een bijzondere casus vanwege de distributie via de EU.
110.
Kunnen de redenen waarom partijen extra voorraad mogelijk niet hebben kunnen opbouwen exact worden aangegeven?
Het kost tijd om extra voorraad op te bouwen. Sommige geneesmiddelen worden slechts 1 of 2 keer per jaar geproduceerd. Daarnaast is er vanwege de Covid-crisis is er sprake geweest van onrust op de markt.
111.
Wat zijn de consequenties als partijen uiterlijk 1 november 2020 geen plan voor fasering indienen? Waarom wordt niet gesteld dat de wet dan gewoon per direct gehandhaafd wordt?
Zoals eerder aangegeven wordt de wet dat «voldoende voorraad» aangehouden moet worden, nog steeds gehandhaafd. Het per direct laten ingaan van de beleidsregel is niet realistisch vanwege de verschillende vraagstukken die nog meer in detail geadresseerd moeten worden. Daarnaast is het niet mogelijk om direct te verwachten dat de vijf maanden voor alle geneesmiddelen overal op orde zijn, omdat het aanleggen van voorraden tijd kost.
112.
Wat wordt verstaan onder een «niet vrijblijvend tijdschema»?
Ik wil graag partijen de ruimte bieden om op een voor hun zo werkbaar mogelijke manier de ijzeren voorraden op te bouwen. Dit betekent wel dat als zij aangeven dit op een bepaalde manier te gaan doen, ik ook verwacht dat zij zich houden aan de gemaakte afspraken.
Een gefaseerde aanpak is in ons ieder belang, omdat we zo waar nodig op basis van praktijkervaring tijdig de koers kunnen bijstellen.
113.
Waarom is er voor gekozen een deel van de kosten voor een verplichte voorraad alsnog bij de burgers neer te leggen, terwijl de wet voorschrijft dat de groothandelaar voor een voldoende voorraad moet zorgen?
Het aanhouden van extra voorraad kost geld. Ik begrijp dat een voorraadverplichting mogelijk financiële gevolgen kan hebben voor sommige fabrikanten, bijvoorbeeld fabrikanten van generieke geneesmiddelen met lage omzet. Ik vind het daarom belangrijk om dit goed met elkaar te verkennen.
Gezien de verwachte positieve effecten van de ijzeren voorraad acht ik dit redelijk.
114.
Kan precies worden aangegeven welke partijen «zorgen hebben geuit over onder andere het effect van prijsregulerende instrumenten (zoals de Wet geneesmiddelenprijzen (Wgp), het geneesmiddelenvergoedingssysteem (GVS) en het inkoopbeleid van zorgverzekeraars) op de beschikbaarheid van de kwetsbare geneesmiddelen aan de onderkant van de geneesmiddelenmarkt in Nederland» en kan daarbij worden aangegeven welke zorgen iedere partij heeft geuit en in hoeverre deze terecht lijken?
Zowel de fabrikanten, groothandels als apothekers hebben in sterke of minder sterke mate hun zorgen geuit over de geneesmiddelenvoorziening «aan de onderkant van de markt» door een afname van inkomsten en/of toename van kosten. Dit kan volgens deze partijen ervoor zorgen dat het niet meer (even) aantrekkelijk is om een geneesmiddel aan te bieden op de Nederlandse markt. Op 26 juni 2020 heeft mijn voorganger al toegezegd structureel meer aandacht te hebben voor de geneesmiddelenvoorziening van deze geneesmiddelen en te werken aan een toekomstbestendige aanpak.1718 Ik informeer u rond de jaarwisseling over de invulling van deze toezegging.
115.
Kunt u aangeven waar de Wet geneesmiddelenprijzen eventueel een belemmering kan vormen wanneer het Apotheek Inkoop Prijs-model als financieringsvorm voor de ijzeren voorraad ingesteld zal worden?
Als we kijken naar aantallen pakjes, dan geldt dat voor ongeveer twee derde van alle pakjes geneesmiddelen in Nederland de maximumprijs vanuit de Wgp geen rol speelt. Als we kijken naar omzet, dan geldt dat voor het merendeel van de generieke geneesmiddelen de apotheek inkoopprijs (AIP) (ruim) onder de wettelijke maximumprijs ligt die is vastgesteld op basis van de Wgp. Voor die middelen is er wettelijk gezien nog ruimte voor de fabrikant om de AIP te verhogen. Voor spécialités (gepatenteerde geneesmiddelen) is dit het geval bij ongeveer veertig procent van de totale omzet op spécialité geneesmiddelen.
Op dit moment werken we verder uit hoe de financiering van de ijzeren voorraad eruit zal zien. Daarin nemen we dit aspect mee.
116.
Kunt u uiteenzetten hoe de financiële compensatie gaat zijn voor het aanhouden van dure geneesmiddelen met relatief beperkte houdbaarheid?
De wijze van financiering wordt op dit moment nader uitgewerkt.
117.
Is er een impactanalyse gemaakt over hoe het huidige Nederlandse geneesmiddelenbeleid, zoals preferentiebeleid, Wgp en parallel import/export, effect heeft op het volume aan tekorten?
Er is op dit moment geen impactanalyse beschikbaar waarin al deze elementen zijn meegenomen. Wel is er zoals beschreven in het antwoord op vraag 114 structurele aandacht voor de geneesmiddelenvoorziening aan «de onderkant van de geneesmiddelenmarkt».
118.
Kunt u aangeven of er een actieplan voor een ijzeren voorraad voor essentiële hulpmiddelen in voorbereiding is? Zo ja, hoe ziet dit er op hoofdlijnen uit?
Het is primair de verantwoordelijkheid van de zorgaanbieder om over voldoende beschermingsmiddelen te beschikken. Omdat vanwege mondiale tekorten deze daar onvoldoende toe in staat bleken te zijn, is het Landelijk Consortium Hulpmiddelen (LCH) tijdelijk opgericht om aanvullende voorraden in te kopen zodat de zorg daar tijdens de coronapandemie op terug kan vallen. Voor de langere termijn – dus ook voor andere mogelijke crises – wordt gewerkt aan een structurele oplossing om in dat soort situaties over voldoende voorraad te kunnen beschikken: de ijzeren voorraad. Daarvoor werk ik momenteel de kaders uit. Ik zal uw Kamer daar te zijner tijd over informeren.
119.
Op dit moment wordt door de Europese Commissie – mede op aandringen van Nederland – onderzoek gedaan naar de afhankelijkheden van Europa en de oorzaken van (toenemende) geneesmiddelentekorten. Wanneer zijn de resultaten hiervan bekend?
Zie antwoord vraag 65 t/m 69.
120.
U schrijft dat model 1 uit het rapport (verwerking van kosten van de voorraad in de AIP) nader zal worden uitgewerkt. Als bij de uitvoering van het voorgestelde model 1 mitigerende maatregelen worden genomen, wordt er dan op gelet dat het uitvoerbaar blijft? Zo ja, hoe?
In de vraag wordt verwezen naar mitigerende maatregelen; het is mij niet direct bekend wat hiermee wordt bedoeld. Het nader uitwerken van model 1 doe ik in samenwerking met veldpartijen. Uitvoerbaarheid is een belangrijke randvoorwaarde.
121.
Welke factoren worden betrokken bij het zoeken naar een structurele aanpak? Hoe worden kwetsbare patiëntengroepen beschermd?
Dit wordt op dit moment uitgewerkt.
122.
Zijn er voor de realisatie van productie in de EU van zowel eindproducten als productie van actieve stoffen (en hulpstoffen) van geneesmiddelen al concrete stappen gezet? Welke voorstellen zijn er door Nederland in de EU gedaan?
Hierover ben ik momenteel op Europees niveau in gesprek met de Europese Commissie en andere EU landen om meer inzicht te krijgen in de productielijnen, mondiale waardeketens en de opties om kwetsbaarheden te verminderen. Immers om tot stappen te komen, is het eerst nodig diepgaande inzicht te krijgen in relevante data zoals: welke stoffen zijn strategisch van belang, voor welke eindproducten zijn ze nodig en in welke fabrieken worden ze geproduceerd.
Voor actieve stoffen verkennen we bijvoorbeeld op EU niveau het bundelen van de krachten door mogelijk het opzetten van een vrijwillige industriële samenwerkingsvorm of alliantie met EU overheden, fabrikanten en andere relevante stakeholders.
123.
Welke capaciteit voor de productie van eindproducten alsook benodigde grondstoffen of halffabrikaten is thans aanwezig in Nederland en Europa?
Er bestaat een overzicht van het aantal fabrikanten die een vergunning hebben om in Europa te produceren, maar er bestaat geen overzichten van de volumes in Europa of Nederland. Uit de EudraGMDP-database1819 van de Europese Commissie blijkt bijvoorbeeld dat er meer dan 10.000 good manufactoring practice (GMP) certificaathouders – bedrijven die een van de stappen in het productieproces mag uitvoeren – zijn in de EEA. De Europese Commissie wil nu proberen voor actieve bestanddelen de productiecapaciteit in beeld te brengen, maar dit beeld kan door marktomstandigheden veranderen.
124.
Wat is wenselijk en wat is mogelijk en denkbaar als het gaat om het tijdsbestek waarin de productie van een bepaald middel kan worden opgeschaald in tijden van crisis?
Dit hangt af van het betreffende middel en de verwachte behoefte van de patiënt en kan in elke crisissituatie anders zijn. In beginsel is dit ook een zaak van private partijen, maar in coronatijd heeft de overheid als facilitator tussen partijen opgetreden om daar waar nodig productie of bereidingen te laten opschalen. Onder andere tijdige informatie-uitwisseling over verwachte problemen is hierbij een belangrijk element.
125.
Is de capaciteit voor productie van beschermingsmiddelen toereikeind voor het toestaan van preventief gebruik van deze middelen? Zo ja, in welke sectoren en hoeveel kan er geproduceerd worden? Zo nee, wat moet er nog gebeuren om dit mogelijk te maken?
Zoals ik u eerder heb bericht, heb ik laten analyseren wat het effect is op de vraag en aanbod van persoonlijke beschermingsmiddelen onder verschillende scenario’s, zoals ook meer preventief gebruik in verpleeghuizen of andere sectoren in de zorg. Uit de analyse blijkt dat er voldoende voorraad beschikbaar is – zowel bij zorginstellingen zelf als achter de hand bij het LCH – voor een tweede piek aan verbruik, ook als beschermingsmiddelen maximaal preventief worden ingezet. Ik heb uw Kamer op 12 oktober geïnformeerd (Kamerstuk 25 295).
Er lopen inmiddels verschillende initiatieven voor eigen productie van beschermingsmiddelen in Nederland. De productiecapaciteit van mondmaskers kan ook nog verder opgeschaald worden. Het streven is dat deze initiatieven er toe leiden dat – als alle productie op stoom is – onze afhankelijkheid daarmee aanzienlijk wordt verminderd. Omdat de wereldmarkt op het gebied van beschermingsmiddelen grillig blijft, is niet vooraf te zeggen welk aandeel
Nederlandse productie in de totale vraag zal zijn.
126.
Wat is de wenselijke grootte voor een ijzeren voorraad van beschermingsmiddelen en geneesmiddelen, rekening houdend met een eventuele nieuwe golf? Welke partijen zijn verantwoordelijk voor deze voorraad en wat betekent het voor de kosten?
Het is primair de verantwoordelijkheid van de zorgaanbieder om over voldoende beschermingsmiddelen te beschikken. Omdat vanwege mondiale tekorten deze daar onvoldoende toe in staat bleken te zijn, is het Landelijk Consortium Hulpmiddelen (LCH) tijdelijk opgericht om aanvullende voorraden in te kopen zodat de zorg daar tijdens de coronapandemie op terug kan vallen. Voor de langere termijn – dus ook voor andere mogelijke crises – wordt gewerkt aan een structurele oplossing om in dat soort situaties over voldoende voorraad te kunnen beschikken: de ijzeren voorraad. Daarvoor werk ik momenteel de kaders uit. Ik zal uw Kamer daar te zijner tijd over informeren. Voor geneesmiddelen verwijs ik u naar het antwoord op vraag 84.
127.
Is de wettelijke verplichting van leveranciers (fabrikanten en groothandels) tot levering nog wel relevant als fabrikanten besluiten om Nederland niet langer als afzetmarkt te kiezen wanneer fabrikanten de kosten van de ijzeren voorraden niet willen dragen? En welke impact heeft dat op de mogelijkheden van apothekers om patiënten in het geval van een tekort toch van geneesmiddelen te kunnen voorzien?
Ook ik vind het belangrijk dat Nederland een aantrekkelijke afzetmarkt is en blijft voor aanbieders van geneesmiddelen. Zo voorkomen we een verschraling van het aanbod. Of Nederland een aantrekkelijke afzetmarkt is, wordt niet alleen bepaald door de invulling van de ijzeren voorraad. Zoals beschreven in het antwoord op vraag 114 heb ik structurele aandacht voor de geneesmiddelenvoorziening aan «de onderkant van de geneesmiddelenmarkt»
128.
U schrijft dat de administratieve en regelgevende procedures moeten worden vereenvoudigd. Gaat regelgeving voor gentherapie hierbij ook worden aangepast?
Voor zover u de verbeteringen rondom de milieuvergunningsprocedures voor ggo’s bedoelt, verwijs ik u naar de laatste stand van zaken brief van 1 juli jl.19
129.
U schrijft dat bij het zoeken naar een structurele aanpak alle relevante factoren worden betrokken. Welke factoren worden hierbij betrokken? Hoe worden kwetsbare patiëntengroepen beschermd?
Zie antwoord vraag 114 en 121.
130.
U schrijft dat we het voor de lange termijn weer aantrekkelijker moeten maken om in de EU te produceren. Daarnaast schrijft u dat het hierbij gaat om zowel de productie van eindproducten als om de mogelijkheid van de productie van de actieve stoffen (en hulpstoffen) van geneesmiddelen. Zijn er voor de realisatie al concrete stappen gezet? Welke voorstellen zijn er door Nederland in de EU gedaan?
Zie antwoord vraag 124.
Daarnaast zet ik me in – waar mogelijk- voor behoud en of versterking van productie van geneesmiddelen.
Uw Kamer heeft op 6 augustus 2020 een brief ontvangen over het voornemen tot het verstrekken van een lening ten behoeve van de doorstart van Apotex20 van de Staatssecretaris van EZK en de Minister voor Medische Zorg en Sport. Om sluiting van de grootste productielocatie van generieke geneesmiddelen te voorkomen is er een voornemen tot het verstrekken van een lening onder voorwaarden. Onderdeel van die voorwaarden zijn ook waarborgen die bijdragen aan de leveringszekerheid van generieke geneesmiddelen in Nederland en Europa.
131.
U schrijft dat nadat bekend is geworden dat de aanscherping van de Wgp-maximumprijzen doorgang zou vinden, er (onder andere) door een Nederlandse groothandel is aangegeven dat hij zijn voorraden voor de Nederlandse markt zal gaan afbouwen. Is de wettelijke verplichting van leveranciers (fabrikanten en groothandels) tot levering nog wel relevant als fabrikanten besluiten om Nederland niet langer als afzetmarkt te kiezen wanneer fabrikanten de kosten van de ijzeren voorraden niet willen dragen? En welke impact heeft dat op de mogelijkheden van apothekers om patiënten in het geval van een tekort toch van geneesmiddelen te kunnen voorzien?
Zie antwoord vraag 127.
132.
Voor welke medicijnen wordt de ijzeren voorraad aangelegd? Alle medicijnen? Of specifieke medicijnen?
Zie antwoord vraag 20.
133.
In hoeverre zullen veldpartijen betrokken worden bij de verdere uitwerking van het Apotheek Inkoop Prijs-model?
Veldpartijen zijn betrokken bij de verdere uitwerking.
134.
Kunt u aangeven in hoeverre veldpartijen positief staan tegenover het sluiten van een «gedragscode» in de vorm van een convenant?
Sommige veldpartijen hebben aangegeven meerwaarde te zien in een gedragscode. Waar het lukt om bepaalde afspraken in goede samenwerking vast te leggen, sta ik daarvoor open.
135.
Kunt u aangeven of u voornemens bent om, in navolging van de aanbeveling van Gupta, een pilot te starten ten behoeve van de uitrol van het Apotheek Inkoop Prijs-model?
Door de gefaseerde aanpak kunnen we op een lerende wijze de verschillende vraagstukken adresseren, onder andere ten aanzien van financiering. Pilots kunnen daarbij een erg nuttige rol vervullen omdat hiermee praktijkervaring opgedaan wordt.
136.
Waarom is er gekozen voor een ijzeren voorraad van vijf maanden waarvan drie maanden bij de firma’s en twee maanden bij de groothandel? Waarom niet bijvoorbeeld vier maanden bij de groothandel en een maand bij de firma?
Zie antwoord vraag 96.
137.
Kunt u toelichten hoe de door VWS meegegeven uitgangspunten tot stand zijn gekomen?
De uitgangspunten zijn destijds door VWS opgesteld nadat er input vanuit de veldpartijen was ontvangen. De voorkeur ging uit naar een werkwijze die redelijk snel ingezet kon worden en die zo min mogelijk (negatieve) neveneffecten zou opleveren. Immers, hoe meer er buiten het huidige systeem wordt gedacht, hoe groter de kans dat er op allerlei punten ongewenste effecten optreden of extra administratieve lasten ontstaan.
138.
Kunt u toelichten wat er wordt verstaan onder «de juiste financiële prikkels op de juiste plaats leggen»?
Dit houdt in dat de financiële middelen voor de ijzeren voorraad terecht komt bij de partijen die daadwerkelijk de kosten dragen om de betreffende voorraden structureel aan te houden.
139.
Kunt u toelichten waarom de ijzeren voorraden de marktmechanismen niet mogen verstoren?
Zie antwoord vraag 137.
140.
Kunt u toelichten waarom er alleen is onderzocht hoe de ijzeren voorraad vormgegeven kan worden binnen bestaande wet- en regelgeving?
Het wijzigen van wet- en regelgeving is een langdurig traject met veel onzekerheden. Ook is er minder flexibiliteit om op basis van ervaringen in de praktijk nuances aan te brengen. De voorkeur ging onder andere daarom uit naar mogelijkheden binnen het huidige systeem.
141.
Kunt u toelichten waarom er in alle vier de modellen voor gekozen is de financiering van de ijzeren voorraad deels via de verzekeraars te laten lopen?
Verzekeraars financieren (binnen de Zvw) reeds de kosten van geneesmiddelen en hebben reeds een bestaande relatie met de betreffende partijen. Zowel bij zorgverzekeraars als veldpartijen was de voorkeur een systeem te kiezen dat zoveel mogelijk aansluit bij de huidige werkwijze.
142.
Waarom is het vergoeden van veldpartijen door middel van overheidssubsidies geen serieuze optie?
De overheidssubsidie bleek erg lastig uitvoerbaar. Dit heeft onder andere te maken met de grondslag voor deze (staats)steun en de controle op de nakoming van de afspraken. Omdat het gaat om een geldstroom buiten de huidige werkwijze en relaties, zorgt het ook voor aanvullende administratieve lasten. Ook was er weinig draagvlak voor deze optie.
143.
Kunt u uitleggen waarom er in alle modellen voor gekozen is om leveranciers en groothandels te belonen voor het aanhouden van de ijzeren voorraden, maar niet te straffen als deze niet aangehouden worden?
Bij het niet voldoen aan de verplichtingen rondom verplichte voorraden, kan de IGJ passende maatregelen nemen. Bijvoorbeeld door het inzetten van boetes.
144.
Kunt u aangeven hoe bij het Apotheek Inkoop Prijs-model, waarbij leveranciers hun lijstprijzen verhogen, waar mogelijk binnen de grenzen van de Wgp, en waarmee er geen controle/inzicht is in het bedrag dat specifiek bedoeld is voor ijzeren voorraden, voorkomen kan worden dat er misbruik wordt gemaakt van deze vorm van financiering?
Dit is een punt van aandacht bij de nadere uitwerking van de financiering. Voor de goede orde, op dit moment is «de ruimte» om de prijs te verhogen bij die geneesmiddelen er ook al (en blijkbaar zijn er dus prijsdrukkende effecten die de prijs lager houden).
145.
Kunt u aangeven hoe verzekeraars tegen het Apotheek Inkoop Prijs- model aankijken, aangezien zij vergoeden op basis van deze verhoogde AIP?
In de werkgroep geneesmiddelentekorten hebben zorgverzekeraars ook hun voorkeur uitgesproken om te kiezen voor een model dat zoveel mogelijk past binnen de huidige werkwijze. Dit model kwam daar het meeste in de buurt. Wel zijn er nog uitvoeringsvraagstukken.
146.
Kunt u toelichten hoe er in de implementatie van model 1 (AIP) op toegezien wordt dat de verhogingen van de lijstprijzen van leveranciers binnen redelijke grenzen zullen blijven?
Hier is aandacht voor in de nadere uitwerking.
147.
Bij welke medicijnen is het mogelijk om binnen de grenzen van de Wgp de lijstprijs te verhogen?
Zie antwoord vraag 115.
148.
Waarom bevatten de verhoogde lijstprijzen geen geoormerkte bedragen voor de compensatie van de ijzeren voorraden?
De Wgp maximeert de apotheek inkoopprijs (vaak aangeduid als de «lijstprijs»). De Wgp stelt geen voorwaarden aan de opbouw van deze prijs.
149.
Hoe wordt er gecontroleerd dat de verhoogde lijstprijzen goed verdeeld worden onder de groothandel, leverancier en apotheek? Zouden deze organisaties zichzelf ongemerkt meer geld kunnen toebedelen?
Ik vind het belangrijk dat de veldpartijen hier onderling goede afspraken over maken. Dit is een expliciet aandachtspunt bij de uitwerking van de financiering.
150.
Hoe groot is het deel van de AIP dat groothandels zullen achterhouden als vergoeding voor hun deel van de voorraaddienst?
Dit moet onderdeel zijn van de afspraak zoals bedoeld in het antwoord op vraag 149.
151.
Zou de Trusted Third Party (TTP) eventueel ook door VWS aangesteld kunnen worden?
Dat is een mogelijke optie, maar hier kan ik nog niet op vooruit lopen.
152.
Kunt u aangeven welk model (1, 2a, 2b, 3) bij de apothekers de voorkeur geniet? Kunt u dit tevens aangeven voor de verzekeraars, farmaceuten en overige betrokken veldpartijen?
Ik wil voorop stellen dat uit de consultatie van partijen is gebleken dat alle modellen voor- en nadelen hebben. Ook Gupta heeft dit geconcludeerd in het rapport. De verzekeraars, apothekers en een deel van de farmaceuten hebben een voorkeur uitgesproken voor model 1. Een deel van de farmaceuten en groothandels heeft geen voorkeur uitgesproken omdat zij aangaven dat alle onderzochte modellen teveel nadelen hebben.
153.
Kunt u toelichten waarom er in model 1 (AIP) voor gekozen is om de geneesmiddelenprijs compleet los te koppelen van de leveringszekerheid en de uitkomsten van de monitoring?
Hier is niet voor gekozen in model 1, het onderzoeksbureau heeft dit beschreven als mogelijk nadeel van het betreffende model. Bij de nadere uitwerking van dit model bekijken we hoe deze financiering beter te koppelen is aan leveringszekerheid.
154.
Kunt u toelichten waarom er in alle vier de modellen voor gekozen is om iedere partij te laten starten op status A in het monitoringsmechanisme?
Het onderzoeksbureau heeft in het rapport bij ieder model kort aangegeven of het betreffende model gecombineerd zou kunnen worden met een monitoringssysteem. Zij hebben geen uitvoerig onderzoek gedaan naar de wijze waarop de monitoring ingericht zou moeten worden. Ter illustratie is in het rapport gekozen voor een monitoringssysteem dat start op basis van goed vertrouwen. Dit betekent dat iedere leverancier en groothandel, tenzij aangetoond is dat dit niet het geval is, start op status A.
155.
Kunt u toelichten hoeveel u verwacht dat het eigen risico zal stijgen als gevolg van het implementeren van model 2a?
Het is niet mogelijk om hier een uitspraak over te doen. Model 2a wordt ook niet verder uitgewerkt.
156.
In het rapport wordt gesteld dat veel veldpartijen problemen benoemen bij het AIP-model. Kunt u aangeven hoe het besluit tot stand is gekomen om dit model verder uit te werken? Kunt u aangeven hoe gewaarborgd wordt dat bezwaren van veldpartijen bij de uitwerking zoveel mogelijk weggenomen worden?
Zie antwoord vraag 27. In de gefaseerde aanpak hebben we samen met veldpartijen aandacht voor de zorgen en nadelen verbonden aan dit model.
Onderzoeksrapport «Onderzoek naar de gevolgen van het vergroten van de voorraden van geneesmiddelen» september 2019.
Kopieer de link naar uw clipboard
https://zoek.officielebekendmakingen.nl/kst-29477-682.html
De hier aangeboden pdf-bestanden van het Staatsblad, Staatscourant, Tractatenblad, provinciaal blad, gemeenteblad, waterschapsblad en blad gemeenschappelijke regeling vormen de formele bekendmakingen in de zin van de Bekendmakingswet en de Rijkswet goedkeuring en bekendmaking verdragen voor zover ze na 1 juli 2009 zijn uitgegeven. Voor pdf-publicaties van vóór deze datum geldt dat alleen de in papieren vorm uitgegeven bladen formele status hebben; de hier aangeboden elektronische versies daarvan worden bij wijze van service aangeboden.
