Staatscourant van het Koninkrijk der Nederlanden
| Datum publicatie | Organisatie | Jaargang en nummer | Rubriek |
|---|---|---|---|
| Ministerie van Volksgezondheid, Welzijn en Sport | Staatscourant 1996, 46 pagina 10 | Besluiten van algemene strekking |
Zoals vergunningen, bouwplannen en lokale regelgeving.
Adressen en contactpersonen van overheidsorganisaties.
U bent hier:

| Datum publicatie | Organisatie | Jaargang en nummer | Rubriek |
|---|---|---|---|
| Ministerie van Volksgezondheid, Welzijn en Sport | Staatscourant 1996, 46 pagina 10 | Besluiten van algemene strekking |
23 februari 1996
nr. VMP/VA-96550
De minister van Volksgezondheid, Welzijn en Sport,
Gelet op artikel 9 van het Verstrekkingenbesluit ziekenfondsverzekering;
Gezien het advies van de Ziekenfondsraad (advies van 28 september 1995, SGZ/39812/95);
Besluit:
De Regeling farmaceutische hulp 1996 wordt gewijzigd als volgt:
A. Bijlage 1 wordt gewijzigd als volgt:
1. In onderdeel A worden de volgende regels geschrapt:
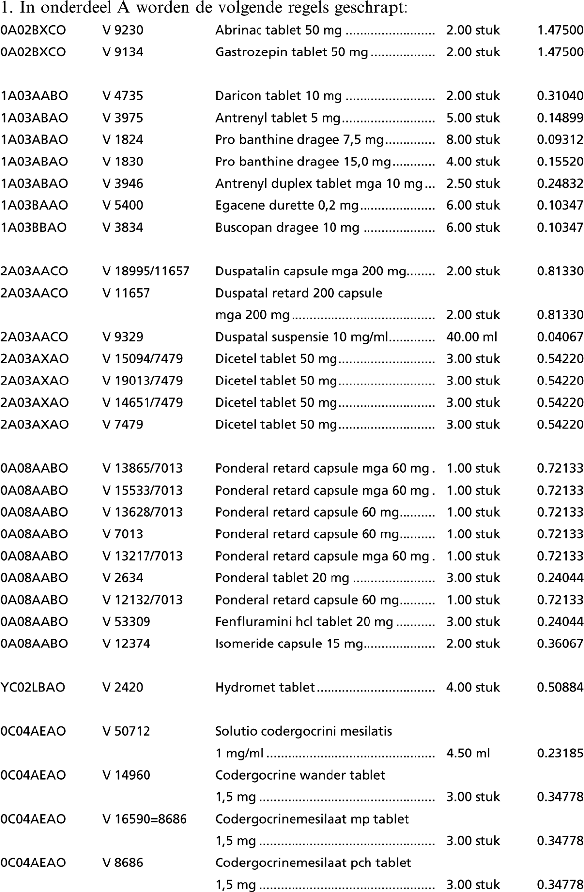
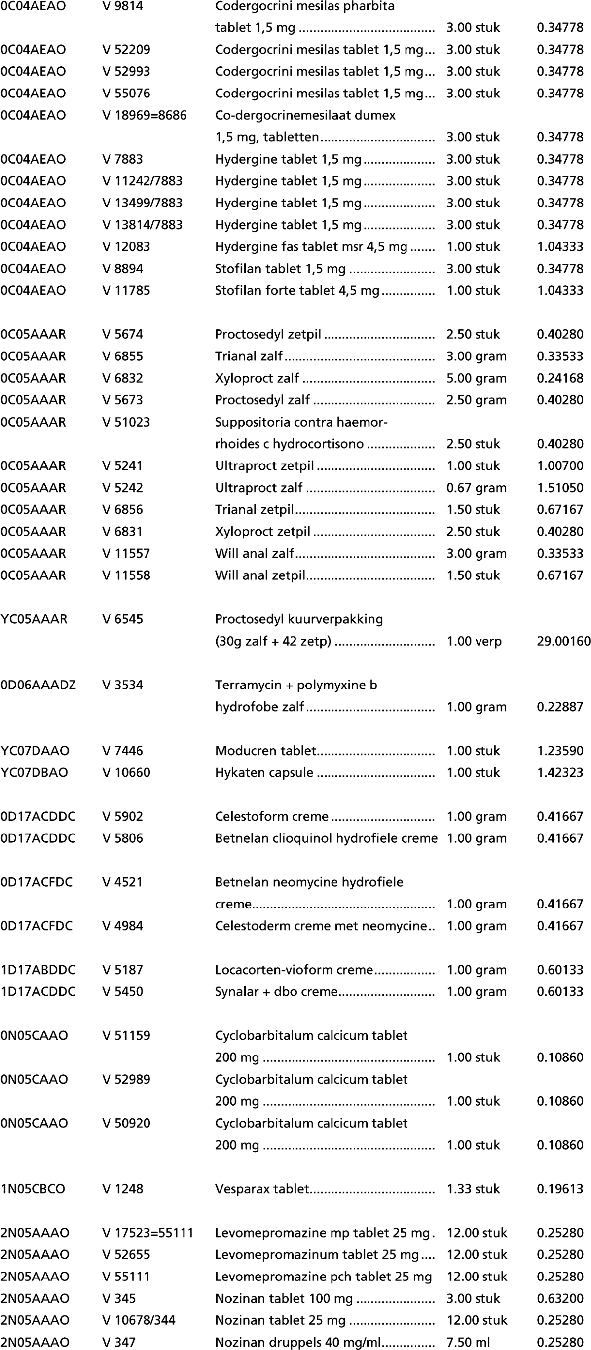
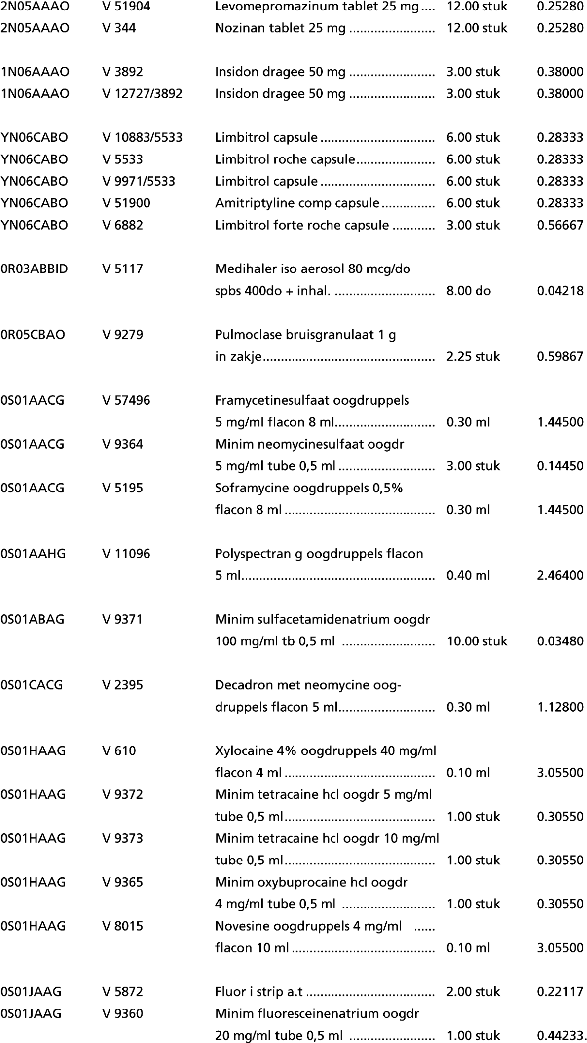
2. In onderdeel B worden de volgende regels geschrapt:



B. Onderdeel 15 van bijlage 2 komt te luiden als volgt:
15. Acetylcysteïne
Voorwaarden:
uitsluitend voor een verzekerde met chronisch obstructief longlijden, die wordt behandeld overeenkomstig de richtlijnen die voor Nederland door de desbetreffende beroepsbeoefenaren zijn aanvaard, mits het ziekenfonds vooraf toestemming heeft verleend.
Deze regeling treedt in werking met ingang van 1 april 1996, met uitzondering van artikel I, onderdeel B, dat in werking treedt met ingang van 1 mei 1996.
De regeling zal met de toelichting in de Staatscourant worden geplaatst.
Geneesmiddelen die met ingang van 1 april 1996 uit het ziekenfonds- en standaardpakket zijn verwijderd.





Met de aanvaarding van de motie Laning-Boersema (Kamerstukken II 1992/93, 22 393, nr. 37), waarin de regering is verzocht het geneesmiddelenpakket te onderwerpen aan de toetsingssystematiek zoals voorgesteld in het rapport ’Kiezen en Delen’, heeft de Tweede Kamer der Staten-Generaal duidelijk gemaakt van belang te achten dat het geneesmiddelenpakket kritisch wordt bezien. Ter uitvoering van die motie zijn op het terrein van de geneesmiddelenvoorziening inmiddels de volgende stappen gezet. Per 1 juli 1993 zijn de homeopatische
farmaceutische produkten van het aansprakenpakket uitgesloten. Vervolgens zijn op 1 januari 1994 de zogenaamde zelfzorgmiddelen grotendeels uit het pakket verwijderd.
Verder is op 30 augustus 1993 de Commissie criteria geneesmiddelenkeuze ingesteld (CCG). Deze commissie heeft als de opdracht gekregen te adviseren over de ontwikkeling van criteria waarmee het geneesmiddelenpakket kan worden onderworpen aan de toetsingssystematiek zoals voorgesteld in het rapport ’Kiezen en Delen’.
De CCG heeft op 29 april 1994 haar rapport ’Verdeling door verdunning’ uitgebracht.
Omdat ik met de Tweede Kamer van oordeel ben dat een kritische beschouwing van het verstrekkingenpakket, en derhalve ook van het geneesmiddelen-pakket, van groot belang is, heb ik op 18 mei 1995 aan de Ziekenfondsraad advies gevraagd over een eerste toetsing van het geneesmiddelenpakket aan de hand van het rapport van de CCG. Daarbij heb ik aan de Ziekenfondsraad voorgesteld een aantal geneesmiddelen uit het aansprakenpakket te verwijderen. Het gaat om middelen ten aanzien waarvan op een relatief eenvoudige wijze kan worden vastgesteld dat zij niet tot de essentiële zorg gerekend kunnen worden. Voorts heb ik de Raad ten aanzien van een aantal middelen mijn opvatting voorgelegd dat daarop slechts onder voorwaarden aanspraak zou moeten bestaan, mits daarvoor tot een uitvoerbare en zo min mogelijk belastende regeling gekomen zou kunnen worden. Ik dacht daarbij met name aan koppeling van de aanspraak aan een omschreven indicatiegebied en een voorafgaande toestemming door het ziekenfonds.
Toen ik advies vroeg aan de Ziekenfondsraad maakten de geneesmiddelen nog onderdeel uit van het verzekeringspakket ingevolge de Algemene Wet Bijzondere Ziektekosten. Ter uitvoering van het regeerakkoord was echter inmiddels besloten de aanspraak op farmaceutische hulp over te hevelen naar het ziekenfondspakket en het vergoedingenpakket ingevolge de Wet op de toegang tot ziektekostenverzekering (het standaardpakket). Het was de bedoeling de opschoning van het geneesmiddelenpakket bij de overheveling te laten plaatsvinden. Omdat de opschoning dus onder meer betrekking zou hebben op het standaardpakket en op dat moment op grond van de Wet op de toegang tot ziektekostenverzeke-ringen nog de verplichting bestond om Zorgverzekeraars Nederland te horen, is op 18 mei 1995 ook het oordeel van Zorgverzekeraars Nederland gevraagd. Met de Wet van 10 juli 1995 (Stb. 355) is deze verplichting komen te vervallen. Bovendien is bij de overheveling per 1 januari 1996 de aanspraak op de vergoeding van farmaceutische hulp in het kader van het standaardpakket gekoppeld aan de regeling daarvan in het kader van de ziekenfondsverzekering. Hiervoor is om pragmatische redenen gekozen, onder meer vanwege de maandelijkse wijzigingen die nodig zijn om het geneesmiddelenvergoedings-
systeem uit te voeren. Een wijziging in de aanspraak op farmaceutische hulp ingevolge de Ziekenfondswet betekent dus automatisch dezelfde beperking in de aanspraak op vergoeding ingevolge de Wet op de toegang tot ziektekostenverzekeringen.
De Ziekenfondsraad heeft op 28 september 1995, SGZ/39812/95 (uitgave Ziekenfondsraad 1995, 680.) en Zorgverzekeraars Nederland hebben op 4 oktober 1995, CB/95174/Rz, advies uitgebracht.
Op 7 december 1995 heb ik de Eerste en Tweede Kamer der Staten-Generaal van mijn standpunt op de hoogte gesteld (Kamerstukken II 1995/96, 24 124, nr. 25)).
De Ziekenfondsraad heeft ter beantwoording van de adviesaanvrage aan de hand van alle tot nu toe ontwikkelde criteria voor de samenstelling van het geneesmiddelenpakket een toetsingsmodel ontwikkeld voor de extramuraal toe te passen geneesmiddelen. Het beslismodel van de Ziekenfondsraad betreft zes criteria voor de beoordeling van de ’instroom’ en ’uitstroom’ van geneesmiddelen in het pakket, te weten: noodzakelijk te verzekeren zorg, werkzaamheid, effectiviteit, therapeutische waarde, doelmatigheid en eigen rekening en verantwoording. Steeds wordt apart nagegaan of uitsluiting als gevolg van de toepassing van het desbetreffende criterium leidt tot ongewenste substitutie. Het criterium ongewenste substitutie is destijds ook gehanteerd bij de beperking van de zogenaamde zelfzorgmiddelen.
Zoals ik beide Kamers der Staten-Generaal heb kenbaar gemaakt, wordt de door de Ziekenfondsraad gekozen werkwijze door mij onderschreven. Ook de uitwerking van de criteria ten behoeve van het geneesmiddelenpakket onderschrijf ik. Door de criteria zoals die door de diverse adviescommissies zijn uitgewerkt, bijeen te brengen, heeft de Ziekenfondsraad de criteria in de praktijk hanteerbaar en toepasbaar gemaakt en gekozen voor een werkwijze die ook bij de toetsing van andere verstrekkingen gebruikt is. Echter, het model is aangepast aan de specifieke eisen die de toetsing van het geneesmiddelenpakket met zich brengt.
Zorgverzekeraars Nederland hebben eveneens instemmend op het model gereageerd en geven daaraan hun steun. Omdat het advies van Zorgverzekeraars Nederland in hoofdlijnen overeenkomt met dat van de Ziekenfondsraad, wordt het advies van Zorgverzekeraars Nederland in het navolgende niet steeds apart genoemd.
In mijn standpunt van 7 december 1995 heb ik aangegeven met ingang van 1 februari 1996 op basis van de criteria van het beslismodel van de Ziekenfondsraad geneesmiddelen uit het ziekenfonds- en dus ook het standaard-pakket te zullen verwijderen. Voorts heb ik in die brief aangegeven de aanspraak op acetylcysteïne aan voorwaarden te zullen verbinden. Omdat nadien bleek dat overleg met de Tweede Kamer over de onderhavige aangelegenheid eerst op 8 februari 1996 zou plaatsvinden, heb ik besloten de maatregel uit te stellen en per 1 april 1996 in te voeren. De Tweede Kamer heeft tijdens het Algemeen Overleg van 8 februari 1996 blijk gegeven volledig accoord te gaan met mijn voornemens ten aanzien van het geneesmiddelen-pakket. De onderhavige regeling strekt tot uitvoering van deze voornemens.
Bij deze eerste toetsing van het geneesmiddelenpakket aan het beslismodel zijn uitsluitend de eerste vier criteria toegepast. Hierna wordt eerst ingegaan op de vier criteria zelf. Vervolgens wordt melding gemaakt van de uitkomst van de toetsing.
Met betrekking tot het eerste criterium ’noodzakelijk te verzekeren zorg’ gaat de CCG, in navolging van het rapport ’Kiezen en Delen’, uit van een gemeenschapsgerichte benadering. De gemeenschap bepaalt welke zorg in het pakket wordt opgenomen om deelname van het individu aan de samenleving te waarborgen of te bevorderen. Met de Ziekenfondsraad ben ik van mening dat daarbij geen rekening wordt gehouden met individuele belangen. Waar het mij om gaat, is of de aandoening dusdanig is dat om medische gronden de hulp van een arts moet worden ingeroepen. Bijvoorbeeld, bij spierpijn na sportbe-oefening of bij sportmassage, is er geen sprake van een ziekte en is er dus geen medische noodzaak. Ook voor zelfzorgmiddelen ontbreekt de noodzaak om een arts in te schakelen.
Noodzakelijk te verzekeren zorg houdt dus in dat er sprake is (of in de toekomst sprake kan zijn) van een (mogelijke) verstoring van de gezondheid waarbij voor het tijdig afwenden dan wel gunstig beïnvloeden van het verloop van het ziekteproces voor de diagnostiek en behandeling medische deskundigheid is vereist.
Het tweede criterium betreft de ’werkzaamheid’. De Ziekenfondsraad volgt de definitie van de Gezondheidsraad in zijn rapport ’Medisch handelen op een tweesprong’ (1991). Onder werkzaamheid wordt daar verstaan: het resultaat van een verrichting onder optimale omstandigheden, bij bepaalde groepen patiënten, door ervaren en deskundige onderzoekers en met uitstekende faciliteiten. Toegespitst op geneesmiddelen, concludeer ik met de Ziekenfondsraad dat een geneesmiddel werkzaam is als de farmacologische werking bij toepassing in klinisch onderzoek resulteert in een therapeutisch effect.
De beoordeling van de werkzaamheid geschiedt in Nederland door het College ter beoordeling van geneesmiddelen. In plaats daarvan kan het ook gaan om een beoordeling in het kader van het Europese vergunningenstelsel. De werkzaamheid wordt getoetst bij de door de aanvrager aangegeven indicatie. Er is dus alleen sprake van getoetste werkzaamheid bij de geregistreerde indicatie. Werkzaamheid bij een andere dan de geregistreerde indicatie moet opnieuw worden vastgesteld op basis van onafhankelijke, wetenschappelijke beoordeling van nieuwe onderzoeksgegevens.
Voor de beoordeling van de werkzaamheid dienen resultaten te worden overgelegd van klinische studies die zijn uitgevoerd in fase 2 en 3 van het geneesmiddelenonderzoek. Er is derhalve sprake van uitvoering van een onderzoek onder optimale omstandigheden. Met andere woorden: de werkzaamheid van een geneesmiddel kan bij een bepaalde indicatie dan wel zijn aangetoond, doch dit zegt nog niets over de vraag of met het geneesmiddel het beoogde doel wordt bereikt. Daarvoor is een aanvullende beoordeling nodig. De Ziekenfondsraad en de CCG hanteren hiervoor het criterium ’de effectiviteit’.
Indien een middel op de markt mag verschijnen op grond van een positieve balans werkzaamheid/schadelijkheid, kan het middel breed worden toegepast. Omdat de omstandigheden dan verschillen van de optimale situatie waarvan sprake was ten tijde van het fase 2 en 3 onderzoek, kunnen de resultaten anders uitvallen. Patiënten die aanvankelijk waren uitgesloten van de klinische studies, kunnen dan wel met het geneesmiddel behandeld worden, zoals bijvoorbeeld mensen met comorbiditeit, andere leeftijdsgroepen en mensen in een ander ziektestadium. Ook wordt dan pas duidelijkheid verkregen over de gevolgen op de langere termijn in de zin van vermindering van morbiditeit en mortaliteit, het uiteindelijke doel van de behandeling. De effectiviteit ligt in het verlengde van de werkzaamheid. Een werkzaam middel is effectief indien uit onderzoek blijkt dat de toepassing in de praktijk resulteert in het beoogde doel van de behandeling. De effectiviteit kan dus pas vastgesteld worden in de praktijk van alledag, wanneer een bredere groep gebruik heeft gemaakt van het middel.
Ten opzichte van de werkzaamheid gaat het dus om een bredere patiëntengroep alsmede het doel van de behandeling, te weten de beoogde gezondheidswinst.
Een voorbeeld moge dit verduidelijken, hoge bloeddruk is onder meer een risicofactor voor cerebro-vasculaire accidenten (CVA). Het behandeldoel is in dit geval het verminderen van morbiditeit en mortaliteit als gevolg van CVA. De bedoeling is dit te bereiken door de bloeddruk te verlagen met bloeddrukverlagende geneesmiddelen. Indien de bloeddruk wel verlaagd wordt, maar dit geen effect heeft op de morbiditeit of mortaliteit ten gevolge van CVA zijn de middelen wel werkzaam, maar niet effectief bij CVA.
De Ziekenfondsraad hanteert na het criterium ’effectiviteit’ het criterium ’therapeutische waarde’. De grote verdienste daarvan is dat dit criterium zowel in zijn benaming als in zijn uitwerking aansluit bij de medische praktijk. Het criterium betekent een apart beslismoment dat ligt tussen de effectiviteit en de doelmatigheid in. De effectiviteit wordt beoordeeld aan de hand van het uiteindelijke doel van het werkzame middel. Bij de doelmatigheid worden de gevolgen van het gebruik van een geneesmiddel afgezet tegen de kosten in vergelijking tot andere geneesmiddelen of andere behandelingen. Bij de therapeutische waarde gaat het om een vergelijking zonder dat gekeken wordt naar de kosten. De vergelijking betreft zaken als bijwerkingen, interacties, contra-indicaties en gebruikersgemak. De therapeutische waarde is dan ook de som van de waardering van alle voor de behandeling relevante eigenschappen van een geneesmiddel, die tezamen bepalend zijn voor de plaats van het middel binnen de therapie in vergelijking met andere beschikbare behandelingsmogelijkheden.
De criteria ’doelmatigheid’ en ’voor eigen rekening en verantwoordelijkheid’ zijn bij deze maatregel niet toegepast. Op een later moment zal het geneesmiddelenpakket aan de hand van deze criteria op de mogelijkheid tot verdere beperking worden getoetst.
Met de opschoning van het geneesmiddelenpakket, zoals met deze regeling is geschied, is slechts op de volgende punten het advies van de Ziekenfondsraad niet gevolgd.
In de eerste plaats ben ik toch overgegaan tot uitsluiting van mebeverine en pinaverium: middelen tegen prikkelbaar darmsyndroom.
De Ziekenfondsraad stelt dat de toepassing van de criteria leidt tot uitsluiting van mebeverine en pinaverium uit het pakket. Na zorgvuldige bestudering van de wetenschappelijke literatuur, concludeert de Raad dat de effectiviteit van deze middelen niet is aangetoond en dat toepassing van het beslismodel leidt tot uitsluiting van deze middelen uit het pakket. Omdat er geen goed medicamenteus alternatief voorhanden is en de klachten voor de betrokkene vaak belastend zijn, adviseert de Raad tot die uitsluiting toch niet over te gaan.
Zorgverzekeraars Nederland zijn dezelfde mening toegedaan en stellen voor de aanspraak te handhaven en eerst nader onderzoek te doen naar de werkzaamheid van deze middelen.
Ik deel beide meningen niet. Mijns inziens is nog steeds niet aangetoond dat het gaat om middelen die een therapeutische waarde hebben. Het enkel in het pakket handhaven van dergelijke middelen omdat de arts anders niets heeft om te kunnen voorschrijven, vind ik geen reden om van de uitkomst van de toepassing van het criterium af te wijken. Bij een consequente toepassing van de criteria is dus er maar één conclusie: mebeverine en pinaverium behoren van het pakket te worden uitgesloten.
De tweede afwijking betreft glucoamylase/invertase. Blijkens de advisering zouden zuigelingen en zeer jonge kinderen moeten kunnen beschikken over glucoamylase/invertase. Ik ben het daar op zich mee eens, maar omdat deze behandeling bij zuigelingen en zeer jonge kinderen slechts plaatsvindt als onderdeel van opname in een ziekenhuis, is er geen enkele aanleiding de aanspraak op glucoamylase/invertase in het extramurale geneesmiddelenpakket te handhaven.
De derde afwijking betreft acetylcysteïne.
Ik heb het advies van de Ziekenfondsraad overgenomen om het stellen van voorwaarden bij de aanspraak op bepaalde middelen achterwege te laten. Bij die voorwaarden gaat het om zaken als een indicatiegebied, een speciale voorschrijver en het vragen van toestemming vooraf aan het ziekenfonds. In het verleden zijn dergelijke voorwaarden gesteld om redenen als:
* gevaar voor oneigenlijk gebruik;
* verwachte hoge kosten;
* wenselijke behandeling in deskundige centra of door gespecialiseerde artsen in verband met de benodigde specialistische kennis;
* gecontroleerde implementatie van een bepaald nieuw geneesmiddel;
* de wenselijke uitsluiting van een middel voor een aandoening, waarvoor behandeling over het algemeen niet
als medisch noodzakelijk wordt beschouwd.
Samengevat gaat het er om dat er sprake moet zijn van een zodanig oneigenlijk gebruik, dan wel verwacht oneigenlijk gebruik, dat het uit oogpunt van kwaliteit en kosten noodzakelijk is om de aanspraak aan voorwaarden te verbinden.
Voor de meeste geneesmiddelen die ik in mijn adviesaanvrage had vermeld als zijnde middelen waarop de aanspraak onder voorwaarden gehandhaafd moet blijven, is het gevaar voor een dergelijk oneigenlijk gebruik er niet. Het toch invoeren van een of meer voorwaarden zou betekenen dat de uitvoeringskosten hoger zullen zijn dan de besparing die de maatregel zou opleveren. Zorgverzekeraars Nederland wijzen eveneens op de administratieve rompslomp en hogere uitvoeringskosten die dergelijke voorwaarden met zich brengen. Een uitzondering maak ik echter met betrekking tot acetylcysteïne.
De Ziekenfondsraad heeft in zijn advies aangegeven dat de mucolytica uit het pakket kunnen worden verwijderd, maar maakt daarbij een uitzondering voor acetylcysteïne omdat er aanwijzingen zijn dat gebruik van acetylcysteïne zinvol kan zijn bij patiënten met chronisch obstructief longlijden (COPD-patiënten). Naar de mening van de Raad is het van belang dat het gebruik acetylcysteïne ook bij die patiënten beperkt wordt via een vast te stellen behandelprotocol. Zorgverzekeraars Nederland achten de totstandkoming van een behandelprotocol eveneens dringend gewenst. De Raad is bereid om in overleg met het veld een behandelprotocol op te stellen ten einde langs die weg tot een beperking in het voorschrijven en tot een gepast gebruik te komen. Ik heb de Raad laten weten van dit aanbod gebruik te zullen maken.
Overeenkomstig het advies van de Raad is de aanspraak op mucolytica met deze regeling beperkt tot acetylcysteïne. Aan de aanspraak op mucolytica was door plaatsing van dit middel op bijlage 2 van de Regeling farmaceutische hulp 1996 (onderdeel 15) een indicatievereiste verbonden. Aan de aanspraak was niet de voorwaarde verbonden dat het ziekenfonds vooraf toestemming moest hebben verleend. In verband met de beperking van de aanspraak op mucolytica tot acetylcysteïne moest onderdeel 15 van voornoemde regeling in ieder geval worden gewijzigd. Omdat uit het advies van de Raad blijkt dat de mucolytica veel ruimer ten laste van de verzekering werden voorgeschreven en afgeleverd dan het in bijlage 3 van de Regeling farmaceutische hulp 1993 opgenomen en het in bijlage 2 van de Regeling farmaceutische hulp 1996 overgenomen indicatievereiste toestaat, heb ik besloten om behalve een indicatievereiste toch ook de eis van voorafgaande toestemming in te voeren. Om het veld de gelegenheid te geven zich op die voorafgaande toestemming voor te bereiden, heb ik besloten dit onderdeel van de regeling per 1 mei 1996 van kracht te laten worden. Ik ga er vanuit dat dan ook het desbetreffende behandelprotocol gereed zal zijn.
De geneesmiddelen die met ingang van 1 april 1996 met deze regeling uit het pakket zijn verwijderd, zijn hierna aangegeven. De verwijdering geschiedt op basis van de criteria zoals die hiervoor zijn beschreven. Per criterium is aangegeven welke middelen op basis van dat criterium van het pakket zijn uitgesloten. De aanduiding tussen haakjes correspondeert met de bijlage bij deze toelichting.
Per 1 april 1996 zijn van de aanspraak uitgesloten:
Op grond van het criterium niet noodzakelijk te verzekeren zorg:
* alle middelen tegen spierpijn na sportbeoefening en als hulpmiddel bij sportmassage (rubefacienta en andere wrijfmiddelen X.N);
* alle middelen tegen aambeien (middelen bij hemorroiden X.P);
* middelen tegen aften (overige mond- en keelmiddelen XI.A.20);
* middelen tegen acute diarree (antidiarroïca VI.D).
Op grond van het criterium niet aangetoonde effectiviteit:
* opipramol (Insidon): middel tegen ziekelijke angst en spanning (overige anxiolyctica I.C.20);
* chloormezanon (Trancopal) en mefenoxalon (Dorsiflex): middelen bij spierkrampen (III.B.10);
* orale preparaten met carbocisteïne of broomhexine, met uitzondering van acetylcysteïne: slijmoplossende middelen (mucolytica VII.A.20);
* huidmiddelen, combinaties van corticosteroïden met antimicrobiële middelen of antimycotica (dermatologica, combinatiepreparaten X.B.21);
* Dexatopic: huidmiddel (dermatologica, overige combinatiepreparaten met een corticosteroïd X.B.23);
* Terramycin: middel voor huidinfecties (antimicrobiële en antivirale middelen voor cutaan gebruik X.E);
* Zincfrin: oogmiddel (decongestiva en adstringentia XII.A);
* Terramycin, Nebacetin, Polyspectran G en B: combinatiemiddelen bij ooginfecties (XII.D);
* benzydamine (Tantum); pijnstillend middel (overige prostaglandinesynthetaseremmers XV.A.12);
* dexfenfluramine (Isomeride), fenfluramine (Ponderal, Fenfluramine Tabletten) en mazindol (Teronac): eetlustremmende middelen (XIX.D.10);
* preparaten met co-dergocrine: middelen bij dementie (niet-geclassificeerde preparaten XIX.K);
* Crataegutt: middel bij coronairinsufficiëntie (niet-geclassificeerde preparaten XIX.K).
Op grond van het criterium niet aangetoonde therapeutische waarde:
* chloralhydraat (Chloraldurat), cyclobarbital (Cyclobarbital calcium tabletten en Vesparax: slaapmiddelen (overige hypnotica I.A.20);
* meprobamaat (Meprobamaat tabletten): middel tegen ziekelijke angst en spanning (overige anxiolytica I.C.20);
* amitriptyline/chloordiazepoxide tabletten (Limbitrol): middel tegen depressie (antidepressiva combinatiepreparaten I.F);
* levodopa (Eldopal): Parkinsonmiddel (II.B);
* Hydromet, Hykaten en Moducren: middelen tegen hoge bloeddruk (antihypertensiva, combinatiepreparaten V.L.60);
* natrium-tetradecylsulfaat (Trombovar) en polidocanol (Aethoxysklerol): middelen tegen spataderen (variscleroserende middelen V.N);
* pirenzepine (Gastrozepin en Abrinac): middel tegen maagzweer of zweer in twaalfvingerige darm (parasympathicolytica VI.A.22);
* middelen tegen krampen van het maagdarmkanaal (spasmolityca VI.B.10);
* isoprenaline, dosis-aërosol (Medihaler-Iso): middel bij cara (sympathicomimeticum VII.B.10);
* ceriumnitraat/zilversulfadiazine creme (Flammacerium), nitrofural (Furacine), framycetine (Sofra-Tule), tromantadine (Viru-Merz): huidmiddelen (antimicrobiële en antivirale middelen voor cutaan gebruik X.E);
* oxybuprocaïne (Novesine): middel bij keel-, neus-, ooraandoening indien verdoving is vereist (overige middelen bij ooraandoeningen XI.C.40);
* oogpreparaten met framycetine, neomycine, sulfacetamide of sulfadicramide: middelen bij ooginfecties (XII.D);
* oogmiddelen, combinatiepreparaten van corticosteroïden met neomycine of framycetine: combinatiepreparaten met antibicrobiele middelen XII.E.20);
* overige oogmiddelen (XII.F);
* metamizol (Novalgin): pijnstillend middel (overige prostagandinesynthetaseremmers XV.A12);
* preparaten met levomepromaxine (Levomepromazine tabl., Nozinan): pijnstiller (overige opioïden XV.A.20);
* ApaCod: pijnstiller combinatiepreparaat (XV.A.30).
Verder wordt glucoamylase/invertase (VI.D) van de aanspraak uitgesloten, omdat dit middel niet extramuraal wordt toegepast.
Tot slot zij opgemerkt dat voldaan is aan artikel 11k, achtste lid, van het Verstrekkingenbesluit ziekenfondsverzekering. De registratiehouders zijn uiterlijk een maand voor de inwerkingtreding van deze regeling van de zakelijke inhoud van de wijzigingen op de hoogte gesteld.
De Minister van Volksgezondheid, Welzijn en Sport,
E. Borst-Eilers.
Kopieer de link naar uw clipboard
https://zoek.officielebekendmakingen.nl/stcrt-1996-46-p10-SC5369.html
De hier aangeboden pdf-bestanden van het Staatsblad, Staatscourant, Tractatenblad, provinciaal blad, gemeenteblad, waterschapsblad en blad gemeenschappelijke regeling vormen de formele bekendmakingen in de zin van de Bekendmakingswet en de Rijkswet goedkeuring en bekendmaking verdragen voor zover ze na 1 juli 2009 zijn uitgegeven. Voor pdf-publicaties van vóór deze datum geldt dat alleen de in papieren vorm uitgegeven bladen formele status hebben; de hier aangeboden elektronische versies daarvan worden bij wijze van service aangeboden.
