Staatsblad van het Koninkrijk der Nederlanden
| Datum publicatie | Organisatie | Jaargang en nummer | Rubriek | Datum ondertekening |
|---|---|---|---|---|
| Ministerie van Volksgezondheid, Welzijn en Sport | Staatsblad 2004, 549 | AMvB |
Zoals vergunningen, bouwplannen en lokale regelgeving.
Adressen en contactpersonen van overheidsorganisaties.
U bent hier:

| Datum publicatie | Organisatie | Jaargang en nummer | Rubriek | Datum ondertekening |
|---|---|---|---|---|
| Ministerie van Volksgezondheid, Welzijn en Sport | Staatsblad 2004, 549 | AMvB |
Wij Beatrix, bij de gratie Gods, Koningin der Nederlanden, Prinses van Oranje-Nassau, enz. enz. enz.
Op de voordracht van Onze Minister van Volksgezondheid, Welzijn en Sport van 12 juli 2004, VGB/P&L 2497622, gedaan in overeenstemming met Onze Minister van Economische Zaken en Onze Minister van Justitie;
Gelet op richtlijn nr. 93/35/EEG van de Raad van 14 juni 1993 tot zesde wijziging van richtlijn 76/768/EEG betreffende de onderlinge aanpassing van de wetgevingen der Lid-Staten inzake kosmetische produkten (PbEG L 151), richtlijn nr. 2003/15/EG van het Europees Parlement en de Raad van 27 februari 2003 tot wijziging van richtlijn nr. 76/768/EEG betreffende de onderlinge aanpassing van de wetgevingen der lidstaten inzake cosmetische producten (PbEU L 66), richtlijn nr. 2003/80/EG van de Commissie van 5 september 2003 tot vaststelling van het symbool dat de houdbaarheid van cosmetische producten aangeeft, in bijlage VIII bis bij richtlijn 76/768/EEG van de Raad (PbEU L 224), alsmede de artikelen 4, 6, onderdeel c, 8, 12, 13, onderdeel a, 14 en 32b, eerste lid, van de Warenwet;
De Raad van State gehoord (advies van 10 september 2004, Nummer W13.04.0367/III);
Gezien het nader rapport van Onze Minister van Volksgezondheid, Welzijn en Sport van 7 oktober 2004, VGP/P&L 2519083, uitgebracht in overeenstemming met Onze Minister van Economische Zaken en Onze Minister van Justitie;
Hebben goedgevonden en verstaan:
Het Warenwetbesluit kosmetische produkten wordt als volgt gewijzigd:
In het gehele besluit wordt:
1. «kosmetische» telkens vervangen door: cosmetische.
2. «kosmetisch» telkens vervangen door: cosmetisch.
3. «produkt» telkens vervangen door: product.
4. «produkten» telkens vervangen door: producten.
5. «produktie», ook in al zijn samenstellingen, telkens vervangen door: productie.
In artikel 1 worden, onder vervanging van de punt aan het slot van zowel onderdeel a als onderdeel b door een puntkomma, vijf onderdelen toegevoegd, luidende:
c. prototype: een eerste model of ontwerp dat niet in partijen wordt geproduceerd en op basis waarvan het cosmetisch product in de eindsamenstelling waarin het wordt verhandeld en ter beschikking van de consument wordt gesteld, wordt gekopieerd of definitief ontwikkeld;
d. richtlijn 67/548/EEG: richtlijn nr. 67/548/EEG van de Raad van de Europese Gemeenschappen van 27 juni 1967 betreffende de aanpassing van de wettelijke en bestuursrechtelijke bepalingen inzake de indeling, de verpakking en het kenmerken van gevaarlijke stoffen (PbEG L 196);
e. richtlijn 76/768/EEG: richtlijn nr. 76/768/EEG van de Raad van 27 juli 1976 van de Europese Gemeenschappen betreffende de onderlinge aanpassing van de wetgevingen der Lid-Staten inzake kosmetische producten (PbEG L 262);
f. alternatieve methode: een methode waarbij op wetenschappelijk verantwoorde wijze, geen gebruik wordt gemaakt van proefdieren, of, als een dergelijke methode niet beschikbaar is, waarbij dierproeven worden verricht en waarbij gebruik wordt gemaakt van een zo gering mogelijk aantal dieren, waarbij dieren betrokken zijn met de laagste graad van neurofysiologische gevoeligheid, en zo min mogelijk pijn, lijden, ongemak of blijvend letsel wordt berokkend, en die de grootste kans bieden op bevredigende resultaten;
g. dierproef: een proef als bedoeld in artikel 2, onderdeel d, van richtlijn nr. 86/609/EEG van de Raad van 24 november 1986 inzake de onderlinge aanpassing van de wettelijke en bestuursrechtelijke bepalingen van de Lid-Staten betreffende de bescherming van dieren die voor experimentele en andere wetenschappelijke doeleinden worden gebruikt (PbEG L 358).
Artikel 2 wordt als volgt gewijzigd:
1. In het derde lid wordt «onder a tot en met f» vervangen door: onder a tot en met g.
2. Het vijfde lid wordt vervangen door twee leden, luidende:
5. Het is verboden cosmetische producten te verhandelen ten behoeve waarvan ingrediënten, combinaties van ingrediënten of de eindsamenstelling van deze producten, om aan de voorschriften van dit besluit te voldoen, zijn beproefd volgens een andere methode dan een door Onze Minister voor die beproeving aangewezen alternatieve methode, voor zover deze beproeving heeft plaatsgevonden na het tijdstip met ingang waarvan de alternatieve methode is aangewezen.
6. Onze Minister stelt nadere regels over welke methode als alternatieve methode wordt aangemerkt.
Artikel 4 wordt als volgt gewijzigd:
1. Het eerste lid, onderdeel a, komt te luiden:
a. een vermelding van de naam of de handelsnaam en het adres of de vestigingsplaats van de fabrikant, zijn gevolmachtigde, degene voor wiens rekening een cosmetisch product gefabriceerd is of degene die verantwoordelijk is voor het in de handel brengen van het cosmetisch product in Nederland, voor zover dit niet geschiedt vanuit een lidstaat van de Europese Unie dan wel de Europese Economische Ruimte, met dien verstande dat de vermelding mag worden afgekort voor zover de afkorting de identificatie van de onderneming mogelijk maakt;
2. Het eerste lid, onderdeel d, wordt vervangen door:
d. een vermelding van de datum van minimale houdbaarheid in de volgorde maand, jaar of in de volgorde dag, maand, jaar en voorafgegaan door de woorden «bij voorkeur te gebruiken vóór eind ...» ofwel door een aanwijzing waar deze datum op de verpakking te vinden is;
3. Aan het eerste lid, onderdeel i, wordt na de zinsnede «dat de woorden «kan ... bevatten» de zinsnede «of het symbool «+/–» ingevoegd en wordt de volgende zin toegevoegd:
De aanwezigheid van stoffen waarvan de vermelding in de kolom «Andere beperkingen en eisen» in bijlage III van richtlijn 76/768/EEG is voorgeschreven, wordt in de lijst vermeld, ongeacht de functie van die stoffen in het product.
4. Het vierde lid komt te luiden:
4. In afwijking van het eerste lid, onderdeel d, wordt bij cosmetische producten die langer dan dertig maanden na verpakking nog houdbaar zijn, door middel van de bij dit besluit behorende bijlage 1 opgenomen symbool gevolgd door de aanduiding van de periode in maand of jaar, aangegeven hoe lang het product na opening zonder enig risico door de consument kan worden gebruikt.
5. In het achtste lid wordt «uitsluitend» vervangen door: ten minste.
6. In het negende lid wordt «de bijlage» vervangen door: bijlage 2.
Artikel 5 wordt vervangen door:
De fabrikant, zijn gevolmachtigde, degene voor wiens rekening een cosmetisch product gefabriceerd is of degene die verantwoordelijk is voor het in de handel brengen van het cosmetisch product in Nederland, voor zover dit niet geschiedt vanuit een lidstaat van de Europese Unie dan wel de Europese Economische Ruimte, vermeldt alleen dan dat het product niet op dieren is getest, indien de fabrikant en zijn leveranciers geen dierproeven hebben uitgevoerd of laten uitvoeren met het cosmetisch product in de eindsamenstelling waarin het wordt verhandeld en ter beschikking van de consument wordt gesteld, het prototype daarvan of enig ingrediënt daarvan, en evenmin ingrediënten hebben aangewend die door anderen op dieren zijn getest met het doel nieuwe cosmetische producten te ontwikkelen.
Artikel 6 wordt als volgt gewijzigd:
1. In het eerste lid wordt de zinsnede «degene die voor het in de handel brengen van ingevoerde kosmetische produkten binnen het grondgebied waarop het Verdrag betreffende de Europese Unie dan wel de Overeenkomst betreffende de Europese Economische Ruimte van toepassing is, verantwoordelijk is,» vervangen door: degene die verantwoordelijk is voor het in de handel brengen van het cosmetisch product in Nederland, voor zover dit niet geschiedt vanuit een lidstaat van de Europese Unie dan wel de Europese Economische Ruimte.
2. In het eerste lid wordt onder vervanging van de puntkomma aan het slot van onderdeel c door een punt, de volgende zin toegevoegd:
Hij houdt hierbij rekening met de specifieke blootstellingskenmerken van de plaatsen waarop het product zal worden aangebracht of met die van de doelgroep. Hij verricht ten minste een specifieke beoordeling van cosmetische producten die bestemd zijn voor kinderen beneden de leeftijd van drie jaar, en cosmetische producten die uitsluitend bestemd zijn voor uitwendige intieme hygiëne;
3. In het eerste lid wordt onder vervanging van de punt aan het slot van onderdeel f door een puntkomma een onderdeel toegevoegd, luidende:
g. gegevens over eventuele dierproeven die door de fabrikant, zijn gevolmachtigde, degene voor wiens rekening een cosmetisch product gefabriceerd is of degene die verantwoordelijk is voor het in de handel brengen van het cosmetisch product in Nederland, voor zover dit niet geschiedt vanuit een lidstaat van de Europese Unie dan wel de Europese Economische Ruimte, zijn verricht betreffende de ontwikkeling of veiligheidsbeoordeling van het product of de ingrediënten daarvan, met inbegrip van eventuele dierproeven die zijn verricht om te voldoen aan de voorschriften van niet-lidstaten van de Europese Unie dan wel de Europese Economische Ruimte.
4. Het vijfde lid komt te luiden:
5. De fabrikant, zijn gevolmachtigde, degene voor wiens rekening een cosmetisch product gefabriceerd is of degene die verantwoordelijk is voor het in de handel brengen van het cosmetisch product in Nederland, voor zover dit voor de eerste maal geschiedt binnen het grondgebied waarop het Verdrag betreffende de Europese Unie dan wel de Overeenkomst betreffende de Europese Economische Ruimte van toepassing is, stelt de in artikel 25 van de Warenwet bedoelde ambtenaren in kennis van het adres van de plaatsen van productie of van eerste invoer in Nederland, alvorens deze producten worden verhandeld.
5. Na het zevende lid worden twee leden toegevoegd, luidende:
8. Onverminderd de intellectuele eigendomsrechten en het handelsgeheim verstrekt de fabrikant, zijn gevolmachtigde, degene voor wiens rekening een cosmetisch product gefabriceerd is of degene die verantwoordelijk is voor het in de handel brengen van het cosmetisch product in Nederland, voor zover dit niet geschiedt vanuit een lidstaat van de Europese Unie dan wel de Europese Economische Ruimte:
a. informatie als bedoeld in het eerste lid, onderdeel a, met betrekking tot de kwalitatieve samenstelling van het product, en onderdeel e;
b. informatie als bedoeld in het eerste lid, onderdeel a, met betrekking tot de kwantitatieve samenstelling van het product voor zover het gevaarlijke stoffen betreft als bedoeld in richtlijn 67/548/EEG.
9. Onze Minister stelt in overeenstemming met Onze Minister van Economische Zaken nadere regels ten behoeve van de informatieverstrekking, bedoeld in het achtste lid.
Na artikel 6 wordt een artikel ingevoegd, luidende:
Een wijziging van richtlijn 67/548/EEG en bijlage III van richtlijn 76/768/EEG, gaat voor toepassing van respectievelijk artikel 6, achtste lid en artikel 4, eerste lid, onderdeel i, gelden met ingang van de dag waarop aan de betrokken wijzigingsrichtlijn uitvoering moet zijn gegeven, tenzij bij ministerieel besluit, dat in de Staatscourant wordt bekendgemaakt, een ander tijdstip wordt vastgesteld.
1. Het opschrift van de bijlage komt te luiden:
Bijlage 2
Bijlage bij artikel 4, negende lid, van het Warenwetbesluit cosmetische producten.
2. Voor Bijlage 2 (nieuw) wordt de bij dit besluit behorende bijlage ingevoegd.
Het Warenwetbesluit bestuurlijke boeten wordt als volgt gewijzigd:
De bijlage wordt als volgt gewijzigd:
1. Na onderdeel C-24.2.2 wordt een onderdeel ingevoegd, luidende:
C-24.2.2a | art. 2 lid 2 jº art. 4 lid 4 | € 450 | € 900 |
2. Na onderdeel C-24.2.10 wordt een onderdeel ingevoegd, luidende:
C-24.2.11 | art. 2 lid 2 jº art. 6 lid 8 | € 450 | € 900 |
De cosmetische producten die:
a. voldoen aan artikel 4, eerste lid, onderdelen d en i, en artikel 4, vierde lid, van het Warenwetbesluit cosmetische producten zoals dit luidde vóór de inwerkingtreding van dit besluit; en
b. vóór 11 maart 2005 zijn verhandeld;
mogen ook na de inwerkingtreding van dit besluit nog worden verhandeld.
Lasten en bevelen dat dit besluit met de daarbij behorende nota van toelichting in het Staatsblad zal worden geplaatst.
histnootDe Minister van Volksgezondheid, Welzijn en Sport,
J. F. Hoogervorst
Uitgegeven de negenentwintigste oktober 2004
De Minister van Justitie,
J. P. H. Donner
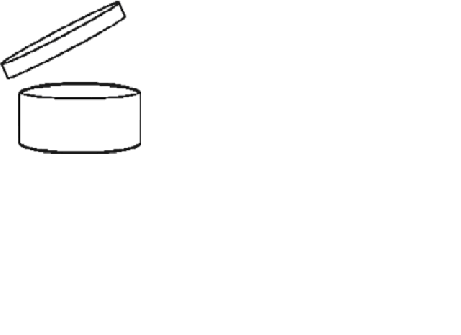
Bijlage bij artikel 4, vierde lid, van het Warenwetbesluit cosmetische producten
Dit wijzigingsbesluit strekt tot uitvoering van richtlijn nr. 93/35/EEG van de Raad van 14 juni 1993 tot zesde wijziging van richtlijn 76/768/EEG betreffende de onderlinge aanpassing van de wetgevingen der Lid-Staten inzake kosmetische produkten (PbEG L 151), richtlijn nr. 2003/15/EG van het Europees Parlement en de Raad van 27 februari 2003 tot wijziging van richtlijn 76/768/EEG betreffende de onderlinge aanpassing van de wetgevingen der lidstaten inzake cosmetische producten (PbEU L 66) en richtlijn nr. 2003/80/EG van de Commissie van 5 september 2003 tot vaststelling van het symbool dat de houdbaarheid van cosmetische producten aangeeft, in bijlage VIII bis bij richtlijn 76/768/EEG van de Raad (PbEU L 224).
Richtlijn 2003/15/EG beoogt de geleidelijke afschaffing van het gebruik van dierproeven voor cosmetische producten te realiseren. De veiligheid van ingrediënten die in cosmetische producten worden gebruikt, zal geleidelijk kunnen worden gewaarborgd met behulp van alternatieve methoden waarbij geen dieren worden gebruikt of waarbij het lijden van dieren bij de proeven tot een minimum is teruggebracht en die op communautair niveau door het Europees Centrum voor de validatie van alternatieve methoden (ECVAM) zijn gevalideerd of als wetenschappelijk valide zijn erkend. Dit met inachtneming van de ontwikkeling van de validering binnen de OESO. In de Wet op de dierproeven is het genoemde verbod op dierproeven reeds ingevoerd. In deze wet is het gebruik van levende dieren voor het ontwikkelen van nieuwe dan wel het testen van bestaande cosmetische producten verboden. De richtlijn voorziet ook in een verbod op het verhandelen van cosmetische producten waarvoor proeven zijn verricht, anders dan door de Commisie vastgestelde alternatieve methoden.
Richtlijn 2003/15/EG geeft eveneens regels over de wijze waarop bij cosmetische producten volledige informatie over de houdbaarheidsduur verstrekt kan worden, zodat consumenten beter worden geïnformeerd.
Voor cosmetische producten met een minimale houdbaarheid van meer dan dertig maanden moet worden vermeld hoe lang het product na opening zonder enig risico door de consument kan worden gebruikt. Richtlijn 2003/80/EG bepaalt dat dit gebeurt door middel van een symbool (geopend zalfpotje), gevolgd door de aanduiding van de periode in maand of jaar.
Tot slot bevat de richtlijn bepalingen over het verschaffen van informatie over stoffen die een bron van allergische reacties zijn bij consumenten. Deze informatie zal de diagnose van contactallergieën bij die consumenten verbeteren en hen in staat stellen het gebruik van cosmetische producten die zij niet verdragen te vermijden.
De stoffen genoemd in artikel 1, onderdeel 10, van richtlijn 2003/15/EG worden door middel van artikel 8 van de Warenwetregeling nadere eisen cosmetische producten geïmplementeerd.
Het is wenselijk de schrijfwijze van een aantal woorden aan te passen aan de huidige spelling. Daartoe worden de woorden «kosmetische», «kosmetisch», «produkt», «produkten» en «produktie» vervangen door respectievelijk «cosmetische», «cosmetisch», «product», «producten» en «productie».
Aan artikel 1 worden vijf definities toegevoegd.
In onderdeel g wordt een definitie gegeven van een dierproef. Hierbij wordt verwezen naar artikel 2, onderdeel d, van richtlijn nr. 86/609/EEG van de Raad van 24 november 1986 inzake de onderlinge aanpassing van de wettelijke en bestuursrechtelijke bepalingen van de Lid-Staten betreffende de bescherming van dieren die voor experimentele en andere wetenschappelijke doeleinden worden gebruikt (PbEG L 358). In dit artikel wordt onder proef verstaan: ieder gebruik van een dier voor experimentele en andere wetenschappelijke doeleinden waardoor pijn, lijden, ongemak of blijvend letsel aan het dier kan worden berokkend, met inbegrip van iedere behandeling waarvan het doel of het mogelijke gevolg de geboorte van het dier in een dergelijke toestand is, maar met uitzondering van de minst pijnlijke, in de moderne praktijk aanvaarde methoden voor het doden of merken van een dier (zogeheten «humane methoden»); een proef begint bij de eerste voorbereiding van een dier voor gebruik en eindigt wanneer geen verdere waarnemingen voor die proef worden gedaan; de uitschakeling van pijn, lijden, ongemak of blijvend letsel door de efficiënte toepassing van algehele of van plaatselijke verdoving, of van een andere methode, heeft niet tot gevolg dat het gebruik van een dier in dat geval buiten deze omschrijving valt. Niet-experimentele behandelingen in de landbouwkundige bedrijfsvoering en in de uitoefening van de diergeneeskundige praktijk zijn van deze richtlijn uitgesloten.
In verband met de toevoeging van onderdeel g aan artikel 6, eerste lid, wordt het verbod van artikel 2, derde lid, van toepassing op de informatie die in dit onderdeel is opgenomen.
Het nieuwe vijfde lid verbiedt cosmetische producten te verhandelen ten behoeve waarvan ingrediënten, combinaties van ingrediënten of de eindsamenstelling van deze producten, om aan de voorschriften van dit besluit te voldoen, zijn beproefd volgens een andere methode dan een door Onze Minister voor die beproeving aangewezen alternatieve methode, voor zover deze beproeving heeft plaatsgevonden na het tijdstip met ingang waarvan de alternatieve methode is aangewezen. De Commissie zal alternatieve methoden, die zijn gevalideerd door de ECVAM of als wetenschappelijk valide zijn erkend, na raadpleging van het Wetenschappelijk Comité voor cosmetische producten en voor niet-voedingsproducten (WCCNVP), voor iedere proef afzonderlijk vaststellen. Hiertoe wordt een methode die als alternatief wordt aangemerkt opgenomen in bijlage IX van richtlijn 76/768/EEG of in bijlage V van richtlijn 67/548/EEG. Gelet op het feit dat nog niet duidelijk is op welke manier de inhoud van de genoemde bijlagen wordt vormgegeven, wordt door Onze Minister iedere alternatieve methode die door de Commissie wordt vastgesteld, afzonderlijk genoemd in een ministeriële regeling (zesde lid). Iedere toevoeging aan bijlage IX van richtlijn 76/768/EEG en bijlage V van richtlijn 67/548/EEG, wordt binnen de implementatietermijn die de wijzigingsrichtlijn stelt, worden opgenomen in een door Onze Minister uit te vaardigen regeling. Vanaf het moment dat het verbod in werking treedt, is het niet toegestaan om cosmetische producten te verhandelen waarvoor op een tijdstip nadat een alternatieve methode voor de beproeving is aangewezen, proeven zijn verricht anders dan door de vastgestelde alternatieve methode. Op dit moment zijn nog geen alternatieve methoden door de Commissie aangewezen.
Zij zal een tijdschema met termijnen voor het ontwikkelen van alternatieve methoden vaststellen. Dit tijdschema zal voorzien in een gefaseerde inwerkingtreding van het onderhavige verbod voor de verschillende methoden. De Commissie streeft ernaar om over maximaal zes jaar vanaf de datum van de inwerkingtreding van richtlijn 2003/15/EG (11 september 2004), voor iedere methode een alternatief beschikbaar te hebben. Voor proeven betreffende toxiciteit bij herhaalde toediening, toxiciteit met betrekking tot de voortplanting en toxicokinetiek, waarvoor momenteel nog geen alternatieven worden ontwikkeld, wordt een tijdschema van maximaal tien jaar vanaf de datum van inwerkingtreding van richtlijn 2003/15/EG, opgesteld.
In artikel 4, eerste lid, onderdeel a, wordt een verbetering aangebracht ten aanzien van degenen tot wie de norm is gericht. Thans is opgenomen dat degene die verantwoordelijk is voor het in de handel brengen van het cosmetisch product in Nederland, voor zover dit niet geschiedt vanuit een lidstaat van de Europese Unie dan wel de Europese Economische Ruimte, ook aan de verplichting van onderdeel a is gebonden. Deze verbetering is verder door het gehele besluit doorgevoerd.
In artikel 4, eerste lid, onderdeel d, wordt bepaald dat cosmetische producten voorzien moeten zijn van een vermelding van de datum van minimale houdbaarheid. Het vierde lid ziet op de situatie dat deze vermelding niet verplicht is wanneer de minimale houdbaarheid meer dan 30 maanden bedraagt. In dit geval wordt aangegeven hoe lang het product na opening zonder enig risico door de consument kan worden gebruikt. Deze informatie wordt aangegeven door middel van het in bijlage 1 bij het Warenwetbesluit cosmetische producten opgenomen symbool, waarmee richtlijn 2003/80/EG wordt geïmplementeerd, en de aanduiding van de periode in maand of jaar. De aanduiding van deze periode kan ook worden aangegeven door middel van het aantal maanden gevolgd door hoofdletter «M».
Het eerste lid, onderdeel i, regelt dat het symbool «+/–» kan worden gebruikt in plaats van «kan … bevatten». Tevens wordt aan dit onderdeel toegevoegd dat bij aanwezigheid van stoffen die worden vermeld in de kolom «Andere beperkingen en eisen» in bijlage III van richtlijn 76/768/EEG, dit moet worden vermeld in de lijst met ingrediënten. Dit verbetert de informatie aan de consument, zodat de consument bepaalde stoffen kan vermijden.
In het achtste lid wordt een verschrijving gecorrigeerd die is opgetreden bij de implementatie van richtlijn 93/35/EEG van de Raad van 14 juni 1993 tot zesde wijziging van Richtlijn 76/768/EEG betreffende de onderlinge aanpassing van de wetgevingen der Lid-Staten inzake kosmetische produkten (PbEG L 151). Thans wordt bepaald dat de vermelding van het eerste lid, onderdeel i, ten minste op de verpakking wordt aangebracht.
Thans regelt artikel 5 dat alleen een vermelding op het product mag komen als het niet op dieren is getest, indien met het cosmetisch product in de eindsamenstelling waarin het wordt verhandeld en ter beschikking van de consument wordt gesteld, het prototype daarvan of enig ingrediënt daarvan, geen dierproeven zijn uitgevoerd.
Ten aanzien van de verplichting van de fabrikant, zijn gevolmachtigde, degene voor wiens rekening een cosmetisch product gefabriceerd is of degene die verantwoordelijk is voor het in de handel brengen van het cosmetisch product in Nederland, voor zover dit niet geschiedt vanuit een lidtsaat van de Europese Unie dan wel de Europese Economische Ruimte, om gegevens ter gerede beschikking te houden van de in artikel 25 van de Warenwet bedoelde ambtenaren, is een aantal aanvullingen gedaan.
Onderdeel c van artikel 6, eerste lid, is uitgebreid. Dit houdt in dat bij de beoordeling van de veiligheid van het cosmetisch product voor de gezondheid van de mens ook rekening wordt gehouden met de specifieke blootstellingskenmerken van de plaatsen waarop het product zal worden aangebracht of met de blootstellingskenmerken van de doelgroep. Dit betekent dat een specifieke beoordeling wordt verricht bij cosmetische producten die bestemd zijn voor kinderen beneden de leeftijd van drie jaar, en van cosmetische producten die uitsluitend bestemd zijn voor de uitwendige intieme hygiëne.
Aan het eerste lid is onderdeel g toegevoegd, waarin is vermeld dat gegevens over eventuele dierproeven die zijn verricht beschikbaar moeten zijn voor de in artikel 25 van de Warenwet bedoelde ambtenaren.
In het vijfde lid van artikel 6 wordt een verbetering doorgevoerd. De in artikel 25 van de Warenwet bedoelde ambtenaren worden thans, voordat de cosmetische producten worden verhandeld, in kennis gesteld van het adres van de plaatsen van productie of van eerste invoer in Nederland. De genoemde ambtenaren worden alleen in kennis gesteld van plaatsen van eerste invoer in Nederland als het cosmetisch product voor de eerste maal wordt verhandeld binnen het grondgebied waarop het Verdrag betreffende de Europese Unie dan wel de Overeenkomst betreffende de Europese Economische Ruimte van toepassing is.
In het achtste lid wordt een informatieplicht opgelegd aan de fabrikant, zijn gevolmachtigde, degene voor wiens rekening een cosmetisch product gefabriceerd is of degene die verantwoordelijk is voor het in de handel brengen van het cosmetisch product in Nederland, voor zover dit niet geschiedt vanuit een lidstaat van de Europese Unie dan wel de Europese Economische Ruimte. Met de invoering van dit artikel 6, achtste lid, wordt een onderdeel van artikel 7 bis, eerste lid, onderdeel h, van richtlijn 2003/15 geïmplementeerd. Met dit artikel wordt beoogd een Europees informatiesysteem ten behoeve van de consument in te voeren, zodat de consument informatie kan verkrijgen over de kwalitatieve samenstelling van een cosmetisch product en de kwantitatieve samenstelling van het product voor zover het gevaarlijke stoffen betreft. Door de invoering van dit systeem moet het voor de consument eenvoudiger worden om bij verschillende fabrikanten informatie te verkrijgen, zelfs als deze fabrikant in een andere lidstaat is gevestigd dan waar de consument onderdaan is.
Het negende lid geeft de minister de bevoegdheid nadere regels te stellen met betrekking tot de uitvoering van deze informatieplicht. De minister stelt nadere regels die betrekking hebben op de wijze waarop de informatie toegankelijk is. Hierbij zal worden aangesloten bij de beleidsregels die betrekking hebben op artikel 7 bis, eerste lid, onderdeel h, van richtlijn 2003/15, zoals die worden voorbereid door de Commissie.
Dit artikel regelt wanneer een wijziging van richtlijn 67/548/EEG en bijlage III van richtlijn 76/768/EEG, in werking treden voor toepassing van de artikelen waarin naar een of meerdere van de bijlagen wordt verwezen.
In beginsel geldt de datum waarop aan de betrokken wijzigingsrichtlijn, waarbij de bijlage wordt gewijzigd, uitvoering moet zijn gegeven, tenzij bij ministeriële regeling een ander tijdstip wordt vastgesteld.
De bestaande bijlage behorende bij artikel 4, negende lid, wordt genummerd, omdat een tweede bijlage wordt toegevoegd.
De normen die aan het besluit worden toegevoegd, worden gehandhaafd door middel van een bestuurlijke boete. Derhalve worden enkele onderdelen toegevoegd aan de bijlage van het Warenwetbesluit bestuurlijke boeten. De in artikel II van dit wijzigingsbesluit bedoelde overtredingen worden beboet met een bedrag van € 450,– voor de kleine bedrijven (50 of minder werknemers) en een boete van € 900,– voor de zogenaamde grote bedrijven (meer dan 50 werknemers). Overtreding van de hier in het geding zijnde voorschriften vertonen, voor zover zij door een bestuurlijke boete kunnen worden afgedaan, een goed vergelijkbare mate van (geringe) ernst. Voor een verdere toelichting inzake de hoogte van deze bedragen, zij verwezen naar de nota van toelichting bij het Warenwetbesluit bestuurlijke boeten.
Dit artikel regelt dat de producten, die aan de eisen voldoen van artikel 4, eerste lid, onderdelen d en i, en artikel 4, vierde lid, van het Warenwetbesluit cosmetische producten voordat het werd gewijzigd door dit besluit, tot 11 maart 2005 mogen worden verhandeld. Na 11 maart 2005 kunnen de producten die voor deze datum al werden verhandeld, nog steeds worden verhandeld. Vanaf deze datum dienen de producten die nog niet eerder werden verhandeld aan de voorschriften van artikel 4, eerste lid, onderdelen d en i, en artikel 4, vierde lid, van dit besluit te voldoen.
Artikel II treedt acht weken na de datum van uitgifte van het Staatsblad waarin hij is geplaatst, in werking. Hiermee wordt rekening gehouden met artikel 32b van de Warenwet.
Richtlijn 2003/15 | |
|---|---|
Artikel 1 | |
Onderdeel 1 | Behoeft geen implementatie |
Onderdeel 2 (artikel 4 bis, eerste lid, onderdelen a en b) | Artikel 2, vijfde en zesde |
Onderdeel 2 (artikel 4 bis, eerste lid, onderdelen c en d) | Behoeft geen implementatie |
Onderdeel 2 (artikel 4 bis, tweede lid, onderdelen 2.1 tot en met 2.4) | Behoeft geen implementatie |
Onderdeel 2 (artikel 4 bis, derde lid, onderdelen a en b) | Artikel 1 |
Onderdeel 2 (artikel 4 ter) | Behoeft geen implementatie |
Onderdeel 3 | Artikel 4, eerste lid, onderdeel d, en vierde lid |
Onderdeel 4 | Artikel 4, eerste lid, onderdeel i |
Onderdeel 5 | Artikel 5 |
Onderdeel 6 | Artikel 6, eerste lid, onderdeel c |
Onderdeel 7 | Artikel 6, eerste lid, onderdeel g, en achtste en negende lid |
Onderdelen 8 en 9 | Behoeven geen implementatie |
Onderdeel 10 | Implementatie via dynamische verwijzing |
Onderdeel 11 | Bijlage 2 |
Artikel 2 | Artikel III |
Artikel 3 | Artikel IV |
Artikelen 4 en 5 | Behoeven geen implementatie |
Richtlijn 2003/80 | |
Artikel 1 | Artikel 4, vierde lid |
De kosten die met dit wijzigingsbesluit gepaard gaan, zijn onder meer kosten die gemaakt moeten worden om aan de administratieve verplichtingen van de richtlijn te voldoen. Met name de etiketteringsverplichtingen en de introductie van de informatieplicht naar de consument over de samenstelling van het cosmetisch product en de gezondheidsklachten, zorgen voor hoge lasten. Bij de informatieplicht gaat het onder meer om het uitwerken van klachten registraties en het uitbreiden van het informatiesysteem aan de consument. Een aantal verplichtingen maakt het nodig dat vrijwel alle etiketten moeten worden aangepast. Extra verzwarende omstandigheid is dat voor producten die langer dan 30 maanden houdbaar zijn een symbool op het etiket verplicht wordt gesteld. Het gaat om ongeveer alle cosmetische producten en het toevoegen van een symbool op het etiket kan betekenen dat het ontwerp van het etiket fundamenteel anders moet worden.
In de nulmeting van VWS wordt uitgegaan van 500 producenten en importeurs van cosmetische producten, uitgesplitst naar 475 MKB bedrijven en 25 multinationals.
In de nulmeting van VWS is in de berekening van de administratieve lasten uitgegaan van gemiddeld 1 wijziging van het etiket per jaar Deze wijzigingen kunnen worden veroorzaakt door wijzigingen in diverse besluiten en regelingen in de Warenwet. Voor wat betreft het Warenwetbesluit cosmetische producten is in de nulmeting uitgegaan van het Hoeveelheidsaanduidingenbesluit (Warenwet). De kosten die gemoeid zijn met de etikettering zijn op jaarbasis als volgt te berekenen.
Handeling | Berichten | Doelgroep | Uurtarief | Tijd | Freq | P | Q | Totaal |
|---|---|---|---|---|---|---|---|---|
Ontwerpen nieuwe etiketten | Alle bedrijven die waren produceren/ verhandelen | € 30 | 1200 | 1 | 36.000+ 25.000 externe kosten | 25 | 1.525.000 | |
Ontwerpen nieuwe etiketten | Alle bedrijven die waren produceren/ verhandelen | € 30 | 120 | 1 | 3.600 + 2.500 externe kosten | 475 | 2.897.500 | |
Totaal | 4.422.500 |
De richtlijn introduceert vier nieuwe etiketteringsverplichtingen:
1. bij minimale houdbaarheid worden de woorden «ten minste houdbaar tot einde» vervangen door «bij voorkeur te gebruiken vóór eind…» of wel door een aanwijzing waar de datum op de verpakking te vinden is (artikel 4, eerste lid, onderdeel d);
2. uitbreiding van de parfumetikettering (artikel 4, eerste lid, onderdeel i);
3. toevoegen van een symbool op producten die langer dan 30 maanden houdbaar zijn, gevolgd door de aanduiding van de periode in maand of jaar (artikel 4, vierde lid);
4. aanpassen claim «niet op dieren getest» (artikel 5).
Deze etiketteringsverplichtingen zijn eenmalig. De eerste drie etiketteringsverplichtingen gelden voor ongeveer 100% van de producten. De claim «niet op dieren getest» geldt voor 10% van deze markt. De verwachting is dat de bedrijven in één keer de etiketten zullen aanpassen, zodat wordt voldaan aan de vier etiketteringsverplichtingen. Op basis van de nulmeting komen de administratieve lasten voor deze etiketteringsverplichtingen dus uit op ongeveer € 4.400.000.
De Nederlandse Cosmetica Vereniging komt echter voor deze etiketteringsverplichtingen uit op een aanzienlijk hoger bedrag (€ 15.000.000). Een verklaring voor dit verschil is dat in de nulmeting bij een wijziging van een etiket van een cosmetisch product uitgegaan wordt van een wijziging van een etiket onder het Hoeveelheidsaanduidingenbesluit. De daar geldende uitgangspunten zijn niet representatief voor de cosmeticabranche. De uurtarieven en de tijdsbesteding voor het vormgeven van het nieuwe etiket kunnen aanzienlijk verschillen.
Naast de etiketteringsverplichtingen introduceert de richtlijn ook drie structurele administratieve lasten:
1. specifieke veiligheidsbeoordeling kinderproducten en producten voor de intieme hygiëne (artikel 6, eerste lid, onderdeel c);
2. registratie van uitgevoerde dierproeven (artikel 6, eerste lid, onderdeel g);
3. informatieplicht richting publiek (artikel 6, achtste lid).
In de nulmeting van VWS is een schatting gemaakt voor de administratieve lasten uit artikel 6. Op basis van deze gegevens is een berekening gemaakt voor de drie structurele administratieve lasten. Deze zijn als volgt.
Handeling | Berichten | Doelgroep | Uurtarief | Tijd | Freq. | P | Q | Totaal |
|---|---|---|---|---|---|---|---|---|
Specifieke veiligheids-beoordeling | Alle cosmetica-bedrijven | € 60 | 8 | 1 | 480 | 500 | 240.000 | |
Registratie uitgevoerde dierproeven | Alle cosmetica-bedrijven | € 60 | 50 | 1 | 6.000 | 500 | 1.500.000 | |
Informatieplicht | Alle cosmetica-bedrijven | € 60 | 100 | 1 | 6.000 | 500 | 3.000.000 | |
Totaal | 4.740.000 |
Gebruik makend van de gegevens uit de nulmeting worden de totale administratieve lasten voor het Nederlandse bedrijfsleven als gevolg van dit besluit geschat op ongeveer € 9.000.000.
Op Europees niveau heeft ook een nulmeting plaatsgevonden. De resultaten van deze Europese nulmeting zijn beschreven in het RPA rapport, Business Impact Assessment of the 7th Amendment to the Cosmetics Directive (June 2003). Het RPA rapport geeft een berekening van de totale kosten die richtlijn 2003/15/EEG voor de cosmetica industrie in de Europese context met zich mee zal brengen. De informatie in het rapport is gebaseerd op vragenlijsten die ingevuld zijn door zowel het MKB als de multinationals. De opzet, methodiek en uitgangspunten van het RPA-rapport wijkt af van de VWS nulmeting. Om uit de totale kosten die richtlijn 2003/15/EG met zich meebrengt de administratieve lasten te bepalen, zijn uit het RPA-rapport die kostenposten geselecteerd die te maken hebben met het verstrekken van informatie, zowel aan de overheid als aan de consument.
Lasten uit de richtlijn | Kosten |
|---|---|
«bij voorkeur te gebruiken vóór eind…» | geen gegevens beschikbaar |
Uitbreiding van de parfumetikettering op de verpakking | 7.250.000 |
Etiketteren van de periode-na-openen | 7.250.000 |
Claim: «Niet op dieren getest» | 750.000 |
Specifieke beoordeling kinderproducten en producten voor de intieme hygiëne | geen gegevens beschikbaar |
Registratie uitgevoerde dierproeven | 1.250.000 |
Nieuwe consumenten informatie gevaarlijke stoffen en gezondheidsklachten | 4.350.000 |
Op basis van dit RPA rapport worden de totale administratieve lasten voor het Nederlandse bedrijfsleven als gevolg van dit besluit geschat op ongeveer € 20.000.000. Het verschil met de nulmeting van VWS zit vooral in de etiketteringsverplichting. Een verklaring voor dit verschil is hierboven reeds gegeven.
Het betreft hier een één op één implementatie van een Europese richtlijn waarbinnen geen vrijheidsgraden zijn voor het beleid van VWS. Het bedrijfsleven zal de verschillende nieuwe etiketteringsverplichtingen samen nemen en het etiket daarop eenmalig aanpassen.
De stijging van de administratieve lasten die dit besluit met zich brengt, draagt niet bij aan de kabinetsdoelstelling om de administratieve lastendruk met 25% te verminderen. Het niet bijdragen aan deze doelstelling dient binnen VWS te worden gecompenseerd. Zowel de eenmalige als de structurele administratieve lasten stijgingen kunnen echter niet worden gecompenseerd binnen het Warenwetcomplex. Binnen het Ministerie van VWS zal worden bezien op welk terrein er wèl voldoende beleidsmatige vrijheden zijn om deze stijging van de administratieve lasten te compenseren.
Op 25 mei 2004 heeft het Adviescollege toetsing administratieve lasten geadviseerd de door dit besluit veroorzaakte stijging van de administratieve lastendruk hoe dan ook te compenseren.
Omdat hier sprake is van administratieve lasten die rechtstreeks voortvloeien uit een richtlijn, is er geen ruimte de door Actal gewenste compensatie te realiseren in het kader van het onderhavige besluit. Het door Actal uitgebrachte advies de lastendruk hoe dan ook te compenseren, zal daarom aandacht krijgen in het Project Nulmetingen dat op dit moment binnen VWS loopt om de administratieve lasten van wetgeving op het terrein van VWS te bepalen.
De Minister van Volksgezondheid, Welzijn en Sport,
J. F. Hoogervorst
Het advies van de Raad van State wordt niet openbaar gemaakt op grond van artikel 25a, vijfde lid j° vierde lid, onder b van de Wet op de Raad van State, omdat het uitsluitend opmerkingen van redactionele aard bevat.
Kopieer de link naar uw clipboard
https://zoek.officielebekendmakingen.nl/stb-2004-549.html
De hier aangeboden pdf-bestanden van het Staatsblad, Staatscourant, Tractatenblad, provinciaal blad, gemeenteblad, waterschapsblad en blad gemeenschappelijke regeling vormen de formele bekendmakingen in de zin van de Bekendmakingswet en de Rijkswet goedkeuring en bekendmaking verdragen voor zover ze na 1 juli 2009 zijn uitgegeven. Voor pdf-publicaties van vóór deze datum geldt dat alleen de in papieren vorm uitgegeven bladen formele status hebben; de hier aangeboden elektronische versies daarvan worden bij wijze van service aangeboden.
