Kamerstuk
| Datum publicatie | Organisatie | Vergaderjaar | Dossier- en ondernummer |
|---|---|---|---|
| Tweede Kamer der Staten-Generaal | 2020-2021 | 29477 nr. 701 |
Zoals vergunningen, bouwplannen en lokale regelgeving.
Adressen en contactpersonen van overheidsorganisaties.
U bent hier:

| Datum publicatie | Organisatie | Vergaderjaar | Dossier- en ondernummer |
|---|---|---|---|
| Tweede Kamer der Staten-Generaal | 2020-2021 | 29477 nr. 701 |
Aan de Voorzitter van de Tweede Kamer der Staten-Generaal
Den Haag, 16 april 2021
Met deze brief doe ik u de halfjaarlijkse voortgangsbrief ijzeren voorraad voor geneesmiddelen toekomen. Leveringsproblemen zijn een hardnekkig mondiaal probleem, waar we ook in Nederland al enige tijd hinder van ondervinden. Om de beschikbaarheid van geneesmiddelen beter te waarborgen staan verschillende nationale en Europese actielijnen uit, hierover heb ik uw Kamer recent geïnformeerd in de voortgangsbrief algemeen geneesmiddelenbeleid1. In deze brief beschreef ik onder andere op welke wijze gewerkt wordt aan het adresseren van de grondoorzaken van geneesmiddelentekorten, het verkleinen van de gevolgen in de praktijk, het in kaart brengen en oppakken van (onwenselijke) internationale afhankelijkheden en kwetsbaarheiden in de keten en het versterken van de productie in Nederland en de EU. Binnenkort ontvangt u mijn brief met de belangrijkste uitkomsten van de rondetafelgesprekken leveringszekerheid van begin maart en deze zomer zal ik uw Kamer nader informeren over mijn strategie en langetermijnagenda leveringszekerheid van medische producten, inclusief de rol van het versterken van productie in Nederland en Europa.
Een van de actielijnen om de beschikbaarheid van geneesmiddelen te borgen is de ijzeren voorraad. De ijzeren voorraad moet zorgen voor een verhoging van de voorraden in de geneesmiddelenketen, zodat er meer weerbaarheid is om tijdelijke leveringsonderbrekingen beter op te vangen. Zo kunnen de gevolgen voor patiënten verkleind worden.
Naast het verhogen van de geneesmiddelenvoorraad in de keten om de structurele weerbaarheid te vergroten is tijdens de coronacrisis door de ziekenhuizen de COVID Crisis Voorraad (CCV) met coronagerelateerde (IC-)geneesmiddelen aangelegd om voorbereid te zijn op mogelijk verhoogd piekverbruik gedurende een volgende coronagolf. Dit hangt samen met de besluitvorming omtrent de gewenste opschaling van de capaciteit in de ziekenhuizen. Over de aanleg van de CCV is uw Kamer meerdere malen separaat geïnformeerd.2 Ook stel ik de kaders op voor voorraden van persoonlijke beschermingsmiddelen (PBM) en kritische medische hulpmiddelen om voorbereid te zijn op toekomstige crises. Hierover heb ik u recent geïnformeerd.3
De uitwerking van de ijzeren voorraad geneesmiddelen gebeurt in samenwerking met veldpartijen. Er spelen verschillende vraagstukken rond de ijzeren voorraad die nadere uitwerking behoeven. Zo is in de motie van het lid Veldman gevraagd om bij het uitwerken van de ijzeren voorraad maatwerk toe te passen bij geneesmiddelen waarbij dat nodig blijkt.4 Om beter te begrijpen hoe nuancering aangebracht moet worden heeft een aantal veldpartijen het initiatief genomen om te starten met een pilot voor voorraadopbouw in een gecontroleerde omgeving. In deze brief zal ik u hierover informeren.
Waar uw kamer heeft aangedrongen op voortgang met de aanleg van voorraden heeft uw kamer mij in de motie van het lid Veldman ook gevraagd om bij het uitwerken van de ijzeren voorraad rekening te houden met wat er in Europa gebeurt. Om inzicht te krijgen in voorraadverplichtingen in Europese landen ben ik een inventarisatie gestart, in deze brief rapporteer ik over de eerste resultaten van deze inventarisatie.
Ook bij de Europese Commissie is er, mede door de coronacrisis, steeds meer aandacht voor leveringszekerheid van geneesmiddelen. Er is al enige tijd een onderzoek gaande naar de oorzaken van geneesmiddelentekorten en mogelijke (Europese) oplossingsrichtingen. De Europese Commissie kijkt ook kritisch naar de nationale aanpak van lidstaten, onder andere rondom voorraadbeleid5. De Europese Commissie is van mening dat een hoge voorraadopbouw in sommige gevallen tot tekorten in andere lidstaten zou kunnen leiden en kijkt daarbij verscherpt naar de selectie van geneesmiddelen en het aantal maanden voorraadopbouw. De Europese Commissie overweegt wel om op Europese schaal crisisvoorraden aan te leggen. Daarom is de Europese inventarisatie die ik uitvoer belangrijk. De Europese Commissie bereidt een herziening van de geneesmiddelen richtlijn (2001/83) en verordening (726/2004) (basic pharmaceutical acts) voor, hierbij kijkt men ook naar welke wetgevende veranderingen kunnen bijdragen aan het verminderen van geneesmiddelentekorten. Nederland neemt actief deel aan deze trajecten.
Eerste resultaten inventarisatie Europees voorraad- en monitoringsbeleid
De motie Veldman heeft verzocht om bij de uitwerking van de ijzeren voorraad rekening te houden met de aanpak in andere Europese landen. In 2018 heeft de Europese Commissie een uitvraag gedaan aan alle lidstaten om de huidige maatregelen die (de gevolgen van) tekorten tegen gaan, waaronder voorraadverplichtingen en monitoring, te inventariseren6. Deze informatie is echter verouderd en reflecteert niet meer de huidige situatie in Europa. Om deze reden ben ik zelf een inventarisatie gestart om het voorraad- en monitoringsbeleid van andere Europese landen in kaart te brengen. Hiervoor heb ik een survey uitgezet naar alle lidstaten en Noorwegen en vervolgens diepte-interviews gehouden met verschillende landen. Ik informeer u over de huidige tussenresultaten, een deel van deze informatie wordt echter nog aangevuld en (extra) gevalideerd.
Voorraadbeleid
In de huidige regelgeving geldt dat er reeds een verplichting is voor vergunninghouders om voldoende voorraad aan te houden en ook is er een meldplicht zodat verwachte leveringsonderbrekingen tijdig gemeld worden7. Groothandels moeten zorg dragen voor een zodanige voorraad dat zij snel kunnen voldoen aan de vraag8. De eerste beelden uit de survey laten zien dat er verschillende aanpakken zijn ten aanzien van de implementatie van voorraadverplichtingen in Europa. Ongeveer een derde van de respondenten geeft aan een vorm van gekwantificeerde voorraadverplichting te hebben. Het gaat hier om gekwantificeerde voorraadverplichtingen die zijn opgenomen in regelgeving of dwingende verplichtingen in tendercontracten rondom voorraden in landen waar sprake is van publieke, centrale inkoop. Enkele landen geven aan momenteel geen gekwantificeerde voorraadverplichting te hebben, maar dat de mogelijkheid hiervan wel verkend wordt. De resterende Europese landen geven aan dat zij geen gekwantificeerde voorraadverplichting hebben.
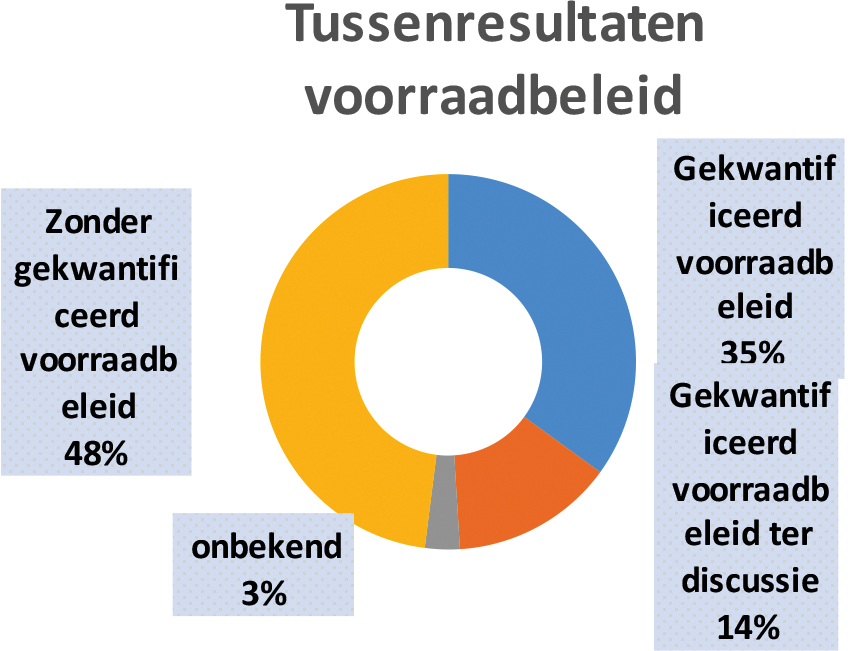
De manier waarop Europese landen de gekwantificeerde voorraadverplichting hebben ingevoerd verschilt sterk per land. Ten eerste is er verschil in de aangebrachte scope. Een deel van de landen heeft een (beperkte) voorraadverplichting voor alle geneesmiddelen op hun nationale markt en het andere deel werkt met een gedefinieerde lijst geneesmiddelen waarvoor deze verplichting geldt. Het gaat hier dan om een lijst met geneesmiddelen die kritisch(er) wordt geacht, de middelen op de lijst verschillen per land. Het gaat voornamelijk om receptplichtige geneesmiddelen, al zijn er ook landen die voor bepaalde geneesmiddelen die zonder recept verkrijgbaar zijn (bijvoorbeeld paracetamol) een voorraadverplichting hebben. Daarnaast is er verschil in de grootte van de voorraadverplichting, variërend van een verplichting van één week tot een verplichting van 10 maanden voor bepaalde kritische geneesmiddelen. Ten slotte varieert op welke partij de verplichting betrekking heeft. De voorraadverplichtingen liggen bij de apotheek, het ziekenhuis, de groothandel en/of vergunninghouder.
Monitoringsbeleid
De meeste Europese landen hebben een vorm van monitoringsbeleid met betrekking tot tekorten en voorraden. De precieze invulling van een monitoringsbeleid varieert sterk in de verschillende Europese landen.
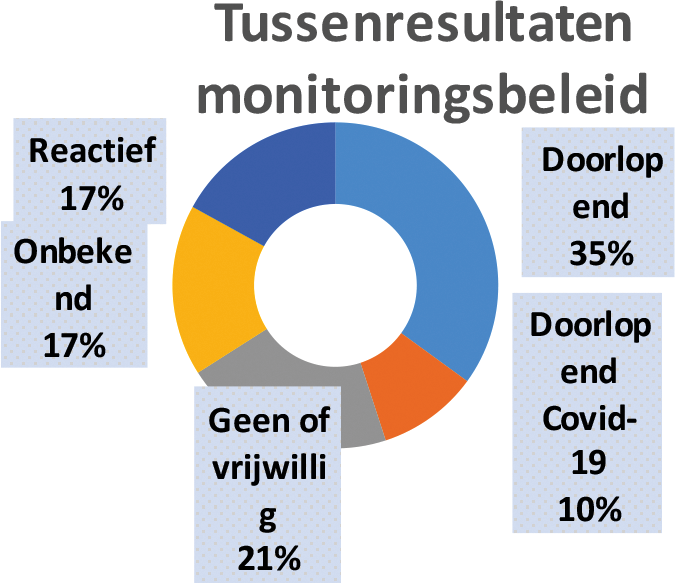
Er zijn landen die (net als Nederland) alleen inzicht opvragen in voorraadposities nadat er melding is gedaan van een (verwacht) leveringsprobleem en landen met een doorlopend monitoringsysteem. Ook hier monitoren sommige landen alleen de beschikbaarheid van een gedefinieerde lijst en andere landen alle geneesmiddelen. Er zijn ook enkele landen die dit (zoals Nederland met het Landelijk Coördinatiecentrum Geneesmiddelen) alleen gedurende de covid-19 crisis doen of hebben gedaan. Daarnaast is er verschil in welke voorraden worden gemonitord, de voorraden bij groothandels, vergunninghouders en/of ziekenhuizen. Ten slotte verschilt bij een doorlopend monitoringssysteem de frequentie waarmee de voorraden moeten worden doorgegeven, van dagelijkse rapporten tot een uitdraai per kwartaal.
De komende maanden rond ik de diepte-interviews en inventarisatie af. Ik bespreek de (tussen)resultaten ook met de relevante Nederlandse veldpartijen. Ik verwacht uw Kamer in de volgende voortgangsbrief na de zomer te informeren over de definitieve eindresultaten en conclusies. Ik houd er hierbij rekening mee dat de aanpak in landen niet één-op-één vergeleken kan worden, omdat er verschillen zijn in manier waarop de zorg in de verschillende landen is georganiseerd.
De beeldvorming uit dit onderzoek is een momentopname. Het is denkbaar dat landen hun beleid ten aanzien van voorraadverplichtingen en monitoring nog aanpassen. Zo hebben verschillende Europese landen al aangegeven dat er op dit moment discussies gaande zijn om beleidsopties te exploreren om (de gevolgen van) tekorten tegen te gaan. Ik volg deze ontwikkelingen nauwlettend.
Pilot voorraadopbouw
Naast het rekening houden met Europese ontwikkelingen rond voorraadverplichtingen heeft de Kamer ook zorgen geuit over toepasbaarheid van een ijzeren voorraad van vijf maanden voor alle geneesmiddelen. Eerder onderzoek heeft uitgewezen dat een voorraad van vijf maanden een groot deel van de tijdelijke leveringsonderbrekingen zou kunnen opvangen. Zo is in de motie van het lid Veldman gevraagd om maatwerk toe te passen bij de uitwerking van de ijzeren voorraad. Ook blijkt dat het voor veel uitwerkingskwesties lastig is om van te voren alle theoretische kaders te bepalen. Daarom hebben veldpartijen het initiatief genomen om te beginnen met een praktische pilot waar binnen een gecontroleerde omgeving ervaring opgedaan wordt met (verdere) voorraadopbouw. Ik juich dit constructieve initiatief van de zorgverzekeraars en koepelorganisaties voor biosimilars en generieke geneesmiddelenindustrie Nederland (Bogin) en Generieke Leveranciers Nederland (GLN) van harte toe en blijf nauw betrokken bij de voortgang en uitkomsten van deze pilot.
In januari zijn partijen begonnen met randvoorwaarden en kenmerken op te stellen om te zorgen dat er op verschillende aspecten ervaring kan worden opgedaan. Onder de scope van de pilot vallen generieke geneesmiddelen die onderdeel zijn van het inkoopbeleid van zorgverzekeraars. In overleg is een aantal middelen geselecteerd. Om optimaal te kunnen leren van de pilot zijn verschillende typen geneesmiddelen geselecteerd gebaseerd op de volgende aspecten: gebruik (acuut, chronisch of seizoensgebonden), de duur van productie en distributie, houdbaarheidstermijn van het geneesmiddel.
Gedurende de pilot streven de leveranciers een aanvullende voorraad van 2 maanden op te bouwen. Een verdergaande opbouw kent, mede door de looptijd van de pilot, (te) veel aanvullende uitdagingen. De pilot duurt tot de zomer, waarna een evaluatie volgt. De evaluatie van de pilot zal inzicht geven in het aanleggen en op peil houden van voorraad voor de verschillende typen middelen, en met welke (markt)omstandigheden leveranciers hier geconfronteerd worden. Ook beoogt de pilot inzicht te geven in omstandigheden rondom grotere voorraden en spillage. Partijen uiten ten slotte hun zorgen over de kosten van aanvullend voorraad, vooral bij de geneesmiddelen waar de marges nu al erg laag zijn. Tijdens de pilot geven partijen verschillende aspecten van kosten zoals opslag en administratieve kosten door aan een trusted third party (TTP), hierdoor zal de pilot ook inzicht verschaffen in de werkelijke kosten van aanvullend voorraadbeheer.
De praktijkervaring opgedaan met deze pilot zal ik, samen met de relevante Europese ontwikkelingen, meenemen in de verdere uitwerking van de ijzeren voorraad. Met het aanleggen van een ijzeren voorraad kunnen niet alle tekorten voorkomen worden, maar streven we ernaar meer weerbaarheid te creëren om tijdelijke tekorten beter te kunnen opvangen. Ik bekijk de uitwerking van de ijzeren voorraad in samenhang met de andere actielijnen om beschikbaarheid van geneesmiddelen te borgen, zoals het op Europees niveau aanpakken van de grondoorzaken van tekorten en de inzichten uit het eerder aangekondigde onderzoek naar de «onderkant van de geneesmiddelenmarkt». Hierbij ben ik mij bewust dat leveranciers opereren in een complexe internationale keten.
Vooruitblik
Zoals afgesproken, informeer ik uw Kamer halfjaarlijks over de voortgang van de ijzeren voorraad. Na de zomer stuur ik u een volgende voortgangsbrief met de eindresultaten van de Europese inventarisatie en de resultaten en conclusies van de pilot. Ook verwacht ik in september 2021 de resultaten van het onderzoek van de Europese Commissie naar tekorten en oplossingsrichtingen. De conclusies uit dit onderzoek zal ik ook met uw Kamer delen.
De Minister voor Medische Zorg, T. van Ark
Art. 81 en 123 van richtlijn 2001/83 vertaald in artikel 49 lid 7 en 9 van de Geneesmiddelenwet
Kopieer de link naar uw clipboard
https://zoek.officielebekendmakingen.nl/kst-29477-701.html
De hier aangeboden pdf-bestanden van het Staatsblad, Staatscourant, Tractatenblad, provinciaal blad, gemeenteblad, waterschapsblad en blad gemeenschappelijke regeling vormen de formele bekendmakingen in de zin van de Bekendmakingswet en de Rijkswet goedkeuring en bekendmaking verdragen voor zover ze na 1 juli 2009 zijn uitgegeven. Voor pdf-publicaties van vóór deze datum geldt dat alleen de in papieren vorm uitgegeven bladen formele status hebben; de hier aangeboden elektronische versies daarvan worden bij wijze van service aangeboden.
