Kamerstuk
| Datum publicatie | Organisatie | Vergaderjaar | Dossier- en ondernummer |
|---|---|---|---|
| Tweede Kamer der Staten-Generaal | 2021-2022 | 29477 nr. 758 |
Zoals vergunningen, bouwplannen en lokale regelgeving.
Adressen en contactpersonen van overheidsorganisaties.
U bent hier:

| Datum publicatie | Organisatie | Vergaderjaar | Dossier- en ondernummer |
|---|---|---|---|
| Tweede Kamer der Staten-Generaal | 2021-2022 | 29477 nr. 758 |
Aan de Voorzitter van de Tweede Kamer der Staten-Generaal
Den Haag, 2 juni 2022
Voor de Nederlandse farmaceutische zorg zet ik me in voor drie belangrijke kernwaarden, namelijk de a) kwaliteit van de geleverde zorg, b) toegankelijkheid van de zorg in termen van beschikbaarheid en financiële toegankelijkheid voor patiënten en c) betaalbaarheid van de zorg voor nu en in de toekomst. Mijn geneesmiddelenbeleid richt zich op deze drie waarden. Dat doe ik bijvoorbeeld door met maatregelen mij te richten op betaalbaarheid, zoals de modernisering van het GVS waarover ik uw Kamer recent heb geïnformeerd1. Met ander beleid richt ik mij meer op toegankelijkheid, zoals het veiligheidsvoorraadbeleid. Deze maatregelen hebben onderlinge samenhang. Ook is er sprake van effecten over en weer. Met een breed palet aan beleidsinterventies streef ik naar balans tussen kwaliteit, toegankelijkheid en betaalbaarheid ten behoeve van de Nederlandse burger.
Het is belangrijk dat de geneesmiddelen die patiënten nodig hebben, ook beschikbaar zijn bij de apotheek. Hoewel niet alle tekorten te voorkomen zijn, zet ik me samen met partijen uit het veld, zowel nationaal als Europees, in voor het versterken van de leveringszekerheid, het (deels daarmee) verminderen van tekorten en het beter ondervangen van tekorten om de gevolgen voor patiënten te verminderen. Hiernaast bekijk ik welke aanvullende maatregelen nodig zijn in voorbereiding op een volgende (gezondheids-)crisis om ook dan de beschikbaarheid van geneesmiddelen zo goed als mogelijk te borgen. Voor mijn inzet rondom beschikbaarheid in crisistijd verwijs ik u naar de beleidsbrief over pandemische paraatheid die uw Kamer onlangs heeft ontvangen.2
In deze brief informeer ik uw Kamer over een aantal ontwikkelingen omtrent de beschikbaarheid van geneesmiddelen en geef een beschrijving van de bijbehorende acties. De opbouw is als volgt:
1. Analyse van de meldingen van verwachte leveringsonderbrekingen.
2. De implementatie van de veiligheidsvoorraad.
3. Europese studie naar de oorzaken van geneesmiddelentekorten.
4. Onderzoek naar de «onderkant van de geneesmiddelenmarkt».3
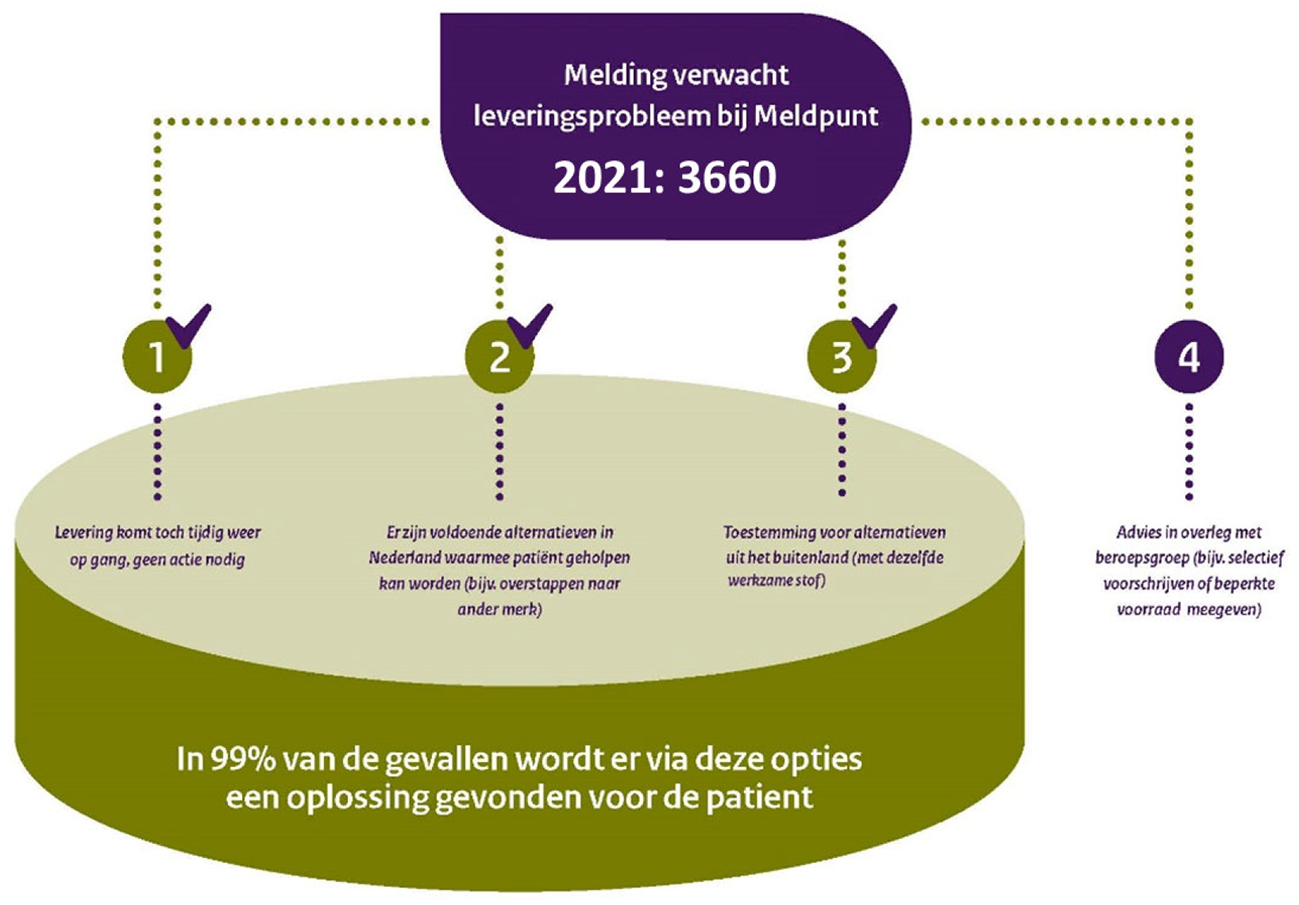
Handelsvergunninghouders zijn wettelijk verplicht om bij het Meldpunt een melding te doen van (verwachte) leveringsonderbrekingen en van producten die definitief uit de handel worden gehaald. Het Meldpunt publiceert ieder jaar een rapportage over het aantal ontvangen meldingen en tot welke acties dit heeft geleid. De jaarrapportage van 2021 vindt u in bijlage 1. Uit de jaarcijfers blijkt dat het aantal meldingen van verwachte leveringsonderbrekingen is gestabiliseerd (3.660 meldingen). Een melding betekent niet dat er ook daadwerkelijk een tekort aan het betreffende geneesmiddel ontstaat.
De laatste jaren melden handelsvergunninghouders steeds vaker zekerheidshalve ook een mogelijk leveringsprobleem; later blijkt er toch geen tekort te ontstaan. De cijfers van Farmanco geven een indicatie voor tekorten die zich daadwerkelijk op productniveau uiten bij de apotheker.4 Farmanco rapporteerde voor het jaar 2021 866 tijdelijke geneesmiddelentekorten. Dit is een daling van circa een derde ten opzichte van de voorgaande twee jaren.
Voor vrijwel alle leveringsproblemen (circa 99%) die worden gemeld bij het Meldpunt én de tekorten uit de cijfers van Farmanco zijn passende oplossingen voor de patiënt beschikbaar. Zo kan een patiënt overstappen op een ander merk of kan de overheid toestemming geven om tijdelijk soortgelijke (buitenlandse) geneesmiddelen in te zetten. Dit kan door het nemen van een tekortenbesluit5, het toestaan van een tijdelijk afwijkende verpakking of het registeren van een nieuw geneesmiddel. Het afgelopen jaar is het slechts twee keer voorgekomen dat er geen passende alternatieven waren voor patiënten, waarna de beroepsgroepen behandeladviezen hebben opgesteld over de inzet van de resterende schaarse voorraad (Visudyne en RoActemra/Kevzara).6 Alhoewel tekorten niet volledig te voorkomen zijn en het vinden van een oplossing soms veel vraagt van partijen in de keten, is het goed nieuws dat er door veldpartijen onderling, maar ook door in specifieke gevallen ingrijpen van de overheid, vrijwel altijd een passende oplossing wordt gevonden voor de patiënt. Tegelijkertijd realiseer ik mij dat dat soms veel vraagt van zorgverleners, waaronder apothekers.
Het Meldpunt rapporteert ook over meldingen van handelsvergunninghouders dat zij geneesmiddelen in Nederland uit de handel halen en geeft aan van hoeveel geneesmiddelen de Nederlandse handelsvergunningen zijn doorgehaald. Hier zien we een daling (-22%) ten opzichte van vorig jaar. In bijna alle gevallen bleven er alternatieven beschikbaar voor de patiënt. Indien dit naar verwachting wel directe problemen zal opleveren voor patiënten, werden de mogelijkheden onderzocht om het geneesmiddel voor de Nederlandse markt te behouden
• Samen met het veld wil ik kijken of we in de routekaart voor de afhandeling van geneesmiddelentekorten nog verder kunnen verduidelijken wat moet worden gemeld. Dit om ervoor te zorgen dat de inzet van het Meldpunt zoveel als mogelijk gericht kan zijn op de beoordeling van daadwerkelijk verwachte leveringsonderbrekingen om tijdig situaties te identificeren waarin monitoring of ingrijpen vanuit de overheid opportuun en effectief is.
• Omdat de meldplicht voortvloeit uit Europese regelgeving, zal ik ook in Europa vragen om meer handvatten voor het verder uitwerken van de meldplicht, met daarin ook een nadere uitwerking van de verplichting van veldpartijen en van de overheid. Hierbij probeer ik de administratieve lasten voor alle partijen tot het noodzakelijke te beperken.
• Ik wil nadere analyses uitvoeren over de geneesmiddelen die van de Nederlandse markt worden gehaald of waarvoor de inzet van een tekortenbesluit nodig was. Hierover informeer ik u nader in paragraaf 4.
In de Geneesmiddelenwet staat dat handelsvergunninghouders en groothandelaren wettelijk verplicht zijn om voldoende voorraad aan te houden om in de behoeften van patiënten te kunnen voorzien.
Al enkele jaren wordt gesproken over het verduidelijken van wat onder voldoende voorraad wordt verstaan, ook om een gelijker speelveld tussen partijen te creëren. Mijn voorganger heeft u 23 november 2021 geïnformeerd over de keuze om deze kwantificering te beperken tot zes weken voor handelsvergunninghouders en vier weken voor groothandelaren in plaats van de aanvankelijk voorgenomen vier maanden voor handelsvergunninghouders en één maand voor groothandelaren.7 Hiermee wordt beter aangesloten bij de huidige praktijk en hetgeen gangbaar is in andere Europese landen. Zo verkleinen we de kans op ongewenste neveneffecten.
Sinds die brief is gewerkt aan de verduidelijking van de regels in de aangekondigde beleidsregel. Ook zijn gesprekken gevoerd over de inzet van het beschikbaar gestelde budget van € 25 miljoen. Partijen hebben hier verschillende standpunten in. Ik merk dat de ingang van het veiligheidsvoorraadbeleid onrust bij sommige handelsvergunninghouders en groothandelaren veroorzaakt en helaas niet op volledig draagvlak van hen kan rekenen. Hierbij geven enkele partijen op voorhand al aan dat het aanhouden van de zes en vier weken voorraden (soms) ver afstaat van de huidige praktijk en, dat opbouw hiernaar toe richting 1 juli 2022 niet mogelijk zou zijn. Zij geven daarbij ook aan dat het opbouwen van voorraden in deze onzekere tijden uitdagend is. Ook is vooraf behoefte aan duidelijkheid over situaties waarin het (tijdelijk) niet mogelijk is voldoende voorraad aan te houden. Ten slotte geven bedrijven aan veel onzekerheid te hebben over of zij aanvullende kosten voor het ophogen van de voorraad kunnen verwerken in de prijzen vanwege de gekozen financieringssystematiek, mede vanwege de samenloop met stijgende inflatie en toenemende kosten door bijvoorbeeld stijgende grondstofprijzen.
Alhoewel ik begrip heb voor de nieuwe ontwikkelingen en de uitdagingen die deze ontwikkelingen met zich meebrengen, zie ik ook dat juist in deze onzekere tijden, waaronder bijvoorbeeld de oorlog in Oekraïne, voorraden een belangrijke rol spelen om mogelijke tijdelijke leveringsonderbrekingen te overbruggen. Ik ga door met de implementatie, maar doe dit wel binnen een aantal zorgvuldige randvoorwaarden, om zo bepaalde zorgen beter te kunnen ondervangen.
De beleidsregel is twee keer voorgelegd aan koepelorganisaties van partijen die voorraad moeten aanhouden (handelsvergunningshouders en groothandelaren). De reacties van de tweede ronde worden op dit moment verwerkt. Ik streef ernaar, rekening houdend met de input vanuit het veld, tot een werkbare en goed uitvoerbare beleidsregel te komen.
Ook over de financiering zijn uiteenlopende wensen vanuit het veld. Het is niet exact te voorspellen wat de verduidelijking van het voorraadbeleid betekent voor aanvullende kosten. Dit omdat het aanhouden van voldoende voorraad nu al een wettelijk verplichting is. Het is wisselend hoe bedrijven dit de afgelopen jaren hebben ingevuld en dus ook hoeveel extra voorraad er waar aangelegd moet worden. Met de huidige termijnen is juist ook geprobeerd aansluiting te zoeken bij wat haalbaar is. Daarnaast is het lastig om vanuit de overheid te bepalen wat de exacte kosten zijn voor voorraadbeheer. Uit de pilot die vorig jaar is gedaan kwamen wisselende beelden, de spreiding van kosten was erg groot. Gegeven de verwachte kostenverhogingen is eerder het Uitgaven Plafond Zorg (UPZ) met € 25 miljoen opgehoogd (€ 45 miljoen voor extra kosten minus € 20 miljoen aan destijds verwachte besparingen). Zo ontstaat meer ruimte om binnen de bestaande financieringssystematiek rekening te houden met eventuele aanvullende kostenstijgingen als gevolg van de voorraadverplichting.
Sommige partijen geven aan dat deze aanpak haaks lijkt te staan op de (toekomstige) inzet van de prijsinstrumenten van de overheid, zoals het Geneesmiddelenvergoedingssysteem (GVS) en de Wet geneesmiddelenprijzen (Wgp). Ze geven aan dat enerzijds met de verhoging van het UPZ meer financiële ruimte wordt geboden om aanvullende kosten te verwerken, maar dat anderzijds via deze instrumenten de mogelijkheden om prijzen te verhogen worden beperkt. Ik begrijp dat er samenhang is tussen enerzijds de inzet die ik pleeg rondom beschikbaarheid en anderzijds de inzet rondom betaalbaarheid. Ik bekijk deze onderwerpen in samenhang en heb daarbij ook aandacht voor de potentieel kwetsbare geneesmiddelen aan de «onderkant van de geneesmiddelenmarkt», dit licht ik nader toe in paragraaf 4.
Ik verwacht van partijen dat zij zelf ook zorgvuldig kijken naar de afspraken die onderling worden gemaakt over prijzen voor geneesmiddelen en daarmee de toegankelijkheid tot geneesmiddelen voor patiënten. Hierbij denk ik zowel aan de inkopende partijen (waaronder zorgverzekeraars en groothandelaren) en de redelijke voorwaarden die zij moeten stellen als aan de handelsvergunninghouders die zich moeten inschrijven voor een haalbare, redelijke prijs.
Door sommige veldpartijen is opgebracht dat de afspraken ten aanzien van resterende houdbaarheid (de bewaartermijn van de producten die op voorraad worden gehouden, die dus afneemt) en aflevertermijnen die door verschillende partijen in de keten worden aangehouden van invloed kunnen zijn bij een dreigend, tijdelijk tekort van producten. Deze partijen hebben aangegeven daar graag met elkaar over in gesprek te gaan. Mijn voorganger heeft opdracht gegeven aan een onafhankelijke procesbegeleider om deze gesprekken te faciliteren en te onderzoeken of partijen onderling tot een leidraad met afspraken over resterende houdbaarheid kunnen komen. Het traject is afgerond. Uit dit traject is gebleken dat het mogelijk was te komen tot enkele richtinggevende doch vrijblijvende werkafspraken over interventies in het geval een dreigend, tijdelijk tekort, waaronder het onderzoeken naar mogelijkheden de goedgekeurde houdbaarheid te verlengen, een passende uitgifte van geneesmiddelen aan de patiënt en het overlaten van afspraken over resterende houdbaarheid aan leveranciers, groothandelaren en apothekers. Partijen hebben de intentie uitgesproken om de inzet en werkbaarheid van de leidraad in de zomer van 2023 te evalueren. In het traject zijn ook andere aanbevelingen opgehaald rondom geneesmiddelentekorten die ik bestudeer en betrek in de eerdergenoemde evaluatie van de routekaart».
Ik heb partijen aangegeven dat ik tot een gebalanceerd pakket ben gekomen voor de voorraadverplichting.
• Ik werk op dit moment aan de definitieve versie van de beleidsregel waarin ik de laatste ronde aan vragen en suggesties van veldpartijen verwerk. Ik streef er naar de beleidsregel uiterlijk 1 juli 2022 te publiceren.
• De beleidsregel zal een jaar na ingangsdatum worden geëvalueerd, op basis van de ervaringen uit de praktijk, waarna deze waar nodig aangepast kan worden.
• Bij de evaluatie wil ik samen met veldpartijen stilstaan bij de ervaren (neven)effecten en de uitvoerbaarheid. We kunnen dan nagaan wat de effecten in de praktijk zijn en welke aanpassingen nodig zijn.
De langverwachte studie van de Europese Commissie naar de grondoorzaken van geneesmiddelentekorten in Europa en mogelijke oplossingsrichtingen is gepubliceerd. Mijn voorganger heeft uw Kamer december 2021 geïnformeerd dat de gepresenteerde data voor Nederland onjuistheden bevatte.8 Hierover is destijds contact gelegd met de Europese Commissie en het onderzoeksbureau. Hieruit bleek dat het onderzoeksbureau dataposten onterecht bij elkaar had opgeteld. Dit is inmiddels gecorrigeerd. Een nieuwe versie van de studie, met de gecorrigeerde data voor Nederland, is in januari jl. gepubliceerd op de website van de Europese Commissie.9
In deze brief zal ik op hoofdlijnen kort ingaan op de belangrijkste conclusies uit de studie, bijlage 2 bevat een uitgebreidere toelichting en appreciatie. De studie vergelijkt en combineert data van Europese landen op het gebied van meldingen van (mogelijke) tekorten en er worden analyses gedaan op deze cijfers om uitspraken te doen over welke producten kwetsbaar lijken voor tekorten. Hierna is op basis van de data bekeken wat de oorzaken waren van deze tekorten. Daarnaast wordt de huidige Europese regelgeving rondom tekorten geëvalueerd, waarbij er ook aandacht is voor de verschillende nationale regels die er naast de Europese regels zijn ingevoerd. Het laatste onderdeel van de studie gaat over mogelijke Europese oplossingsrichtingen.
Concluderend geeft de studie een aantal inzichten, alhoewel de aanknopingspunten voor specifiek beleid helaas beperkt zijn. Vanwege beperkingen in de data is het niet mogelijk om de situatie tussen lidstaten goed te vergelijken, uitspraken over waar tijdelijke tekorten en terugtrekkingen van de markt vaker voorkomen kunnen daarmee niet gedaan worden. Wel trekt het rapport de voorzichtige conclusie dat het aantal tekorten in de afgelopen tien jaar binnen Europa is toegenomen. Alhoewel er verschillende analyses zijn gedaan, is het niet mogelijk om te bepalen welke geneesmiddelen significant kwetsbaarder zijn voor tekorten en dus mogelijk om meer, of andere, (beleids)inzet vragen. Ook de impact van tekorten was niet met de beschikbare data vast te stellen, alhoewel het beeld dat er voor de meeste tekorten een alternatief is voor de patiënt ook in deze studie bevestigd wordt.
De studie toont aan dat het ontstaan van geneesmiddelentekorten multifactorieel is en beïnvloed wordt door zowel de internationale dynamiek (bijvoorbeeld bij productieproblemen) als de nationale dynamiek (bijvoorbeeld een sterke toename van vraag). Er is daarmee geen gemakkelijke oplossing en het aanpakken van tekorten vraagt om inzet van een breed speelveld aan partijen. De studie toont duidelijk aan dat lidstaten inmiddels, in aanvulling op de reeds bestaande Europese wettelijke verplichtingen10, een breed scala aan nationale maatregelen hebben geïntroduceerd. Denk hierbij aan concrete nationale voorraadverplichtingen, restricties voor parallelhandel of het publiceren van data over tekorten. Een verscheidenheid aan strengere en mindere strenge regels zet de solidariteit tussen de lidstaten onder druk omdat bedrijven bij schaarse voorraad mogelijk voorkeur geven aan het uitleveren van specifieke landen boven anderen.
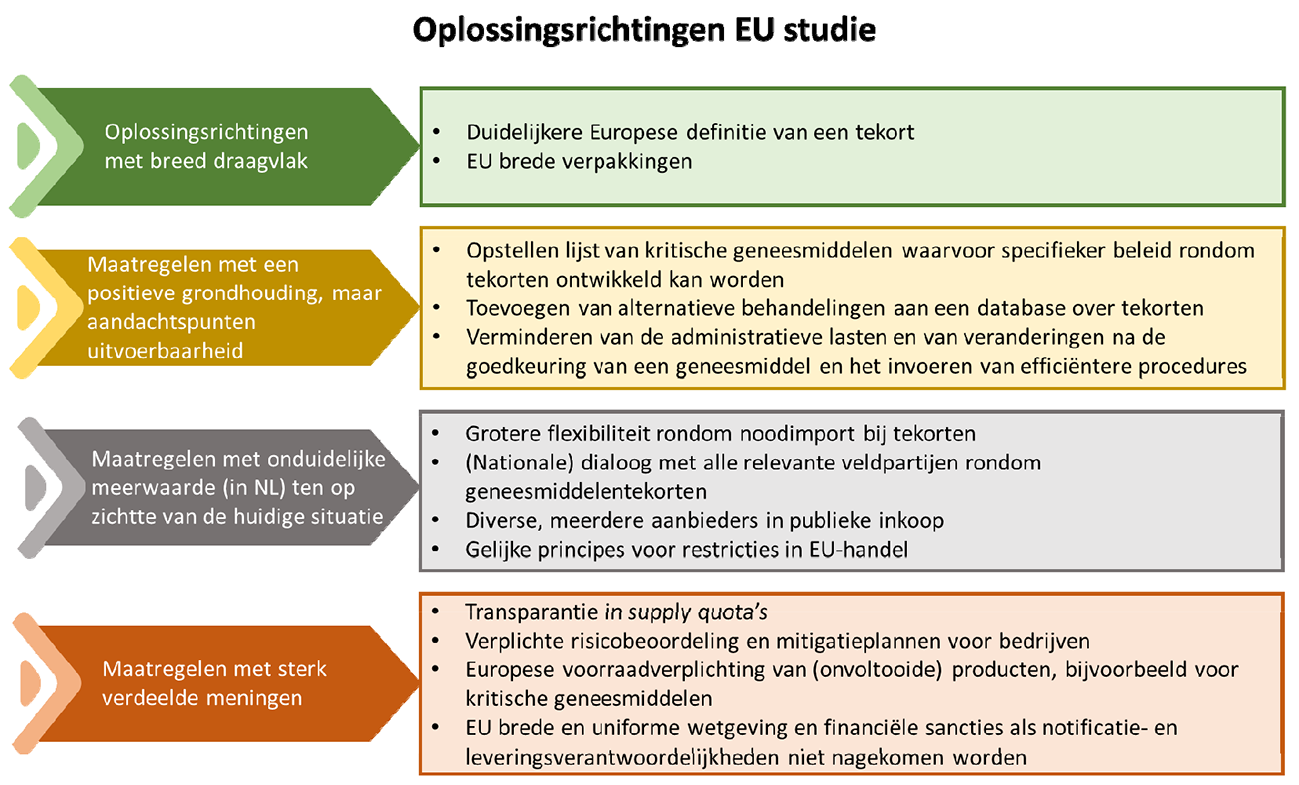
Ten slotte eindigt het rapport met zestien mogelijke Europese oplossingsrichtingen. Ik heb de oplossingsrichtingen ook besproken met het veld. Het is belangrijk dat de oplossingsrichtingen nader uitgewerkt worden en getoetst worden op effectiviteit, uitvoerbaarheid en proportionaliteit. Ik zie, mede na de besprekingen met het veld, een onderscheid tussen oplossingsrichtingen met een breed draagvlak, oplossingsrichtingen waarbij een algemene positieve grondhouding is maar zorgen bestaan over de uitvoerbaarheid, oplossingsrichtingen waarbij onduidelijk is wat de meerwaarde is ten op zichtte van de huidige situatie en oplossingsrichtingen met een wisselend draagvlak waarvan ik in ieder geval de specifieke kanttekeningen nader wil bespreken met andere lidstaten.
De verwachting is dat de Europese Commissie, onder andere op basis van deze studie, eind 2022 met concrete wetsvoorstellen zal komen in het kader van de herziening van de EU basiswetgeving geneesmiddelen (zie hiervoor ook mijn reactie op de openbare raadpleging voor deze herziening, zoals gedeeld met uw Kamer).11 De Europese Commissie zal daartoe eerst een impact assessment afronden, waarna er naar verwachting meer informatie beschikbaar komt over de verwachte effectiviteit, uitvoerbaarheid en proportionaliteit van mogelijke oplossingen voor tekorten. Lidstaten hebben in verschillende Europese overleggremia de intentie uitgesproken om verder te spreken over de interpretatie van de studiebevindingen en de voorgestelde oplossingsrichtingen, onder andere door het uitwisselen van reeds bestaande nationale best practices. Geneesmiddelentekorten worden in een breed scala aan overleggen op Europees niveau besproken, waaronder het Pharmaceutical Committee, de SPOC working party, de Joint Action on shortages en de HMA/EMA Task Force on availability of authorised medicines for human and veterinary use.
• Ik stel me actief op in de Europese gesprekken en neem daarin mijn voorlopige conclusies mee zoals weergegeven in deze brief.
• Op basis van de verdieping met de lidstaten en mogelijk aanvullende informatie vanuit de Europese Commissie zal ik mijn definitieve inzet voor de herziening van de EU-basiswetgeving geneesmiddelen bepalen. Nadat de wetsvoorstellen van de Europese Commissie zijn gepubliceerd, ontvangt uw Kamer een appreciatie hierop.
Mijn voorganger heeft u geïnformeerd over het onderzoek dat Berenschot vorig jaar heeft uitgevoerd naar de onderkant van de geneesmiddelenmarkt. Dit onderzoek is uitgezet om ten eerste meer inzicht te krijgen in wat verstaan wordt onder «de onderkant van de geneesmiddelenmarkt». Ten tweede beoogde het onderzoek inzicht te verkrijgen in hoe beleid vanuit overheid en verzekeraars en/of gedrag/keuzes van handelsvergunninghouders, groothandelaren en apotheken (gezamenlijk) invloed hebben op de beschikbaarheid van geneesmiddelen aan de onderkant van de geneesmiddelenmarkt. Een beter beeld krijgen van dit deel van de geneesmiddelenmarkt is van belang, omdat (nieuw) overheidsbeleid en keuzes van het veld invloed kunnen hebben op de mate van beschikbaarheid van geneesmiddelen voor patiënten. Eind vorig jaar heeft Berenschot het onderzoek afgerond, het rapport is destijds met uw Kamer gedeeld12. In de afgelopen maanden heb ik het rapport met verschillende veldpartijen besproken. In deze paragraaf zal ik kort ingaan op de hoofdbevindingen uit het rapport en de vervolgstappen.
Om de (economisch) kwetsbare geneesmiddelen aan de «onderkant van geneesmiddelenmarkt» te identificeren, gebruiken de onderzoekers primair de variabelen «omzet» en «aantal aanbieders». De hypothese in dit onderzoek was dat er een samenhang is tussen omzet en kwetsbaarheid. Uit interviews bleek dat veldpartijen, vanuit zowel aanbieders als experts, aangaven dat bij drie of minder aanbieders een markt kwetsbaar wordt. Berenschot onderscheidt op basis van de variabelen in het rapport vier segmenten in de geneesmiddelenmarkt: kleine nicheproducten, kleine nicheproducten met veel aanbieders, generieke hardlopers en dure geneesmiddelen13. De segmentering is gemaakt op basis van omzet op GVS-cluster en ATC-5 niveau in combinatie met het aantal aanbieders. Berenschot identificeert twee kwetsbare segmenten: de kleine nicheproducten met (relatief) lage omzet en weinig aanbieders en de kleine nicheproducten met veel aanbieders met (relatief) lage omzet. Tegelijkertijd geeft Berenschot aan dat er ook in de andere segmenten kwetsbare producten kunnen zitten (bijvoorbeeld door lage marges).
Uit het onderzoek en ook in de gesprekken met veldpartijen werd duidelijk dat het om een zeer complexe markt gaat waarvan niet alle informatie beschikbaar is.
Dit zorgt voor beperkingen in het onderzoek. Het rapport beantwoordt mede daardoor niet alle vooraf gestelde vragen, met name als het gaat om het effect dat overheidsinstrumenten en -beleid en gedrag van marktpartijen gezamenlijk hebben op het mogelijk kwetsbaar zijn of worden van deze geneesmiddelen. Dit laatste is belangrijk omdat beschikbaarheid van geneesmiddelen een verantwoordelijkheid van alle partijen gezamenlijk is.
Mede naar aanleiding van de bevindingen uit het onderzoek werk ik aan de volgende acties.
• Prijsinstrumenten overheid. Aangezien de prijsinstrumenten van de overheid mogelijk ook een rol spelen in de beschikbaarheid van kwetsbare geneesmiddelen, zijn eerder door VWS uit voorzorg de maximumprijzen als gevolg van de Wet geneesmiddelenprijzen tijdelijk «gemitigeerd». Hiermee behouden producten met een omzet van minder dan € 1 miljoen per jaar in Nederland een hogere maximumprijs. Ik verwacht uw Kamer voor de zomer te informeren over de voortzetting dan wel de aanpassing van de bestaande tijdelijke mitigerende maatregel. Bovendien onderzoek ik de noodzaak en mogelijkheid van een verzachtende maatregel bij de GVS-modernisering gericht op het beschermen van (potentieel) kwetsbare geneesmiddelen. Ik informeer uw Kamer voor de zomer over de verdere invulling van de GVS-modernisering. Daarin ga ik, zo goed als dan mogelijk, ook verder in op de voorzorgsmaatregel binnen het GVS voor de (economisch) kwetsbare geneesmiddelen.
• Instrumenten veldpartijen. Het zijn zoals gezegd niet alleen overheidsinstrumenten die invloed hebben op dit kwetsbare deel van de markt. Druk op prijzen wordt ook veroorzaakt door de rol en het gedrag van onder andere zorgverzekeraars, groothandels, apothekers en leveranciers. Ik wil dit rapport ook gebruiken om verder in gesprek te gaan met deze partijen over de wijze waarin zij hun rol kunnen pakken in het voorkomen van het kwetsbaar zijn, of worden, van bepaalde geneesmiddelen.
• Nadere analyses kwetsbare geneesmiddelen. Om meer kennis op te doen met betrekking tot het kwetsbare deel van de geneesmiddelenmarkt ga ik nadere analyses (laten) doen naar intrekkingen van handelsvergunningen van de Nederlandse markt en de tekortenbesluiten van de IGJ in de afgelopen jaren. Onderzoek naar de karakteristieken van deze geneesmiddelen geeft mogelijk beter inzicht in waarom dergelijke middelen (tijdelijk of langdurig) niet beschikbaar zijn en daarmee in de potentiële oorzaken van specifieke kwetsbaarheden in de geneesmiddelenmarkt.
• Evaluatie boetestructuur. Ten slotte zal ik de boetestructuur vanuit de rijksoverheid voor wat betreft de artikelen die gerelateerd zijn aan tekorten (overtreding van de meldplicht en de voorraadverplichting), mede in relatie tot de boetestructuur vanuit verzekeraars, evalueren.
Tot slot
Met deze brief heb ik uw Kamer op een aantal punten geïnformeerd over de stand van zaken rondom de beschikbaarheid van geneesmiddelen en de inzet die ik in dit kader pleeg op verschillende onderdelen. Na de zomer zal ik uw Kamer een volgende voortgangsbrief sturen. Hierbij zal ik in ieder geval ingaan op de voortgang binnen de Werkgroep Geneesmiddelentekorten, het veiligheidsvoorraadbeleid, de stand van zaken rondom de beschreven acties in relatie tot de (economisch) kwetsbare geneesmiddelen en de Europese ontwikkelingen. Ook wordt u na de zomer geïnformeerd over de twee lopende onderzoeken naar de kwetsbaarheden in de productie- en distributieketens, en naar welke instrumenten er zijn om (duurzame) productie dicht bij huis te stimuleren en in welke situaties dit wenselijk is. Mocht er in de tussentijd aanleiding zijn om u eerder te informeren over specifieke ontwikkelingen zal ik dat doen.
De Minister van Volksgezondheid, Welzijn en Sport, E.J. Kuipers
Tekortenbesluit: De inspectie heeft de mogelijkheid om in het kader van een tijdelijk geneesmiddelentekort toestemming te geven aan fabrikanten, groothandelaren of apotheekhoudenden om een vergelijkbaar geneesmiddel uit het buitenland te betrekken (nader uitgewerkt in artikel 3.17a van de Regeling Geneesmiddelenwet)
Te raadplegen via: Future-proofing pharmaceutical legislation – Publications Office of the EU (europa.eu)
De wettelijke verplichtingen om tekorten tijdig te melden en voldoende voorraad aan te houden hebben een Europese oorsprong en zijn in Nederland geïmplementeerd in de Geneesmiddelenwet.
Kamerstuk 29 477, nr. 741. Er is in januari door Berenschot een nieuwe versie van het rapport gepubliceerd: op een paar punten is de opmaak verbeterd. Zie bijgevoegd de meest recente versie.
Nicheproducten: bestaat uit GVS-clusters en ATC5-groepen met drie of minder aanbieders (generiek/spécialité) in de laagste twee omzetkwartielen.
Nicheproducten met veel aanbieders: bestaat uit GVS-clusters en ATC5-groepen in de laagste twee omzetkwartielen maar met vier of meer aanbieders per cluster of groep.
Generieke hardlopers: bestaat uit GVS-clusters en ATC5-groepen in de twee hoogste omzetkwartielen met vier of meer aanbieders per cluster of groep
Kostbare middelen: uit GVS-clusters en ATC5-groepen in de hoogste twee omzetkwartielen en met drie of minder aanbieders per cluster of groep
Kopieer de link naar uw clipboard
https://zoek.officielebekendmakingen.nl/kst-29477-758.html
De hier aangeboden pdf-bestanden van het Staatsblad, Staatscourant, Tractatenblad, provinciaal blad, gemeenteblad, waterschapsblad en blad gemeenschappelijke regeling vormen de formele bekendmakingen in de zin van de Bekendmakingswet en de Rijkswet goedkeuring en bekendmaking verdragen voor zover ze na 1 juli 2009 zijn uitgegeven. Voor pdf-publicaties van vóór deze datum geldt dat alleen de in papieren vorm uitgegeven bladen formele status hebben; de hier aangeboden elektronische versies daarvan worden bij wijze van service aangeboden.
