Kamerstuk
| Datum publicatie | Organisatie | Vergaderjaar | Dossier- en ondernummer |
|---|---|---|---|
| Tweede Kamer der Staten-Generaal | 2021-2022 | 29477 nr. 735 |
Zoals vergunningen, bouwplannen en lokale regelgeving.
Adressen en contactpersonen van overheidsorganisaties.
U bent hier:

| Datum publicatie | Organisatie | Vergaderjaar | Dossier- en ondernummer |
|---|---|---|---|
| Tweede Kamer der Staten-Generaal | 2021-2022 | 29477 nr. 735 |
Aan de Voorzitter van de Tweede Kamer der Staten-Generaal
Den Haag, 23 november 2021
Met deze brief doe ik u de halfjaarlijkse voortgangsbrief voorraadbeleid voor geneesmiddelen toekomen. Het kwantificeren van de voorraadverplichting is een van de nationale actielijnen om de beschikbaarheid van geneesmiddelen beter te borgen. Hiermee streeft het kabinet ernaar dat leveringsonderbrekingen beter ondervangen worden, met minder gevolgen voor de patiënt.
Allereerst merk ik op dat de term ijzeren voorraad verwarring met zich mee brengt. Deze wekt, ook in het veld, de indruk dat het een statische voorraad is die los staat van de reeds bestaande voorraadverplichting en voorraden. Ik spreek daarom liever van een minimale veiligheidsvoorraad die door partijen aangehouden moet worden. In deze en toekomstige brieven zal ik deze term aanhouden.
Op dit moment zijn handelsvergunninghouders en groothandelaren wettelijk verplicht om voldoende voorraad aan te houden. Dit zijn open geformuleerde verplichtingen en de invulling van deze verplichtingen verschilt dan ook sterk tussen de bedrijven. De plannen om de reeds bestaande voorraadverplichting te kwantificeren werden al voor de COVID-19 crisis besproken. Door het kwantificeren van de huidige wettelijke verplichting wordt een gelijker speelveld gecreëerd in Nederland en wordt de just-in-time levering gedeeltelijk teruggedrongen. Hierdoor is er meer ruimte om te reageren op onvoorspelbaarheden eerder in de productie- en distributieketen van een geneesmiddel.
In 2019 heeft voormalig Minister voor Medische Zorg en Sport (MZS) Bruins besloten dat er een voorraad moest komen van vijf maanden voor alle geneesmiddelen1. In juli 2020 is de implementatiefase gestart, de voorraad zou 1 juli 2022 gereed moeten zijn. Het afgelopen jaar is op verschillende manieren, zowel binnen Nederland als in EU verband, veel aanvullende kennis opgedaan. Bijvoorbeeld door de ervaringen met voorraadopbouw van Corona gerelateerde (IC-)geneesmiddelen tijdens de coronacrisis (de zogeheten Corona Crisis Voorraad of CCV), gesprekken met andere landen over hun aanpak met betrekking tot voorraadbeleid, de eerste studieresultaten van de Europese Commissie over de grondoorzaken van tekorten, inzicht in de impact van nationale voorraadverplichtingen op de beschikbaarheden in andere landen en de Nederlandse pilot waar in een gecontroleerde omgeving een hogere voorraad van een aantal geneesmiddelen werd opgebouwd. Deze ervaringen hebben nogmaals onderstreept dat de geneesmiddelenketen, en het ontstaan van beschikbaarheidsproblemen, complex is.
Uw Kamer en veldpartijen hebben de uitwerking van het voorraadbeleid nauw gevolgd. Naast draagvlak voor het plan zijn er ook zorgen over de neveneffecten. Uw Kamer heeft in oktober 2020 een motie van het lid Veldman (VVD)2 aangenomen om bij de uitwerking van de ijzeren voorraad maatwerk toe te passen en aan te sluiten bij de aanpak in andere Europese landen. Ook riepen verschillende veldpartijen zoals handelsvergunninghouders, zorgverzekeraars en apothekers op om meer aansluiting te zoeken bij Europa, sommige zelfs om te wachten op de verwachte wetgevende Europese voorstellen over voorraadbeleid. Dit omdat strengere eisen vanuit Nederland een risico kunnen zijn voor de beschikbaarheid van kwetsbare producten en verschraling van het totale aanbod van geneesmiddelen in Nederland. Vergunninghouders zouden ertoe kunnen besluiten om (bepaalde) producten niet meer aan te bieden op de Nederlandse markt, bijvoorbeeld omdat dit niet meer rendabel zou zijn. In lijn met de motie Veldman is een Europese inventarisatie uitgevoerd om meer zicht te krijgen in de aanpak in andere landen. Daarnaast hebben partijen een pilot uitgevoerd om ervaring op te doen met de verdere opbouw van voorraad. Ten slotte is de voormalig Minister voor MZS Van Ark, in het licht van de zorgen van uw Kamer en het veld, een onderzoek gestart naar de mogelijk kwetsbare producten aan de «onderkant van de geneesmiddelenmarkt».3
De ervaringen en nieuwe ontwikkelingen in het afgelopen jaar hebben er toe geleid dat ik mij genoodzaakt zie om de reikwijdte van de eerder voorgenomen veiligheidsvoorraad te herzien. Ik heb daarbij gezocht naar een balans tussen enerzijds het op korte termijn realiseren van resultaten voor de Nederlandse patiënt en anderzijds het zoveel als mogelijk aansluiten bij de aanpak in Europa en het (daarmee) voorkomen van ongewenste negatieve neveneffecten op de beschikbaarheid van geneesmiddelen in Nederland en spillage.
Samengevat heb ik hierbij rekening gehouden met de bevindingen dat het aanvankelijke Nederlandse voorstel van vijf maanden sterk afwijkt van de aanpak in andere landen, dat de Europese Commissie zich kritisch heeft uitgesproken over te omvangrijke nationale voorraadverplichtingen wegens effecten op de beschikbaarheid in andere landen en het feit dat, sneller dan aanvankelijk verwacht, door de COVID-19 crisis concrete stappen worden gezet om te komen tot Europese oplossingsrichtingen waaronder mogelijk Europees voorraadbeleid.
Doordat een voorraadverplichting van vijf maanden sterk afwijkt van de aanpak in andere landen, is er een risico op verschraling van aanbod. Dit kan nadelige effecten hebben op de bredere beschikbaarheid van geneesmiddelen in Nederland. Ook heb ik de signalen over een verwachte toename van verspilling meegewogen.
Ondanks dat er ontwikkelingen zijn op Europees niveau, zie ik ook dat de uitkomsten nog onzeker zijn en het nog enkele jaren kan duren voordat de wetsvoorstellen alle formele trajecten hebben doorlopen en in werking treden. Ik wil, net als in andere landen, daarom wel alvast ook in Nederland een stap zetten richting stevigere voorraden en een gelijker speelveld.

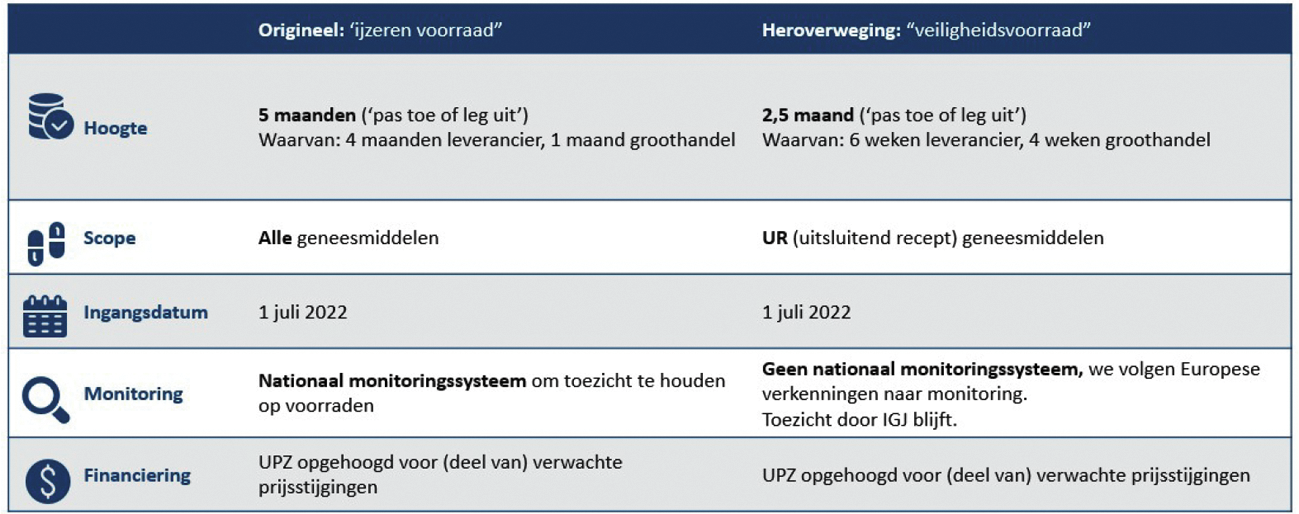
Ik heb besloten om het oorspronkelijke voorstel van vijf maanden voor alle geneesmiddelen te verlagen naar tweeënhalve maand, met een verplichting van zes weken bij de handelsvergunningshouders en vier weken bij de groothandelaren. Deze nadere duiding geldt, in tegenstelling tot het oorspronkelijke voorstel, alleen voor alle receptplichtige geneesmiddelen (UR). Deze termijnen worden opgenomen in een beleidsregel, ee beleidsregel zal nog steeds in werking treden op 1 juli 2022. Dit acht ik voor de meeste geneesmiddelen haalbaar gezien de lagere omvang en de resterende periode. De Inspectie Gezondheidszorg en Jeugd (hierna: de IGJ) zal voor de handhaving van de in de beleidsregel vastgestelde omvang een overgangstermijn hanteren van zes maanden. Voor deze verplichting geldt nog steeds het «pas toe of leg uit» beginsel. De handelsvergunninghouders en groothandelaren zijn verantwoordelijk voor een verantwoorde onderbouwing van de keuzes voor de aangehouden voorraad. De oordeelvorming in het specifieke geval valt onder de toezichtstaak van de IGJ. De randvoorwaarden worden nader toegelicht in de beleidsregel. Hierover wordt het veld binnenkort geconsulteerd.
Voor de financiering van de veiligheidsvoorraad is eerder het Uitgavenplafond Zorg (UPZ) opgehoogd met € 25 miljoen per jaar, uitgaande van een voorraadverplichting van vijf maanden. Dit was gebaseerd op berekeningen van de kosten en mogelijke besparingen in een onderzoek uit 2019.4 Tijdens de pilot hebben partijen gegevens overlegd over de gemaakte kosten van de aanvullende voorraad. Hieruit bleken hogere kosten dan uit het eerder genoemde rapport. Omdat enerzijds de kosten lager worden door een lagere voorraadverplichting, maar anderzijds de kosten mogelijk hoger liggen dan eerder ingeschat, ga ik niet nu (n.a.v. de lagere voorraadverplichting) over tot het verlagen van de beschikbare budgettaire reeks. Wel zal ik de definitieve uitkomsten van de pilot nader bestuderen en de praktijkervaringen volgen, om zodoende ook op financieel gebied de goede keuze te kunnen maken.
In afwachting van de uitkomsten van het onderzoek naar de «onderkant van de geneesmiddelenmarkt» en daarmee meer inzicht in mogelijke kwetsbare geneesmiddelen, verleng ik daarnaast de tijdelijke mitigerende maatregel binnen de Wet geneesmiddelenprijzen (Wgp) voor de herijking van april 2022. Met deze tijdelijke maatregel wordt op verzoek voor producten met een relatief lage omzet (< € 1 miljoen in Nederland per jaar) tijdelijk geen daling van de maximumprijs doorgevoerd.
Verdergaande nationaal voorraadbeleid voor ketenpartijen vind ik wegens de eerdergenoemde redenen, niet proportioneel. Een uitzondering hierop is de tijdelijke Corona Crisis Voorraad (CCV), waar voor een beperkte lijst met corona gerelateerde (IC-)geneesmiddelen ruime voorraden aangehouden worden door ziekenhuizen om mogelijk piekverbruik op te kunnen vangen. Ik wil eerst in Europees verband bekijken of we tot een geharmoniseerde aanpak kunnen komen en werken aan bredere maatregelen waarmee de (grond)oorzaken van toenemende leveringsonderbrekingen ook geadresseerd kunnen worden. De genomen maatregel voorraadbeleid wordt twee jaar na ingang geëvalueerd. Ik bekijk dan waar aanscherping mogelijk en nodig is. Hierbij houd ik rekening met hetgeen dan inmiddels op Europees niveau is bereikt.
Met deze heroverwegingen is de aanpak beter in lijn met de aanpak in andere Europese landen en verklein ik de kans op negatieve neveneffecten zoals verschraling van aanbod, verminderde beschikbaarheid in andere landen en verspilling. Hiermee kom ik ook beter tegemoet aan de wensen en zorgen van uw Kamer en de veldpartijen. Ik zie echter ook dat sommige partijen kritisch blijven op de verplichting. Ik acht de huidige aanpak echter proportioneel en ik verwacht dat alle partijen hun verantwoordelijkheid nemen om deze redelijke voorraadtermijnen te realiseren en na te streven. Tegelijkertijd bespreek ik graag met veldpartijen welke uitdagingen zij tegen komen en hoe we de regels in de toekomst verder kunnen verduidelijken. Alhoewel we met de voorraadverplichting niet alle tekorten kunnen oplossen, zetten we op deze manier gezamenlijk weer een stap vooruit in het beter borgen van de beschikbaarheid van geneesmiddelen voor de patiënten in Nederland.
In de onderstaande passages informeer ik u in meer detail over deze keuzes, de ervaringen die zijn opgedaan en de relevante actualiteiten die hebben bijgedragen aan de beschreven heroverweging. Ik ga daarbij in op de eindresultaten van de Europese inventarisatie, de belangrijke bevindingen uit de nationale pilot voorraadopbouw, de studie van de Europese Commissie naar de grondoorzaken van tekorten en relevante uitvoeringsvraagstukken.
Eind 2020 is voormalig Minister voor MZS van Ark een inventarisatie gestart om het voorraad- en monitoringsbeleid van andere Europese landen in kaart te brengen. Beter inzicht krijgen in de aanpak in andere Europese landen en het zoveel als mogelijk daarbij aansluiten waren wensen van zowel uw Kamer als de veldpartijen. In het laatste kwartaal van 2020 is een vragenlijst uitgezet naar alle EU-lidstaten en Noorwegen. Vervolgens zijn diepte-interviews gehouden met landen die aangaven al een veiligheidsvoorraadverplichting te hebben. Ook zijn de resultaten besproken en bediscussieerd in het SPOC-netwerk5, waarin landen samenwerken aan geneesmiddelentekorten. Dit alles heeft waardevolle inzichten opgeleverd over de mogelijkheden die er zijn en de ervaringen in andere landen.
Het is belangrijk te vermelden dat de resultaten een momentopname zijn van de situatie ten tijde van de vragenlijst (november 2020-juli 2021). De aanpak van geneesmiddelentekorten en specifiek voorraadverplichtingen zijn actuele thema’s die in verschillende landen actief ter discussie staan. Ook is de aanpak tussen landen niet een-op-een te vergelijken, omdat landen verschillen in onder andere de wijze waarop het zorgsysteem is ingericht en in hun inkoop- en prijsbeleid.
In de huidige (Europese) regelgeving voor geneesmiddelen geldt dat er reeds een verplichting is voor handelsvergunninghouders en groothandels om voldoende voorraad aan te houden en ook is er voor handelsvergunninghouders een meldplicht zodat verwachte leveringsonderbrekingen tijdig gemeld worden6. Met de inventarisatie is bekeken welke landen naast deze algemene verplichtingen ook een gekwantificeerde voorraadverplichting hebben ingevoerd. Hierbij zijn tijdelijke crisisverplichtingen met betrekking tot COVID-19 buiten beschouwing gelaten.
De inventarisatie laat zien dat het beleid omtrent voorraden sterk verschilt tussen Europese landen. In totaal hebben 27 respondenten de vragenlijst beantwoord. Ongeveer een derde van de respondenten gaf aan een vorm van gekwantificeerde voorraadverplichting te hebben. In acht landen in de vorm van een wettelijke verplichting, bij twee landen is het onderdeel van hun centrale inkoop. Een enkeling (10%) gaf aan dat gekwantificeerd voorraadbeleid officieel op de agenda staat. Ongeveer de helft van de landen gaf aan dat zij op dit moment geen gekwantificeerde voorraadverplichting hebben. De landen met een wettelijk gekwantificeerde voorraadverplichting hebben deze verschillend ingericht qua selectie van geneesmiddelen waarvoor de verplichting geldt, de omvang van de verplichting en de verantwoordelijke partij voor de voorraden (handelsvergunninghouders, groothandelaren en/of apotheken), zie Figuur 1. Globaal laat de Europese inventarisatie drie modellen zien welke ik hierna nader toelicht.
– Model 1: Een algemene gekwantificeerde verplichting voor alle (receptplichtige) geneesmiddelen
– Model 2: Een gekwantificeerde voorraadverplichting voor alleen een specifieke lijst geneesmiddelen die als kritisch en/of kwetsbaar worden gezien.
– Model 3: Een combinatie model waarbij een algemene verplichting geldt voor alle geneesmiddelen en een hogere verplichting voor een specifieke lijst (kritische of kwetsbare) geneesmiddelen.
Model 1, de algemene verplichting voor alle geneesmiddelen, is het meest gangbaar. De omvang van de verplichting is doorgaans minder groot dan die van de andere modellen, variërend tussen de één en drie maanden. Geen enkel Europees land heeft een wettelijke verplichting van vijf maanden voor alle geneesmiddelen, zoals in Nederland oorspronkelijk het plan was. Bij dit model zie ik dat er doorgaans geen aparte financieringsconstructie is voor de voorraden. Het aanhouden van een dergelijke (veiligheids)voorraad wordt gezien als verantwoordelijkheid van de partijen zelf en de kosten ervan moeten verwerkt worden in de prijs.
Een aantal landen heeft een gekwantificeerde voorraadverplichting voor alleen een specifieke lijst met geneesmiddelen (model 2). Het gaat daarbij om kritische en/of kwetsbare producten. Een vergelijking van de producten die op deze lijsten staan in de verschillende landen (Finland, Noorwegen en Zwitserland7) laat zien dat er grote verschillen tussen deze lijsten zijn. De criteria waarop wordt bepaald of een geneesmiddel op de lijst hoort verschilt en daarnaast verschilt ook de invulling van de criteria. Ook is er veel variatie in de grootte van de lijst (van 15 tot~200 producten). Er zijn weinig algemene conclusies te trekken over de keuzes die hierin zijn gemaakt. Slechts 1 product (adrenaline) is aanwezig op alle lijsten. Bij dit model zie ik dat de verplichtingen hoger zijn dan in het model 1, maar nog steeds sterk uiteenlopen van twee tot tien maanden. Tegelijkertijd zie ik bij dit model, waarschijnlijk mede doordat de hogere verplichting meer is dan wat gezien kan worden als een reguliere verantwoordelijkheid, er aparte financieringsconstructies zijn waarmee de overheden c.q. de inkopende partijen direct meebetalen aan (een deel van) de kosten en risico’s van de voorraden.
Ten slotte heeft Frankrijk afgelopen jaar een combinatiemodel geïntroduceerd (model 3). Hierbij is er een algemene verplichting van twee weken voor alle geneesmiddelen en geldt daarnaast een aanvullende voorraadverplichting van twee maanden voor geneesmiddelen met «Major Therapeutic Interest» en een verplichting tot vier maanden voor geneesmiddelen met een historie van beschikbaarheidsproblemen. Handelsvergunninghouders zijn (mede) verantwoordelijk om vast te stellen of hun product onder deze definities valt. Ik heb begrepen dat veel geneesmiddelen zouden vallen onder de definitie van «Major Therapeutic Interest» omdat het een brede definitie betreft. Dit betekent dat voor een groot deel van de geneesmiddelen een verplichting van twee maanden geldt.
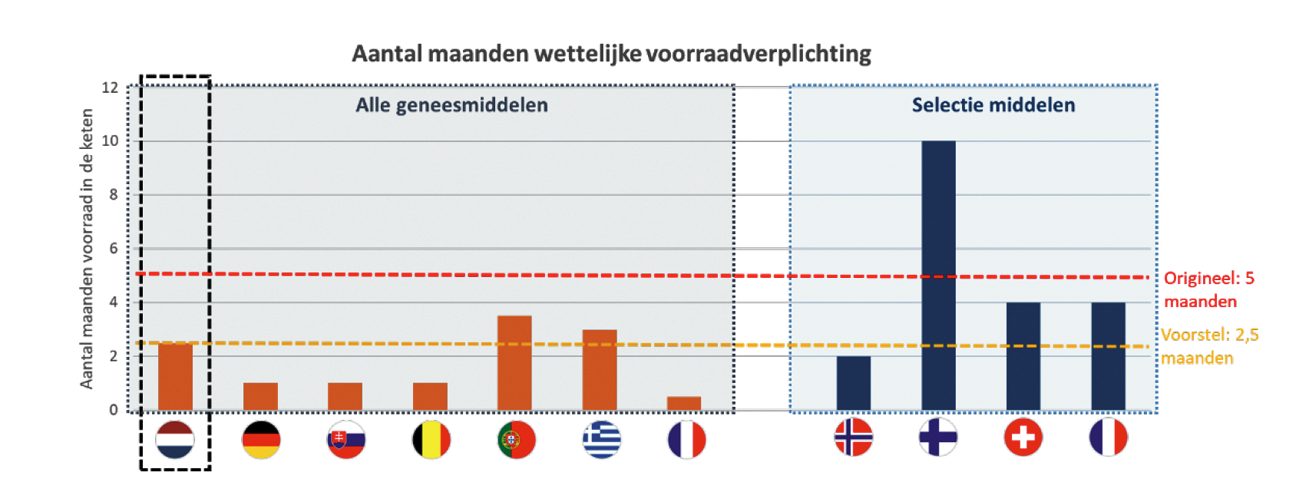
Figuur 1: Wettelijke voorraadverplichtingen in Europese landen.
Er is in de Europese inventarisatie ook nagevraagd op welke wijze landen voorraden monitoren. Hieruit blijkt dat in landen met gekwantificeerd voorraadbeleid veelal geen uitgebreid monitoringssysteem is om deze voorraden proactief te controleren. De verantwoordelijkheid ligt bij de handelsvergunninghouders om op tijd te melden als zij een leveringsonderbreking verwachten. De inspecties zijn wel bevoegd om controles uit te voeren of de partijen zich houden aan de verplichting en er zijn sancties mogelijk als dit niet gebeurt. Dit wordt door landen verschillend ingevuld.
Uit de resultaten concludeer ik dat er geen eenduidige Europese aanpak is waar we als Nederland bij kunnen aansluiten. Wel concludeer ik dat het oorspronkelijke Nederlandse voorstel van vijf maanden voor alle geneesmiddelen sterk afwijkt van de aanpak in andere landen. De Europese Commissie heeft eerder haar zorgen uitgesproken over vergaande nationale voorraadplannen, omdat deze effect kunnen hebben op de beschikbaarheid in andere landen. Deze zorgen zijn onder andere uitgesproken naar aanleiding van de Franse voorraadplannen. Hierover bent u in de vorige voortgangsbrief geïnformeerd.8 De plannen van Frankrijk waren destijds overigens minder vergaand dan de oorspronkelijke Nederlandse plannen.
Gezien de kritiek van de Europese Commissie op de Franse voorraadplannen is er op ambtelijk niveau gesproken met de Europese Commissie over de bevindingen van de Europese inventarisatie en de Nederlandse plannen. De Europese Commissie was zich aanvankelijk ook niet bewust van de verscheidenheid aan voorraadverplichtingen in verschillende landen en was kritisch op het aanvankelijke Nederlandse plan voor vijf maanden en de mogelijke effect daarvan op de beschikbaarheid in andere landen. De Europese Commissie heeft de voorkeur voor een Europese, geharmoniseerde aanpak, maar erkent ook dat de plannen voor Europees voorraadbeleid nog niet concreet zijn en nadere uitwerking en afstemming behoeven. Er is benadrukt dat ook Nederland de voorkeur heeft voor een gezamenlijke Europese aanpak, maar dat dit nog enkele jaren kan duren. De Europese Commissie is geïnformeerd dat gewerkt werd aan een mogelijke heroverweging om beter aan te sluiten bij de aanpak in andere landen.
Real-time monitoring van voorraden is ingewikkeld, tijdrovend en vereist een goed werkend systeem. Ook zijn er vragen over de meerwaarde bovenop het al verplichte meldsysteem. In Europa zijn gedachten over het op Europees niveau geharmoniseerd monitoren van beschikbaarheid (waaronder voorraden), zodat gegevens ook tussen EU-landen gecombineerd en gedeeld kunnen worden. De mogelijkheid tot het ontwikkelen van een geharmoniseerde IT-tool wordt ook bekeken in een door de Europese Commissie geïnitieerde Joint Action. Een Joint Action is een instrument waarin meerdere lidstaten samenwerken aan een gezamenlijk doel, het heeft een sterk beleidsmatig karakter. Joint Actions richten zich op onderwerpen waarbij Europese samenwerking meerwaarde heeft. Landen moeten zich aanmelden voor de Joint Action. Deze specifieke Joint Action staat gepland voor 2022 en 2023. Ook in de nu openstaande publieke consultatie voor de EU-basiswetgeving geneesmiddelen wordt als mogelijke maatregel het geharmoniseerd monitoren genoemd. Met de voorgenomen uitbreiding van het mandaat van het Europees Medicijn Agentschap (EMA) wordt daarnaast een rol gecreëerd voor het EMA in voorraadmonitoring van geneesmiddelen en medische hulpmiddelen in crisissituaties9. Ik acht het op dit moment niet opportuun om naast deze Europese ontwikkelingen een eigen verdergaande monitoringstool te ontwikkelen. Ik bekijk wel wat er beter kan ten aanzien van de werking van het huidige Meldpunt geneesmiddelentekorten en -defecten (hierna Meldpunt) en de daarbij horende meldapplicatie. Daarnaast bekijk ik in het licht van de ontwikkelingen van het EMA of ik, voor bijvoorbeeld crisissituaties, een centrale coördinatiestructuur wil verankeren, zoals bijvoorbeeld het Landelijk Coördinatiecentrum Geneesmiddelen (LCG). Dit hangt ook af van de uiteindelijke exacte vorm van de uitbreiding van het EMA-mandaat en de input die het EMA nodig heeft vanuit de lidstaten.
In de vorige voortgangsbrief bent u geïnformeerd dat zorgverzekeraars en koepelorganisaties voor biosimilars en generieke geneesmiddelenindustrie Nederland (Bogin) en Generieke Leveranciers Nederland (GLN) een pilot hebben georganiseerd om in een gecontroleerde omgeving ervaring op te doen met verdere voorraadopbouw.
Binnen een looptijd van vier maanden bouwden elf generieke handelsvergunninghouders aanvullend voorraad tot twee maanden op voor een selectie van geneesmiddelen. Het betrof geneesmiddelen die onder het preferentiebeleid van zorgverzekeraars vallen. De geneesmiddelen waren opgedeeld in vier categorieën: acuut gebruik, chronisch gebruik, seizoensgebonden producten en opiaten.
Bij de start van de pilot bleek dat een aantal partijen al bezig was (aanvullend) veiligheidsvoorraad op te bouwen. Gedurende de pilot zijn vrijwel alle handelsvergunninghouders erin geslaagd voorraad op te bouwen. Er werd onderscheid gemaakt tussen fast movers (levering van het geneesmiddel iedere 0 tot 4 maanden), medium movers (levering van het geneesmiddel iedere 5 tot 9 maanden) en slow movers (levering van het geneesmiddel (minder) dan eens per 10 maanden). Voor de eerste twee categorieën was het voor meer handelsvergunninghouders realiseerbaar om binnen de beperkte tijd van de pilot aanvullende voorraden op te bouwen.
Daarnaast bevestigde de pilot dat het beheren en verder opbouwen van voorraden kosten met zich meebrengt. Er zijn verschillende kostenposten geïdentificeerd, te weten spillagekosten, financieringskosten, opslagkosten, aanvullende verzekeringskosten en administratieve kosten. De Trusted Third Party (TTP) heeft de onderbouwing van deze kosten ontvangen en geanalyseerd. De spreiding van de kosten was groot. Uit de pilot waren de kosten per maand hoger dan eerder geschatte kosten uit het Gupta rapport dat in 2019 met uw Kamer is gedeeld.10
De complexe dynamiek van zowel de Nederlandse als de Europese markt en de noodzaak tot een «pas toe of leg uit» benadering werd ook in de pilot onderstreept. Handelsvergunningshouders geven ook aan dat er denkbare situaties zijn waarin zij een beroep moeten doen op de veiligheidsvoorraad. Ook is de markt dynamisch en zijn er regelmatige veranderingen, bijvoorbeeld beleidswijzigingen ten aanzien van vergoeding en prijzen, door wijzigingen in preferentiebeleid of het inkoopbeleid van groothandelaren. Ik neem dit mee in de uitwerking van de beleidsregel, waar ik hieronder verder op in ga. Hierbij zal ik handelsvergunningshouders en groothandelaren consulteren.
Ten slotte benadrukken de partijen dat meer voorraad kan helpen om een leveringsonderbreking te overbruggen, maar dat er meer nodig is om de tekortenproblematiek te kunnen adresseren. Volgens partijen spelen verschillende overheidsinstrumenten en marktdynamieken een rol bij het ontstaan van tekorten. Een integrale aanpak is daarbij belangrijk.
Ik bespreek op korte termijn met de partijen hun definitieve bevindingen. Het eindrapport zal ik met uw Kamer delen. Ik dank de partijen voor hun deelname aan de pilot en de inzichten die hiermee zijn opgedaan.
De Europese Commissie heeft een studie laten uitvoeren naar de grondoorzaken van geneesmiddelentekorten en mogelijke oplossingsrichtingen. Het onderzoek is helaas meerdere malen vertraagd. De eindresultaten worden dit jaar nog verwacht. In deze brief deel ik alvast met u de eerste beelden welke de Europese Commissie met lidstaten heeft gedeeld. Een volledige appreciatie van dit onderzoek en de Nederlandse inzet in Europa ontvangt uw Kamer in het eerste kwartaal van 2022.
De analyse van de tekorten in Europa laat zien dat de definities van tekorten en beschikbare data over tekorten sterk uiteenlopen in de verschillende EU landen. Hierdoor is het lastig om gegevens over tekorten te vergelijken tussen landen. Uit de tussenresultaten blijkt dat een tekort gemiddeld drie maanden duurt en er voor circa 80% van geneesmiddelen waarvoor een tekort bestaat een passend alternatief beschikbaar is.11 Het onderzoek laat zien dat geneesmiddelentekorten voorkomen bij alle soorten geneesmiddelen, zowel generiek (60%) als spécialité (40%) en in diverse therapiegebieden.
In het onderzoek zijn ook verschillende oplossingsrichtingen geëvalueerd. Tot nu toe betroffen dit kwalitatieve evaluaties, dat wil zeggen door middel van appreciaties van verschillende veldpartijen waaronder handelsvergunninghouders, groothandelaren, apothekers en overheden. Dit is onwenselijk, omdat eventuele (wets)voorstellen naar aanleiding van deze studie zoveel mogelijk data gedreven zouden moeten zijn. Ik zal in het definitieve rapport kritisch kijken naar de uiteindelijke onderbouwing van de voorstellen. De voorlopige oplossingsrichtingen zijn divers. Eén van deze oplossingsrichtingen gaat over een mogelijke Europese voorraadverplichting, bijvoorbeeld voor kritische geneesmiddelen. Het is nog onduidelijk hoe deze voorraadverplichting vorm zou moeten krijgen, bijvoorbeeld bij welke partij de verplichting ligt en hoe hoog de voorraad zou moeten zijn. Dit zal naar verwachting in het komende jaar nader besproken worden. Andere oplossingsrichtingen zijn bijvoorbeeld het verplicht stellen van risico-mitigatieplannen, het introduceren van EU uniforme verpakkingen zodat verpakkingen makkelijker herverdeeld kunnen worden en het zorgen voor meer transparantie in de keten.
Ik wacht de definitieve resultaten van het onderzoek af. De oplossingsrichtingen worden naar verwachting de komende tijd nog verder uitgedacht. Sommige oplossingsrichtingen zijn ook als voorstellen opgenomen in de publieke consultatie voor de herziening van de basiswetgeving geneesmiddelen12, waaronder het verplichten van een veiligheidsvoorraad. De Europese Commissie is van plan in het vierde kwartaal van 2022 met concrete wetsvoorstellen te komen om de beschikbaarheid van geneesmiddelen beter te kunnen borgen. Daarna duurt het echter nog enige tijd eer de onderhandelingen met de EU Gezondheidsraad en het Europese parlement zijn afgerond en de verplichtingen daadwerkelijk inwerking zouden treden. Ik verwacht dat de aanvullende Europese verplichtingen op zijn vroegst eind 2023 of begin 2024 van kracht worden. Ik vind het daarom belangrijk om, net als andere landen, wel vast een stap te zetten op nationaal niveau.
Tegelijkertijd ben ik een groot voorstander van een geharmoniseerde aanpak, indien haalbaar. Ik volg nauwgezet wat er Europees gebeurt en wat dat in de toekomst zou betekenen voor de nationale aanpak.
Op basis van de bovengenoemde bevindingen heb ik gezocht naar een goede balans tussen enerzijds het op korte termijn realiseren van resultaten voor de Nederlandse patiënt en anderzijds het zoveel als mogelijk aansluiten bij de aanpak in Europa en het (daarmee) ook voorkomen van ongewenste negatieve neveneffecten op de beschikbaarheid van geneesmiddelen in Nederland en andere landen en op spillage. Hierbij heb ik gekozen voor een algemene verplichting van tweeëneenhalve maand voorraad waarvan zes weken bij de handelsvergunninghouder en vier weken bij de groothandel. Volgens het Gupta rapport13 zou een voorraad van tweeëneenhalve maand ongeveer de helft van de tijdelijke tekorten kunnen opvangen, al is het lastig dit percentage exact vast te stellen.
Een veiligheidsvoorraad van tweeëneenhalve maand betekent niet dat er op ieder moment slechts een voorraad van tweeëneenhalve maand aanwezig is. Deze kwantificering gaat over de minimale voorraad die aangehouden moet worden. Doordat de voorraad op verschillende momenten wordt bijgevuld en uitgeleverd is er een wisselende voorraadhoogte zoals geïllustreerd in figuur 2.
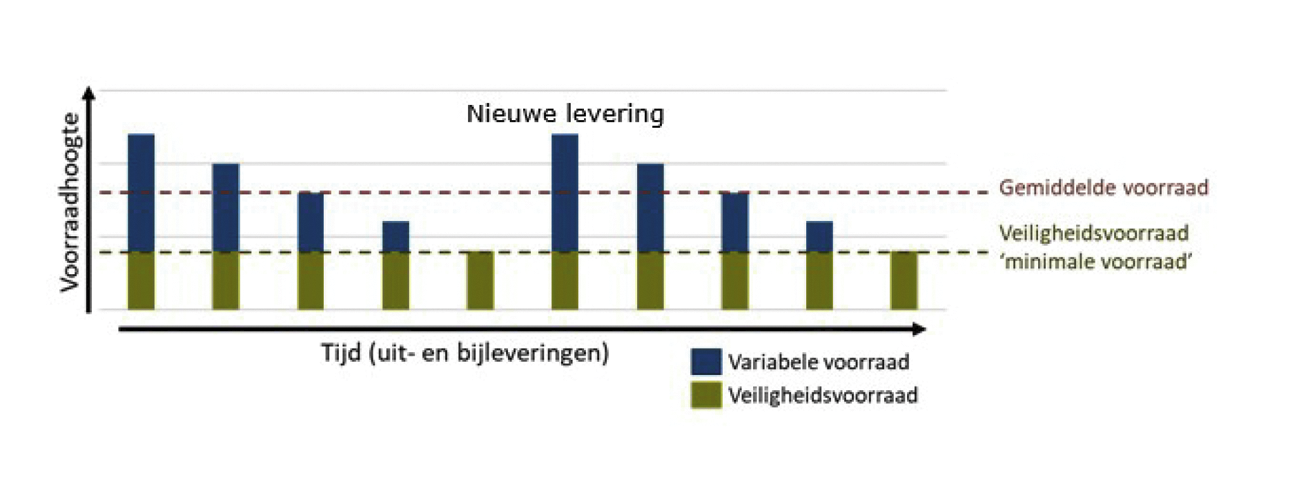
Figuur 2: Illustratieve weergave van voorraadverloop met een minimale voorraad
De kwantificering van de voorraadverplichting geldt voor geneesmiddelen die uitsluitend op recept verkregen kunnen worden (UR-geneesmiddelen). Zelfzorggeneesmiddelen vallen hier dus niet onder. Voor zelfzorggeneesmiddelen geldt nog steeds dat er sprake moet zijn van voldoende voorraad, zoals bedoeld in artikel 49 lid 9 en artikel 36 lid 2 van de Geneesmiddelenwet. Deze geneesmiddelen hebben een andere marktwerking met een sterk commercieel karakter en een ander distributieketen. Ik heb begrepen vanuit de leden van de werkgroep dat er strenge afspraken worden gemaakt rondom leverbaarheid. Daar komt ook bij dat deze geneesmiddelen breed beschikbaar zijn bij onder andere drogisten en dat hiervoor vaak meerdere aanbieders en alternatieven bestaan. Een gebruiker kan makkelijker naar een andere verkoper om alsnog het product te verkrijgen. Ten slotte zijn in het verleden voor zelfzorggeneesmiddelen incidenteel tekorten gemeld. Dit alles wegende vind ik een aanvullende duiding voor de voorraad van zelfzorggeneesmiddelen vanuit de overheid op dit moment niet nodig.
Ik heb ook de optie overwogen om eventueel onderscheid te maken in of een product kritisch is of niet, om te kijken of meer maatwerk haalbaar is. Tekorten komen zowel bij generieken als spécialités voor. Het Meldpunt ontvangt meer meldingen van verwachte leveringsonderbrekingen bij generieken, dit is echter ook deels te verklaren door het feit dat circa driekwart van alle geneesmiddelen generiek is.14 15 Ook merk ik op dat tekorten bij een deel van spécialités juist veel impact kan hebben op de patiënt, omdat er geen andere handelsvergunninghouder is die als passend alternatief kan dienen. Ik zie daarom weinig aanknopingspunten om op basis van deze kenmerken op dit moment meer maatwerk toe te passen. In de beleidsregel worden wel handvatten gegeven voor gevallen waarin de voorraadverplichting niet uitvoerbaar zou kunnen zijn.
In Europees verband wordt gewerkt aan het opstellen van (criteria voor) een lijst met kritische geneesmiddelen om te bekijken of er voor deze middelen aanvullende maatregelen wenselijk zijn. Ik heb de afgelopen maanden actief deelgenomen aan deze discussies. Hier blijkt dat het opstellen van een lijst met kritische geneesmiddelen uitdagend is. Immers kunnen veel producten in een specifieke situatie voor een specifieke patiënt kritisch zijn. Uit dit traject komt ook naar voren dat het onwenselijk is dat verschillende landen werken met verschillende lijsten en criteria. Ik blijf nauw aangesloten bij het EU-traject. Ik acht het derhalve op dit moment ook niet haalbaar om sterkere voorraadverplichtingen in te voeren voor een specifieke nationale lijst met kritische geneesmiddelen. Uitzondering hierop is de Corona Crisis Voorraad waarbij ziekenhuizen tijdelijk grotere voorraden aanhouden van Corona gerelateerde (IC-)geneesmiddelen.
In de brief van 7 juli 202016 kondigde voormalig Minister voor MZS Van Rijn aan dat de voorraad op 1 juli 2022 gerealiseerd moest zijn. Aangezien de voorraadtermijn verlaagd wordt van vijf naar tweeënhalve maand en er nog ruim een half jaar te gaan is acht ik dit haalbaar. Uit eerder onderzoek van Gupta17 bleek dat een deel van de handelsvergunningshouders al een veiligheidsvoorraad aanhoudt van één tot twee maanden en dat ook bij de groothandelaren al een veiligheidsvoorraad ligt van twee tot drie weken. Ook zijn sommige bedrijven reeds begonnen met het aanleggen van voorraden in aanloop naar 1 juli 2022. Het is denkbaar dat dit ondanks inspanningen voor sommige geneesmiddelen te kort dag is. De IGJ zal voor de handhaving van de in de beleidsregel vastgestelde omvang een overgangstermijn hanteren van zes maanden.
De verduidelijking van de veiligheidsvoorraad wordt opgenomen in een beleidsregel. De conceptversie van de beleidsregel is bijna gereed. Ik deel deze binnenkort met veldpartijen ter consultatie. Ik zie dat er in het veld veel behoefte is aan duidelijkheid over de invulling van de voorraadverplichting en dat er oog is voor bijzondere omstandigheden, zoals situaties waarbij het niet mogelijk is aan de voorraadverplichting te voldoen. Ook zijn er producten te bedenken waarvoor het niet mogelijk is om de bepaalde voorraad aan te houden, zoals gepersonaliseerde producten die op maat worden gemaakt voor de specifieke patiënt.
Ik begrijp de behoefte aan duidelijkheid. Ik werk daarom, samen met de IGJ, aan een beleidsregel die duidelijkheid schept over de kaders. Tegelijkertijd benadruk ik dat het niet mogelijk is om van tevoren duidelijkheid te geven over alle situaties die zich kunnen voordoen gezien de complexiteit en dynamiek van de geneesmiddelenmarkt.
De handelsvergunninghouders en groothandelaren zijn verantwoordelijk voor een verantwoorde onderbouwing van de keuzes voor de aangehouden voorraad. De oordeelvorming in het specifieke geval valt onder de toezichtstaak van de IGJ. Vooruitlopend op de beleidsregel wil ik vast duidelijkheid geven over het volgende, ook naar aanleiding van de vragen die tijdens het Commissiedebat van16 juni 2021 zijn gesteld over de voorraadverplichting. De voorraad die aangehouden moet worden is onder andere gerelateerd aan het specifieke marktaandeel en de verwachte vraag. Een handelsvergunninghouder met een klein marktaandeel zal dus minder totale voorraad hebben dan een handelsvergunninghouder met een groot marktaandeel.
Hierbij geldt het principe van «pas toe of leg uit». Er kunnen externe ontwikkelingen zijn, waardoor een handelsvergunninghouder of groothandel een groter beroep moet doen op de opgebouwde voorraad. Dit is ook wat de Europese Commissie benadrukt in een werkdocument over de begrenzing van de zorgplicht van de handelsvergunninghouder en groothandel ten aanzien van voorraad18. De Commissie noemt hier twee situaties waarbij handelsvergunninghouder mogelijk niet verantwoordelijk zijn voor het ontstaan van een tekort:
– tekorten die worden veroorzaakt doordat een distributeur geneesmiddelen uitvoert naar/levert aan een andere klant in een andere lidstaat en waarvan de houders van een vergunning voor het in de handel brengen zich niet bewust zijn (voor zover zij niet hebben verzuimd te voldoen aan de normale bestellingen in verhouding tot de omvang van de markt van de betreffende lidstaat) (oftewel parallelexport); en
– tekorten die worden veroorzaakt door een verhoogde vraag vanwege een tekort aan een alternatief geneesmiddel van een ander bedrijf.
Ik verwacht met de beleidsregel een deel van de vragen vanuit de partijen over de uitvoering weg te kunnen nemen. Maar ik wil er ook op wijzen dat in landen waar al langere tijd voorraadverplichtingen zijn er actuele discussies zijn over de uitvoering en uitzonderingsgronden. Ik zal de ervaringen uit de praktijk daarom nauwgezet volgen. Waar nodig, en op basis van de opgedane ervaringen, kan de beleidsregel in de loop van de tijd dan verder worden verduidelijkt en aangevuld. Ik blijf ook aandringen op meer handvatten op Europees niveau.
Het aanhouden van (meer) voorraad kost geld. Zoals gezegd zijn handelsvergunningshouders en groothandelaren nu al wettelijk verplicht om voldoende voorraad aan te houden. Het verschilt echter sterk per handelsvergunningshouder en per product hoe deze verplichting wordt ingevuld. Sommige handelsvergunningshouders en groothandelaren zullen de benoemde voorraden van respectievelijk zes weken en vier weken al minimaal aanhouden. Voor een deel van de bedrijven betekent het echter dat zij hun voorraden moeten ophogen en daarmee mogelijk aanvullende kosten zullen maken. Hier staat tegenover dat ik met deze verplichting wel weer een gelijk(er) speelveld tussen bedrijven creëer.
Op basis van het onderzoek naar financiering voor de ijzeren voorraad19 is eerder een berekening gemaakt van de verwachte kosten en is gekozen om de kosten van de voorraad te laten verwerken in de inkoopprijs. Door de voormalig Minister voor MZS Bruins is hiertoe het Uitgavenplafond zorg (UPZ) structureel opgehoogd met € 25 miljoen (€ 45 miljoen voor hogere kosten minus € 20 miljoen aan besparingen), destijds bedoeld voor de voorraadverplichting van vijf maanden. Dit om hogere zorguitgaven als gevolg van het verstevigen van de voorraadposities van geneesmiddelen (deels) op te vangen en mogelijk te maken. Het was geen volledige dekking van de kosten, een deel van de kosten moest door partijen zelf opgevangen worden.
Tijdens de pilot hebben partijen gegevens overlegd over de gemaakte kosten van de aanvullende voorraad. Hieruit bleken hogere kosten dan uit het eerdergenoemde rapport. Het is op dit moment nog niet mogelijk om deze verschillen exact te duiden en verklaren. Voor handelsvergunningshouders van geneesmiddelen met al lage marges is het mogelijk niet rendabel om deze kosten volledig zelf op te vangen. Tegelijkertijd, zijn er handelsvergunningshouders en groothandelaren die nu al (deels) aan de veiligheidsvoorraadverplichting voldoen. Die kosten zitten dus al (deels) verwerkt in de huidige prijzen. Rekening houdend met deze constateringen en deze onzekerheden heb ik besloten om, ondanks de verlaging van de voorraadverplichting, niet nu over te gaan tot het verlagen van de beschikbare budgettaire reeks. Wel zal ik de definitieve uitkomsten van de pilot nader bestuderen en de praktijkervaringen volgen, om zodoende ook op financieel gebied e.e.a. in de gaten te houden.
Met de genoemde verhoging van het UPZ is gezorgd dat er budgettaire ruimte is om een deel van de prijzen (eventueel) te laten stijgen. Ik verwacht dat veldpartijen hun inkoop zorgvuldig doen en dan ook ruimte bieden voor eventuele prijsstijgingen waar deze daadwerkelijk nodig en mogelijk zijn. Met de beleidsregel ontstaat een gelijk(er) speelveld ten aanzien van de geldende voorraadverplichting, waardoor partijen onder gelijke(re) voorwaarden met elkaar concurreren.
Ik ben mij ervan bewust dat een verscherpte voorraadverplichting risico’s kan hebben voor geneesmiddelen die mogelijk nu al kwetsbaar zijn. Ik denk bijvoorbeeld aan geneesmiddelen met lage winstmarges. Verschillende veldpartijen, waaronder fabrikanten, hadden zorgen dat bij een voorraadverplichting van vijf maanden kwetsbare producten van de markt zouden worden gehaald. Ik verwacht dat dit risico lager is met de nieuwe aanpak, hoewel ik niet kan uitsluiten dat voor bepaalde specifieke producten risico’s blijven bestaan. Met het onderzoek naar de onderkant van de geneesmiddelenmarkt hoop ik meer inzicht te krijgen in welke producten kwetsbaar zijn en de rol die instrumenten van veldpartijen en overheid hier spelen.
Eerder is besloten tijdens de COVID-19 crisis (onder meer) een tijdelijke mitigerende maatregel te nemen binnen de Wgp om bij onvoorspelbare marktomstandigheden mogelijke kwetsbare producten te ontzien. Met deze tijdelijke maatregel is op verzoek voor producten met een relatief lage omzet (< € 1 miljoen in Nederland per jaar) tijdelijk geen daling van de maximumprijs doorgevoerd om eventuele risico’s op beschikbaarheidsproblemen in dit marktsegment te verkleinen. In afwachting van de uitkomsten van het eerder genoemde onderzoek naar de onderkant van de geneesmiddelenmarkt, verleng ik deze tijdelijke mitigerende maatregel voor de eerstvolgende herijking van april 2022. Het financiële effect van het verlengen van deze tijdelijke maatregel kan worden gedekt binnen het financiële kader. Ten slotte hebben handelsvergunninghouders altijd de mogelijkheid, als de wettelijke maximumprijs daadwerkelijk de mogelijkheid tot een redelijke winst belemmert, hiertoe een verzoek in te dienen onder artikel 3 (2) van de Wgp. Ik verwacht dan wel een gedegen onderbouwing.
Op basis van de resultaten van het onderzoek naar de onderkant van de geneesmiddelenmarkt bekijk ik of eventuele aanvullende acties nodig zijn om de beschikbaarheid van mogelijk kwetsbare geneesmiddelen beter te borgen.
Bij de opbouw van de CCV en de pilot ijzeren voorraad heb ik gezien dat het aanhouden van grotere voorraden het risico op verspilling vergroot. Met de verlaging van de grootte van de veiligheidsvoorraad van vijf naar tweeëneenhalve maanden wordt het risico op spillage verkleind naar een meer acceptabel niveau. Wel wordt het nog belangrijker dat producten met een beperkte resterende houdbaarheid zo efficiënt mogelijk worden ingezet. Ik heb begrepen dat verschillende partijen in de keten, waaronder groothandelaren, zorgverzekeraars en apotheken, eisen stellen aan de resterende houdbaarheidstermijnen of te hanteren aflevertermijnen van geneesmiddelen. De samenloop van deze termijnen kan ertoe leiden dat geneesmiddelen met een beperkte resterende houdbaarheid niet meer geaccepteerd worden in de keten, terwijl deze geneesmiddelen nog veilig ingezet kunnen worden. Partijen uit de keten hebben aangegeven dat zij graag om tafel willen om te bekijken of werkafspraken gemaakt kunnen worden om voorraden met een beperkte resterende houdbaarheid maar nog goede kwaliteit zo goed als mogelijk in te kunnen zetten. Ik juich dit initiatief toe en zal dit faciliteren. Ik hoop dat partijen uiterlijk in het eerste kwartaal van 2022 tot werkafspraken komen.
Het beleid omtrent veiligheidsvoorraden kent verschillende uitwerkingsvraagstukken waar ik de afgelopen jaren met partijen over heb gesproken. Zoals gezegd is het lastig om alle praktische uitvoeringsvraagstukken van tevoren compleet te overzien. De veiligheidsvoorraad verplichting wordt twee jaar na ingangsdatum geëvalueerd. Hierbij zal ik de (neven)effecten van de maatregel, voor zover haalbaar, bekijken en of de beleidsregel aangevuld c.q. aangepast moet worden. Zo creëer ik een lerend systeem. Bij de evaluatie wordt ook de voortgang meegewogen die dan inmiddels op Europees niveau is behaald.
De veiligheidsvoorraad is één van de manieren waarop ik geneesmiddelentekorten aanpak. Deze oplossingsrichting pakt niet de grondoorzaken van tekorten aan, maar creëert een buffer om tijdelijke leveringsonderbrekingen beter te kunnen ondervangen. Ook met extra voorraad bestaat helaas de mogelijkheid dat tekorten ontstaan en kan de aanvoer van bepaalde producten kwetsbaar blijven. We moeten daarom breder blijven inzetten op de beschikbaarheid van medische producten, het aanpakken van de grondoorzaken van tekorten en het versterken van de leveringszekerheid. Over dit laatste heb ik uw Kamer recent geïnformeerd20. Met alle geschetste Europese ontwikkelingen, de Europese studie en de mogelijkheid voor aanvullende Europese wetsvoorstellen en acties, zie ik hiervoor in de komende jaren ook voldoende kansen die vragen om een stevige inzet in Europa
In de stand van zaken-brief leveringszekerheid van medische producten heb ik uw Kamer geïnformeerd dat ik aanvullende kennis, analyse en inzichten nodig heb als het gaat om de productie- en toeleveringsketen van onder andere geneesmiddelen. Ik heb daarom nader onderzoek uitgezet over de risico’s en kwetsbaarheden in de productie- en toeleveringsketens. Ik verwacht de resultaten hiervan in de loop van 2022 en laat vervolgacties op dat gebied aan het volgende kabinet. In dezelfde brief geef ik aan evaluatieonderzoek te doen naar de ervaringen met de verschillende instrumenten om productie dichtbij huis – binnen Nederland en de EU – te stimuleren. Het stimuleren en behouden van productie van medische producten dichtbij huis kan bijdragen aan de leveringszekerheid. De inzet om de leveringszekerheid te versterken is nationaal gericht, maar ook Europees en breder internationaal.
Daarnaast bekijk ik welke winst nationaal nog te behalen is in het signaleren en ondervangen van tekorten. Zo zet ik de samenwerking in de Werkgroep geneesmiddelentekorten, waarin overheid, leveranciers, zorgverzekeraars, groothandelaren en zorgverleners samenwerken, graag voort. Ik ben bezig met de doorontwikkeling van het Meldpunt, waarmee we werken aan een betere meldfunctie en -proces. De afgelopen jaren is het aantal meldingen fors toegenomen. Een groot deel van deze meldingen betreft meldingen die door enkele handelsvergunninghouders zekerheidshalve worden gedaan omdat deze handelsvergunninghouders onduidelijkheid ervaren bij hetgeen ze wel of niet moet melden en boetes vrezen. Dit zorgt voor een ernstige en onwenselijke vertroebeling van de cijfers. Ook kost het Meldpunt veel tijd om alle meldingen te verwerken, terwijl voor een groot deel van de meldingen geen daadwerkelijk tekort ontstaat. Ik werk aan herformulering van de Geneesmiddelenwet die hopelijk meer duidelijk geeft in de reikwijdte van de verantwoordelijkheden van handelsvergunninghouders. Ik bekijk ook met de IGJ welke duidelijkheid zij hier nog in kunnen geven. Daarnaast wil ik de routekaart voor de afhandeling van meldingen van geneesmiddelentekorten die in 2017 is opgesteld op basis van de lessen van de afgelopen jaren actualiseren.
Ten slotte wil ik u informeren over de afhandeling van de motie van Kamerlid Dik-Faber21. Hierin heeft uw Kamer de regering opgeroepen om informatie over tekorten te publiceren. Het afgelopen jaar heb ik verkend welke mogelijkheden hiertoe zijn en wat de behoeften van veldpartijen hierin zijn. Op dit moment publiceert de IGJ een tekortenbesluit op het moment dat een tekort niet opgelost kan worden met alternatieven in het binnenland, maar wel door vergelijkbare producten uit het buitenland. Het College ter Beoordeling van Geneesmiddelen publiceert een advies aan artsen en apothekers op de website als er sprake is van een tekort waarvoor geen passend alternatief (meer) is. Dit komt enkele keren per jaar voor. Farmanco (van de KNMP)22 publiceert gegevens over alle tekorten die apothekers ervaren, inclusief informatie of er alternatieven zijn. Ten slotte publiceert SFK over de leveringsproblemen die worden ervaren door één of meerdere groothandelaren23.
Op dit moment heeft het Meldpunt, door de wijze waarop het meldingsproces is ingericht, geen overzicht van alle daadwerkelijke tekorten op productniveau. Het Meldpunt heeft een overzicht van alle meldingen van verwachte leveringsonderbrekingen. Op het moment dat er voldoende alternatieven zijn, wat in de meerderheid van de meldingen het geval is, wordt een melding afgesloten. Het is dan niet definitief vast te stellen of zich daadwerkelijk een tekort manifesteert voor dit specifieke middel of niet. Een compleet overzicht van geneesmiddelentekorten kan het Meldpunt dus ook niet publiceren. Het publiceren van alle meldingen van mogelijke leveringsonderbrekingen vind ik onverstandig en kan onnodige onrust en administratieve lasten voor het veld creëren. Dit wordt versterkt door de eerdergenoemde vertroebeling in de meldingen doordat enkele handelsvergunninghouders zekerheidshalve veel meldingen doen. Mogelijk biedt de eerdergenoemde samenwerking op Europees niveau in de Joint Action op termijn nieuwe aanknopingspunten. Op dit moment is het niet uitvoerbaar om bovenop de genoemde publicaties, meer gegevens over tekorten te publiceren. Ik beschouw de motie hiermee als afgehandeld.
Met de in deze brief genoemde maatregel zet ik een stap met partijen naar het beter ondervangen van tijdelijke leveringsonderbrekingen. De komende maanden werk ik met partijen aan de resterende implementatievraagstukken. De volgende voortgangsbrief over de veiligheidsvoorraad verwacht ik rond het einde van het eerste kwartaal in 2022 met uw Kamer te delen. In deze brief wordt in ieder geval ingegaan op de ontwikkeling van de beleidsregel, eventuele relevante geleerde lessen tot dusver en de appreciatie van de studie van de Europese Commissie naar de grondoorzaken van geneesmiddelentekorten.
De Staatssecretaris van Volksgezondheid, Welzijn en Sport, P. Blokhuis
Art. 81 en 123 van richtlijn 2001/83 vertaald in artikel 49 lid 7 en 9 van de Geneesmiddelenwet
Informatie over Zwitserse voorraden is verkregen via literatuuronderzoek: www.iqvia.com/library/white-papers/agile-stockpiles;
In de Nederlandse cijfers zien we dat er voor circa 99%van de tekorten een passend alternatief of oplossing is (jaarraportage Meldpunt geneesmiddelentekorten 2020).
Link naar publieke consultatie: https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/12963-Revision-of-the-EU-general-pharmaceuticals-legislation/public-consultation_en
In 2018 gingen de meldingen over verwachte leveringsonderbrekingen voor 60% om generieken en 40% om spécialités, in 2020 ging circa 80% van de meldingen om generieken en 20% om spécialités. Het verschil in 2020 is ook mogelijk te verklaren doordat enkele generieke fabrikanten in dat jaar zekerheidshalve veel meldingen hebben gedaan waarbij uiteindelijk toch geen leveringsonderbreking plaatsvond.
Kopieer de link naar uw clipboard
https://zoek.officielebekendmakingen.nl/kst-29477-735.html
De hier aangeboden pdf-bestanden van het Staatsblad, Staatscourant, Tractatenblad, provinciaal blad, gemeenteblad, waterschapsblad en blad gemeenschappelijke regeling vormen de formele bekendmakingen in de zin van de Bekendmakingswet en de Rijkswet goedkeuring en bekendmaking verdragen voor zover ze na 1 juli 2009 zijn uitgegeven. Voor pdf-publicaties van vóór deze datum geldt dat alleen de in papieren vorm uitgegeven bladen formele status hebben; de hier aangeboden elektronische versies daarvan worden bij wijze van service aangeboden.
