Staatscourant van het Koninkrijk der Nederlanden
| Datum publicatie | Organisatie | Jaargang en nummer | Rubriek |
|---|---|---|---|
| Ministerie van Volksgezondheid, Welzijn en Sport | Staatscourant 2001, 250 pagina 74 | Besluiten van algemene strekking |
Zoals vergunningen, bouwplannen en lokale regelgeving.
Adressen en contactpersonen van overheidsorganisaties.
U bent hier:

| Datum publicatie | Organisatie | Jaargang en nummer | Rubriek |
|---|---|---|---|
| Ministerie van Volksgezondheid, Welzijn en Sport | Staatscourant 2001, 250 pagina 74 | Besluiten van algemene strekking |
14 december 2001
Z/VU-2243505
De Minister van Volksgezondheid, Welzijn en Sport;
Gelet op de artikelen 9 en 11a van het Verstrekkingenbesluit ziekenfondsverzekering;
Gezien het rapport van de Ziekenfondsraad (rapport van 24 maart 1994 SGZ/874/94), het rapport van de Commissie Vergoedingslimieten van de Ziekenfondsraad (rapport van 26 maart 1991, FARM/5468) en de rapporten van het College voor zorgverzekeringen (rapporten 6 april 2001, Farmacie/21017544, 5 juni 2001, Farmacie/21023591, 7 juni 2001, Farmacie/21025985, 25 juni 2001, Farmacie/21028100, 19 juli 2001, Farmacie/21031956, 3 augustus 2001, Farmacie/21034253, 18 september 2001, Farmacie/21042084, 2 oktober 2001, Farmacie/21043899 en 13 november 2001, Farmacie/21049826);
Besluit:
De Regeling farmaceutische hulp 19961 wordt als volgt gewijzigd:
A
Bijlage 1 wordt als volgt gewijzigd:
1. In onderdeel A worden de volgende regels opgenomen:
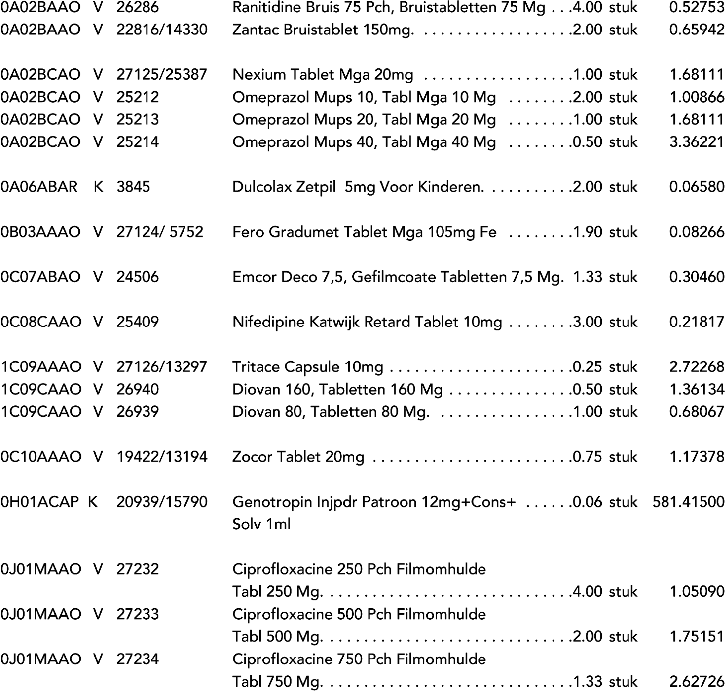
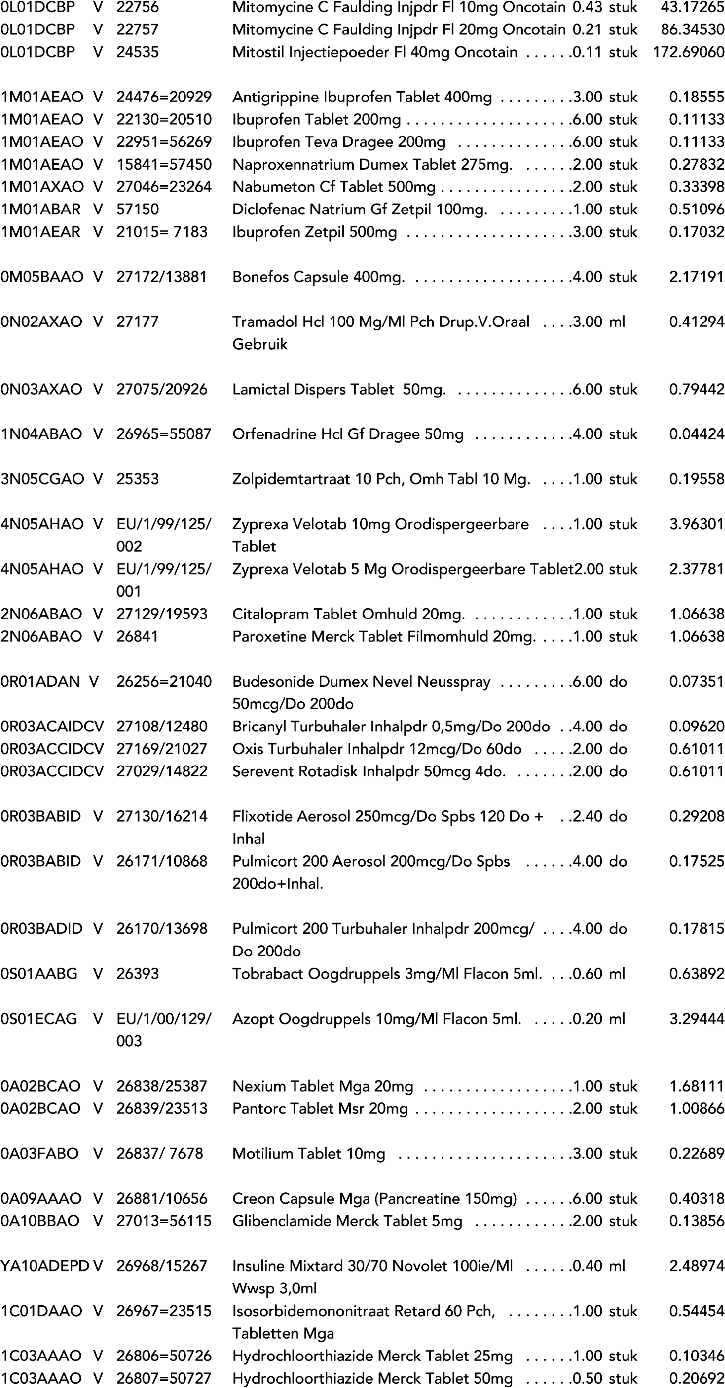
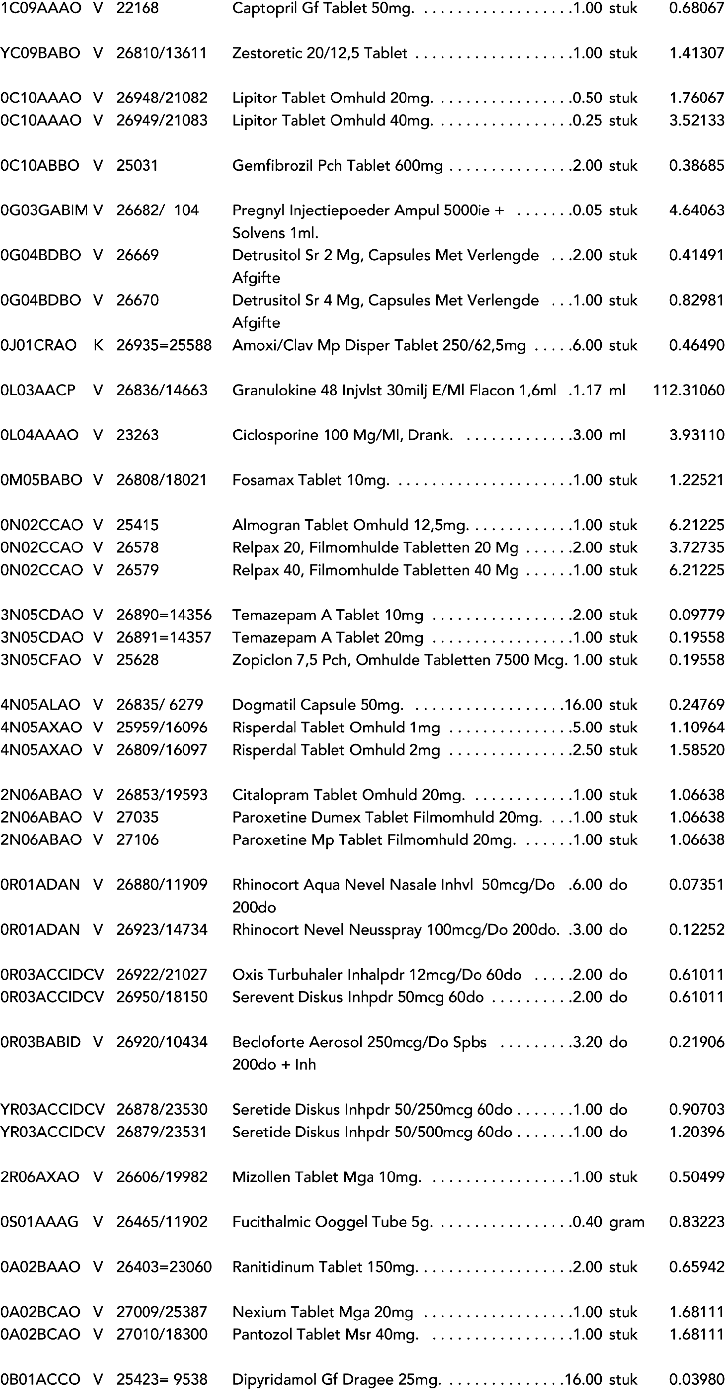
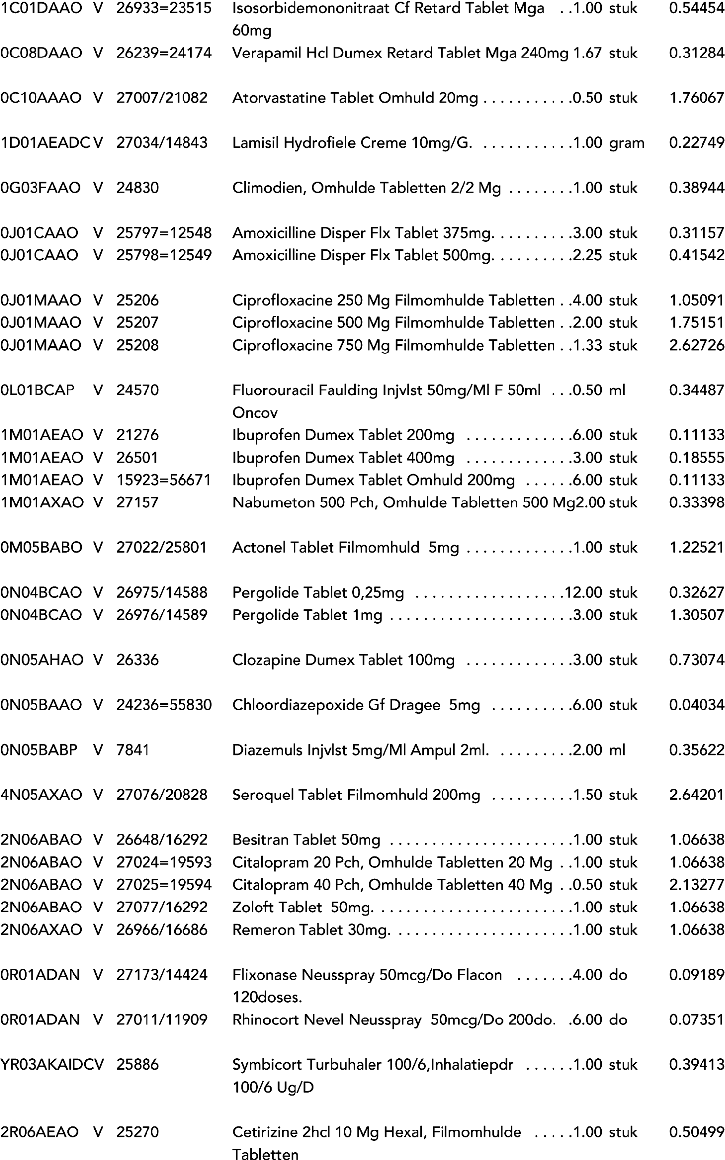
2. In onderdeel A worden de volgende regels vervangen door de daarbij vermelde teksten:

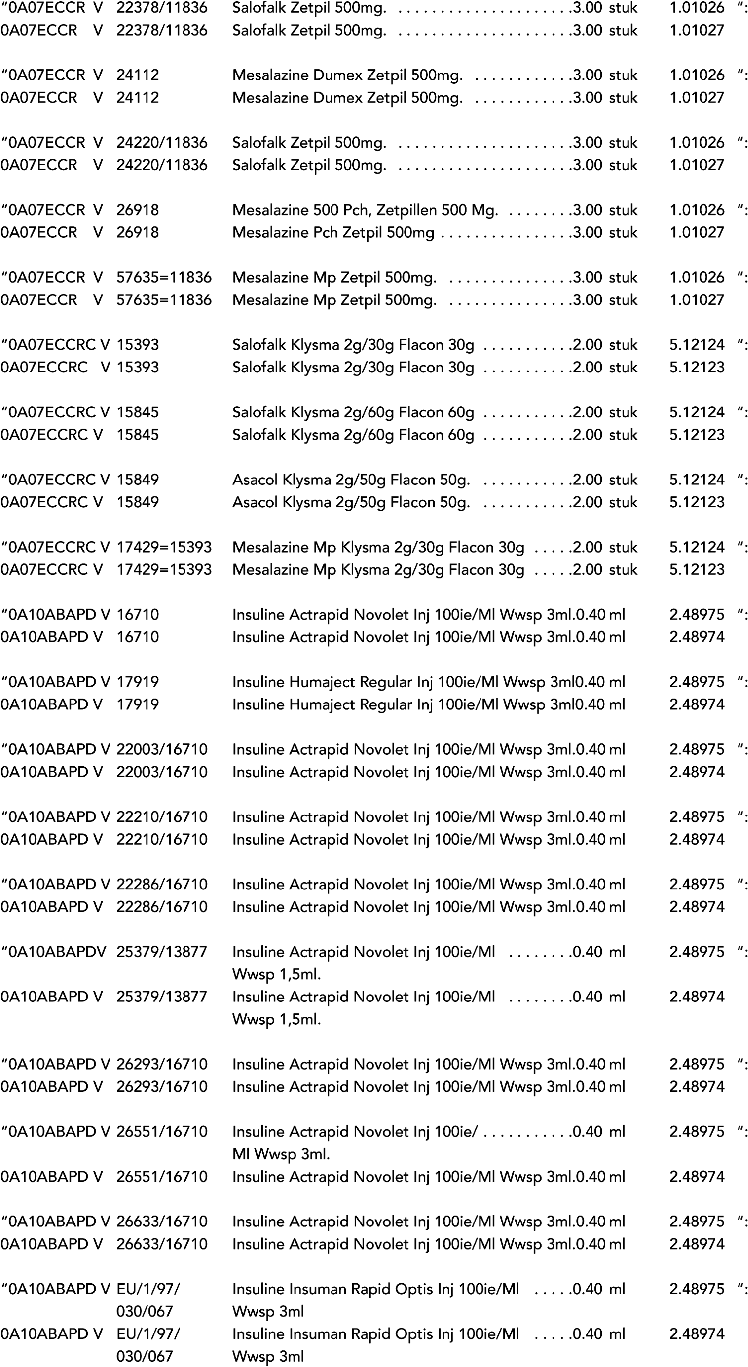
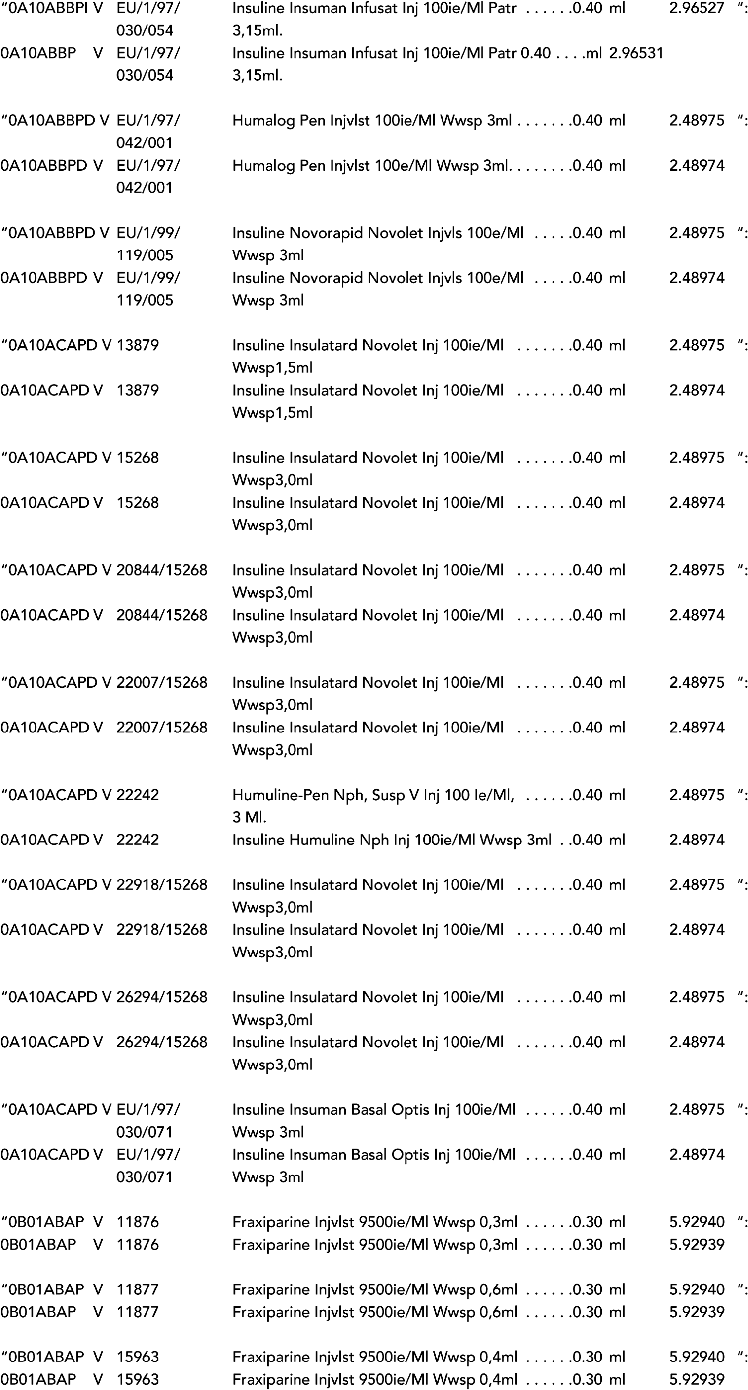
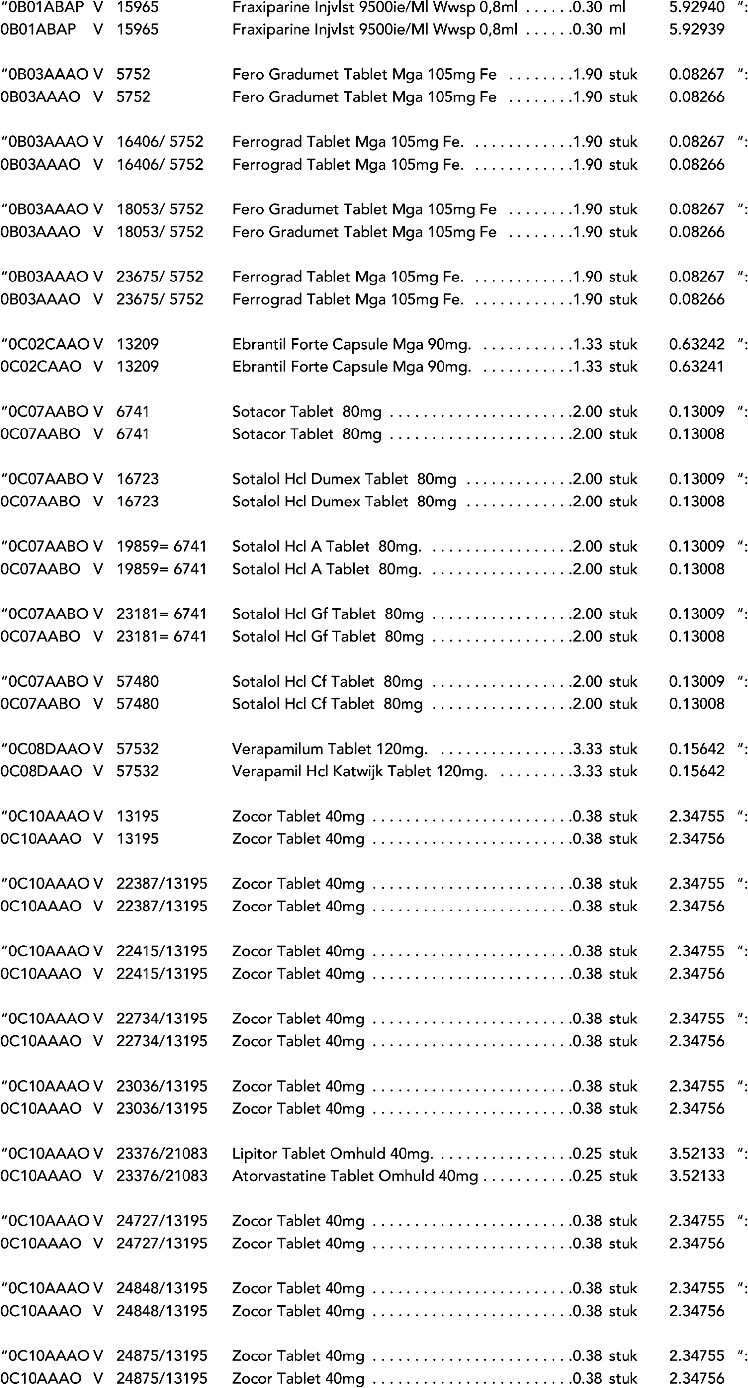
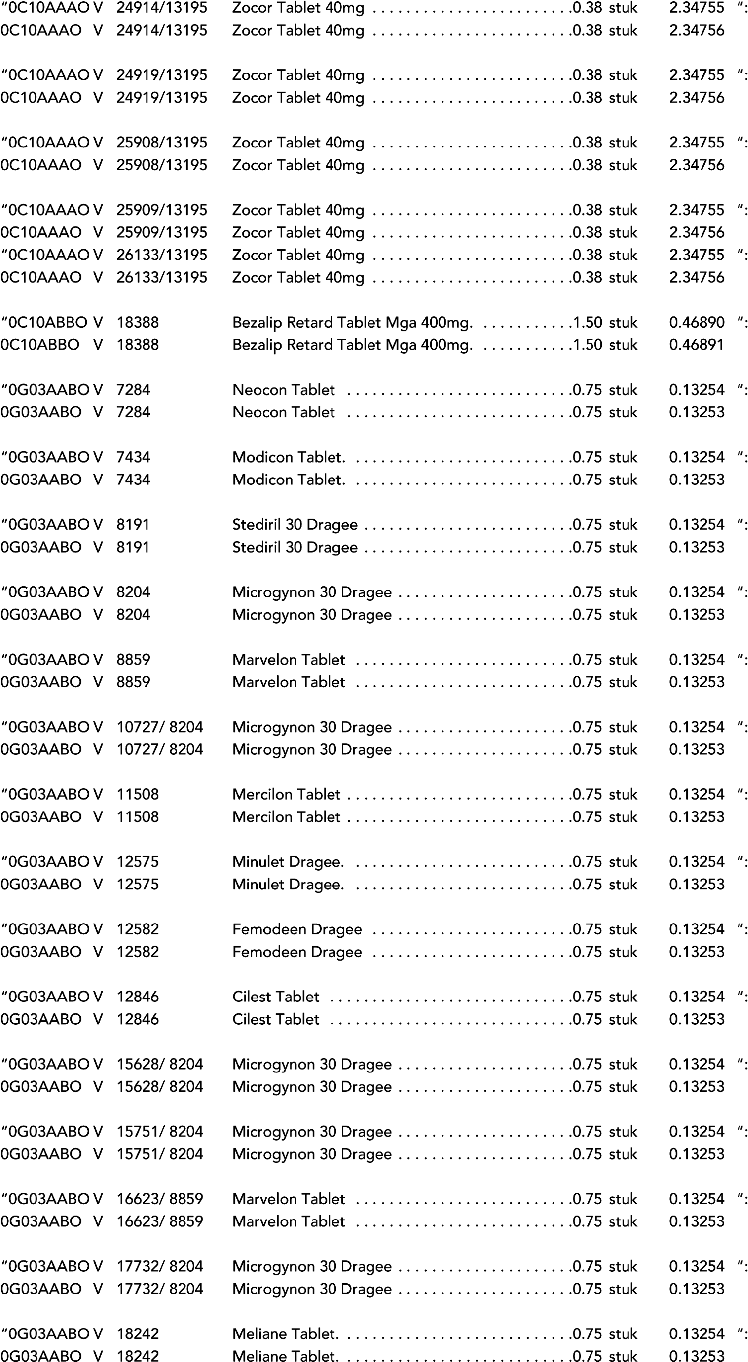
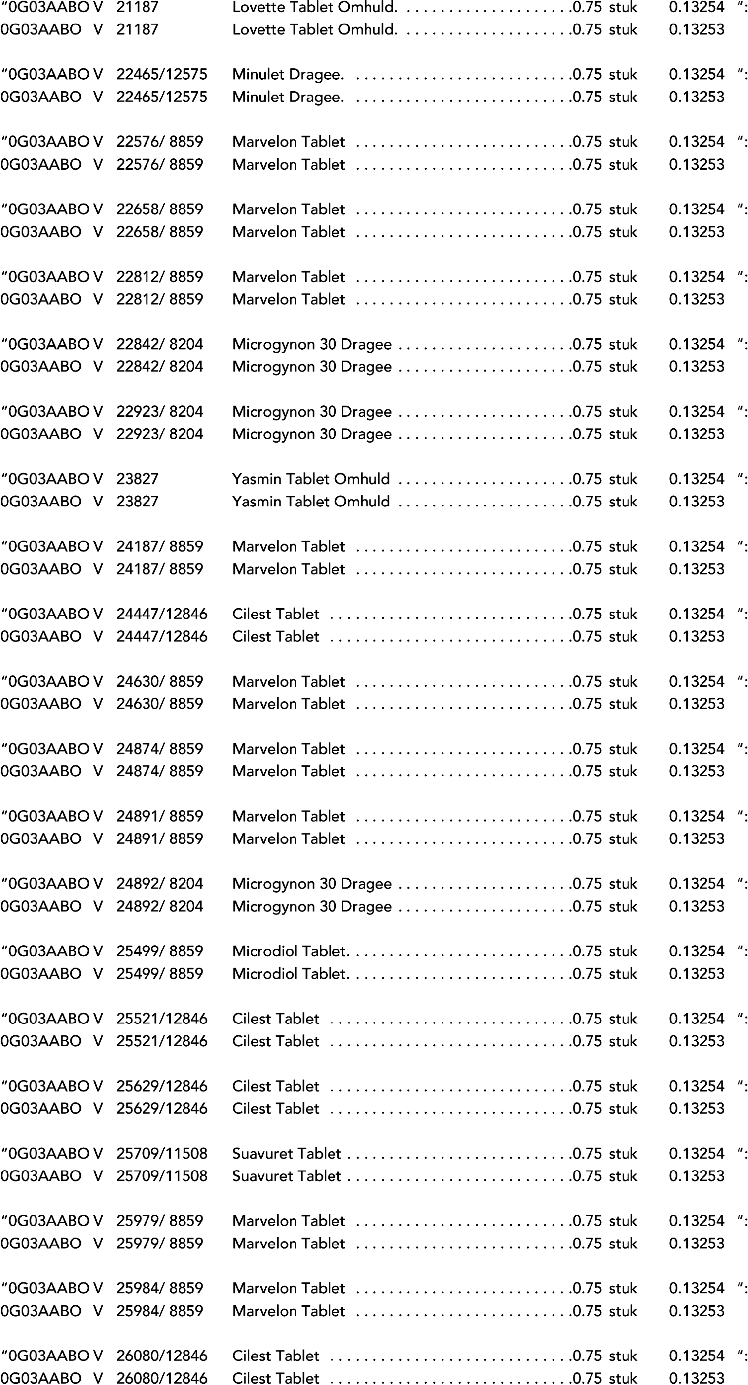
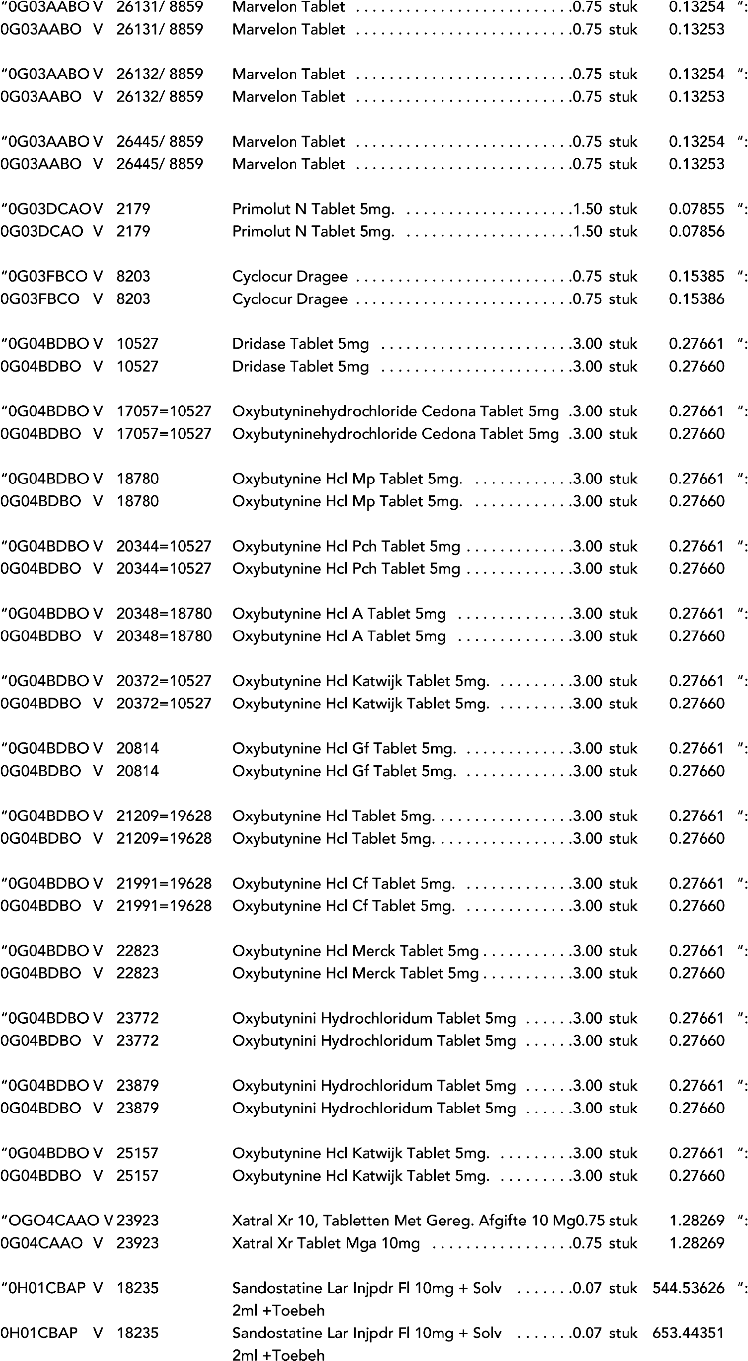
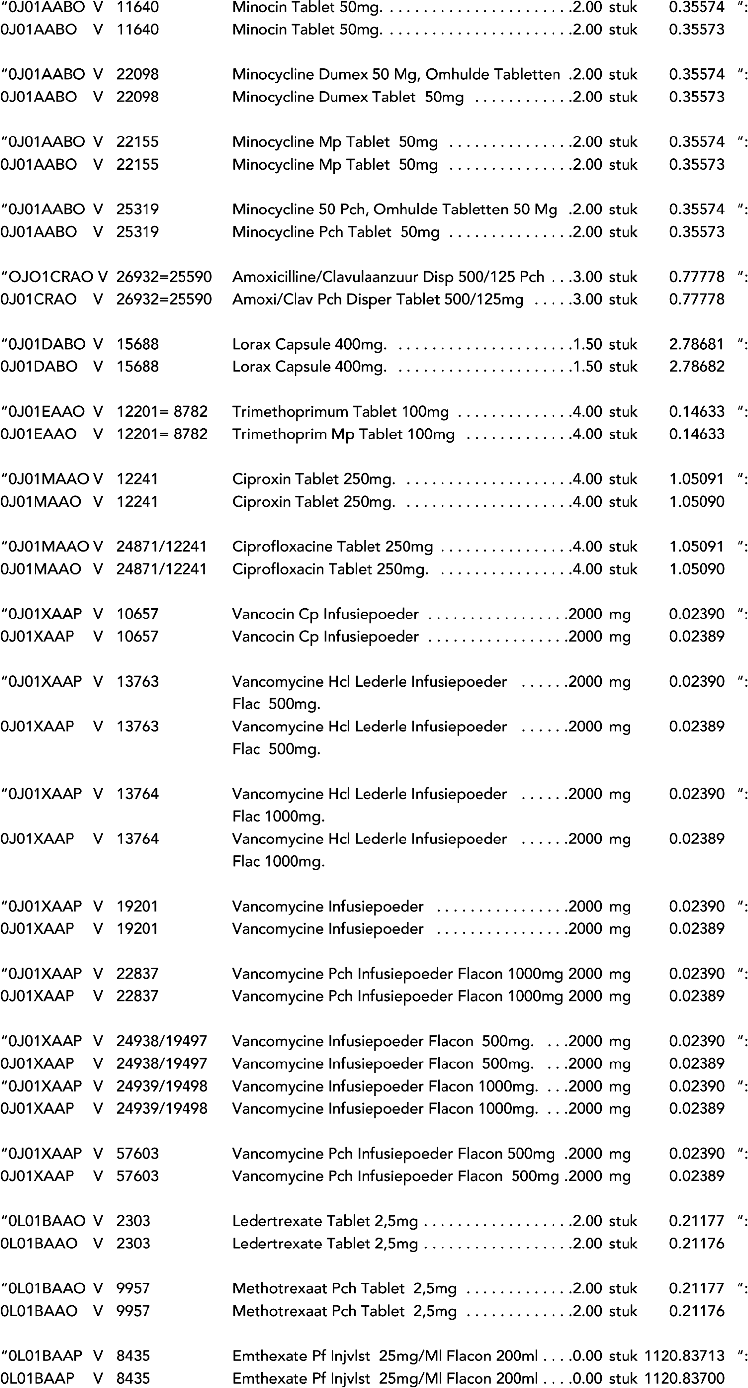
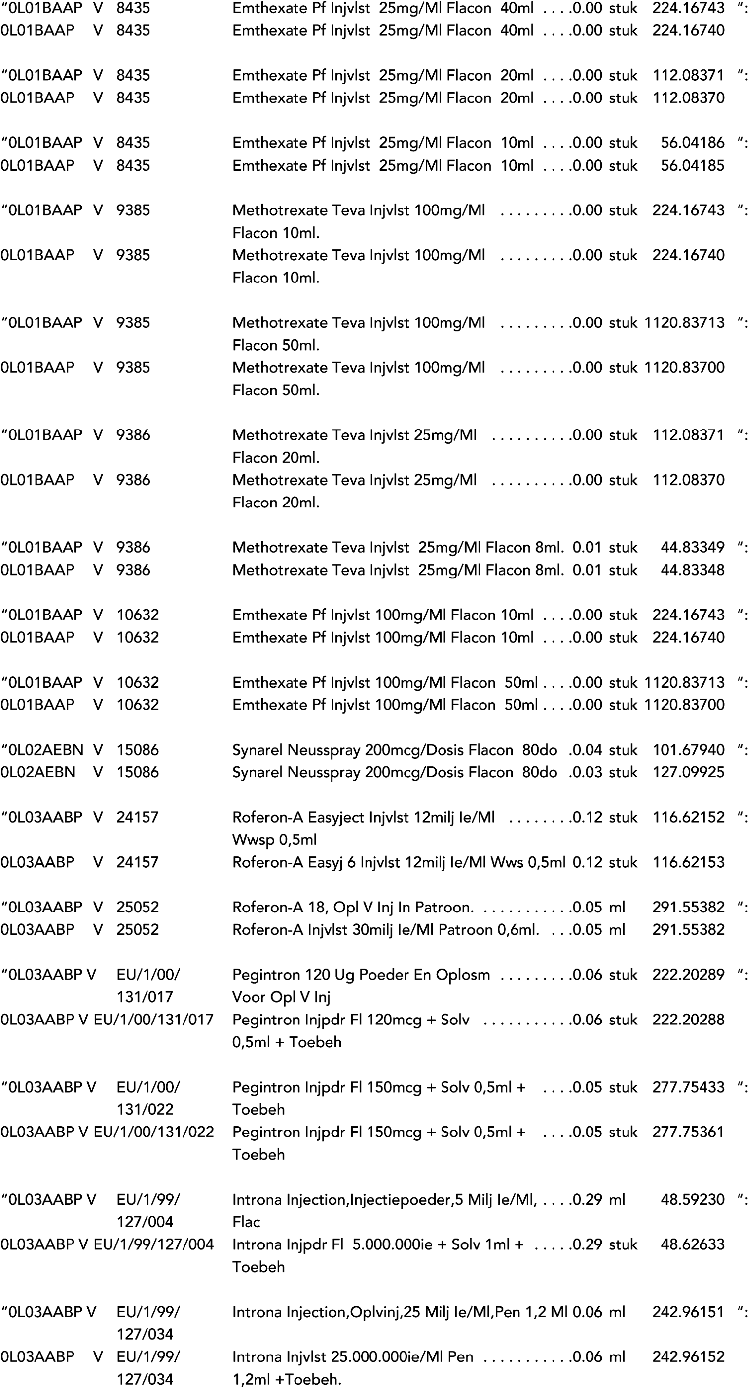
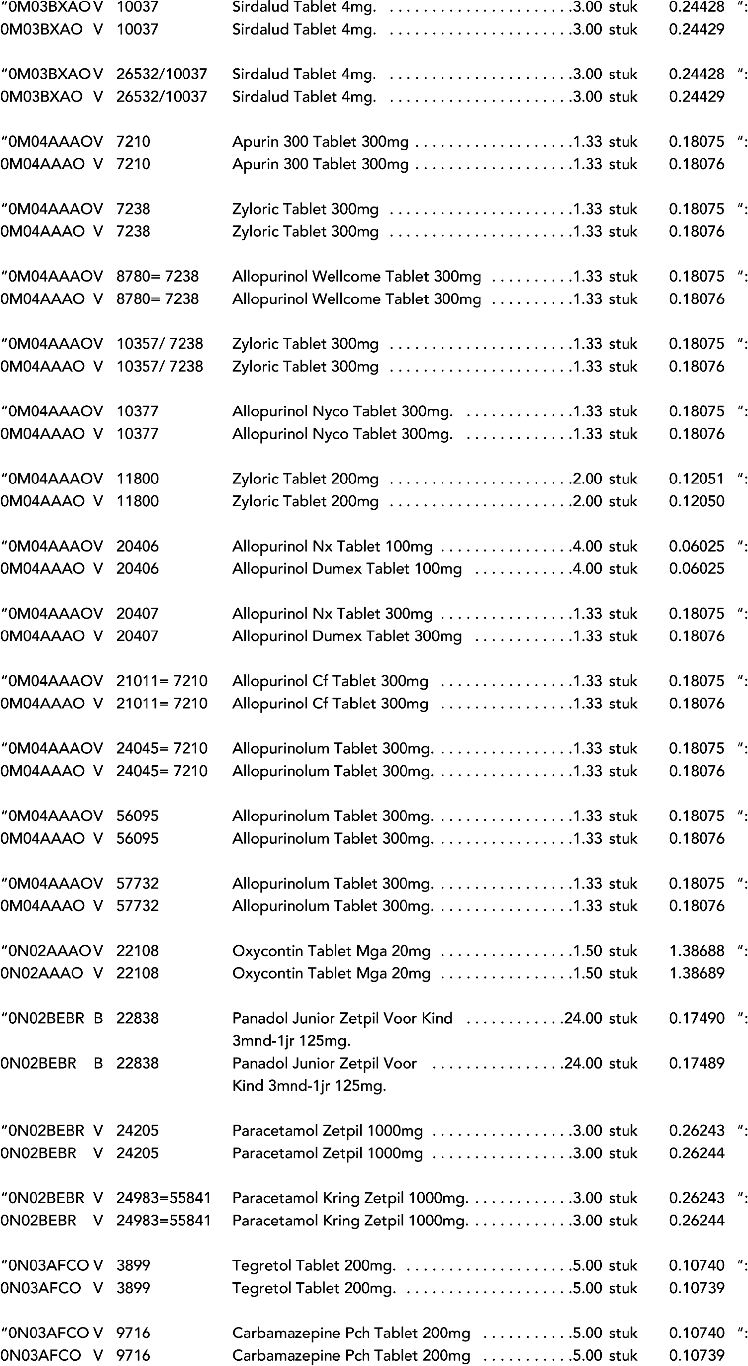
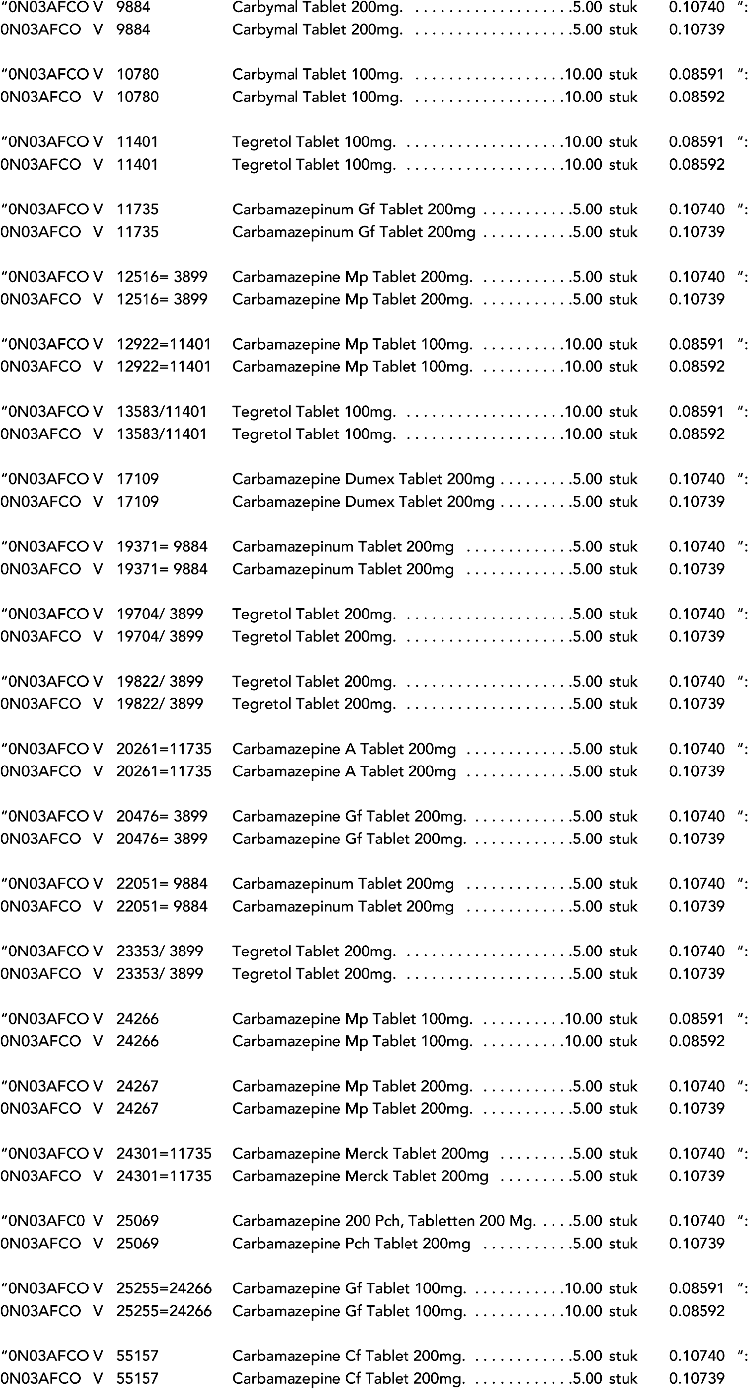
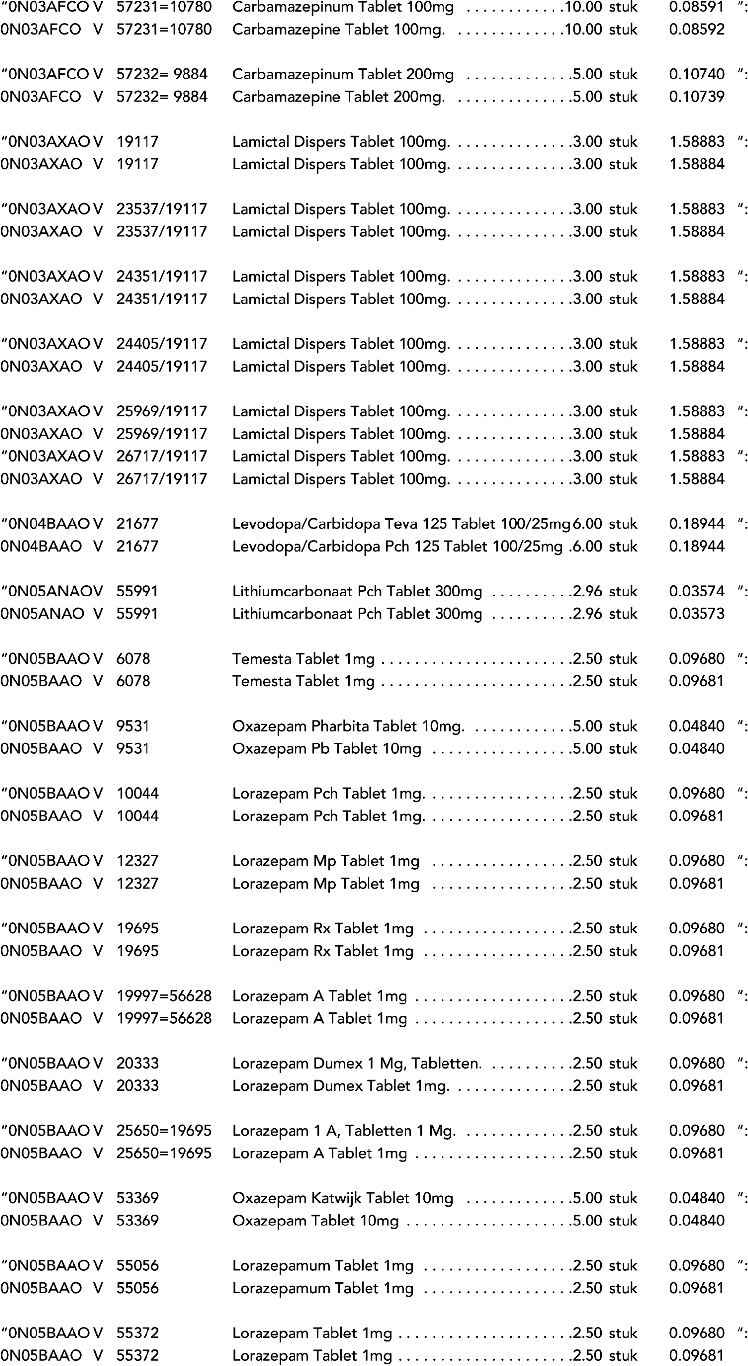
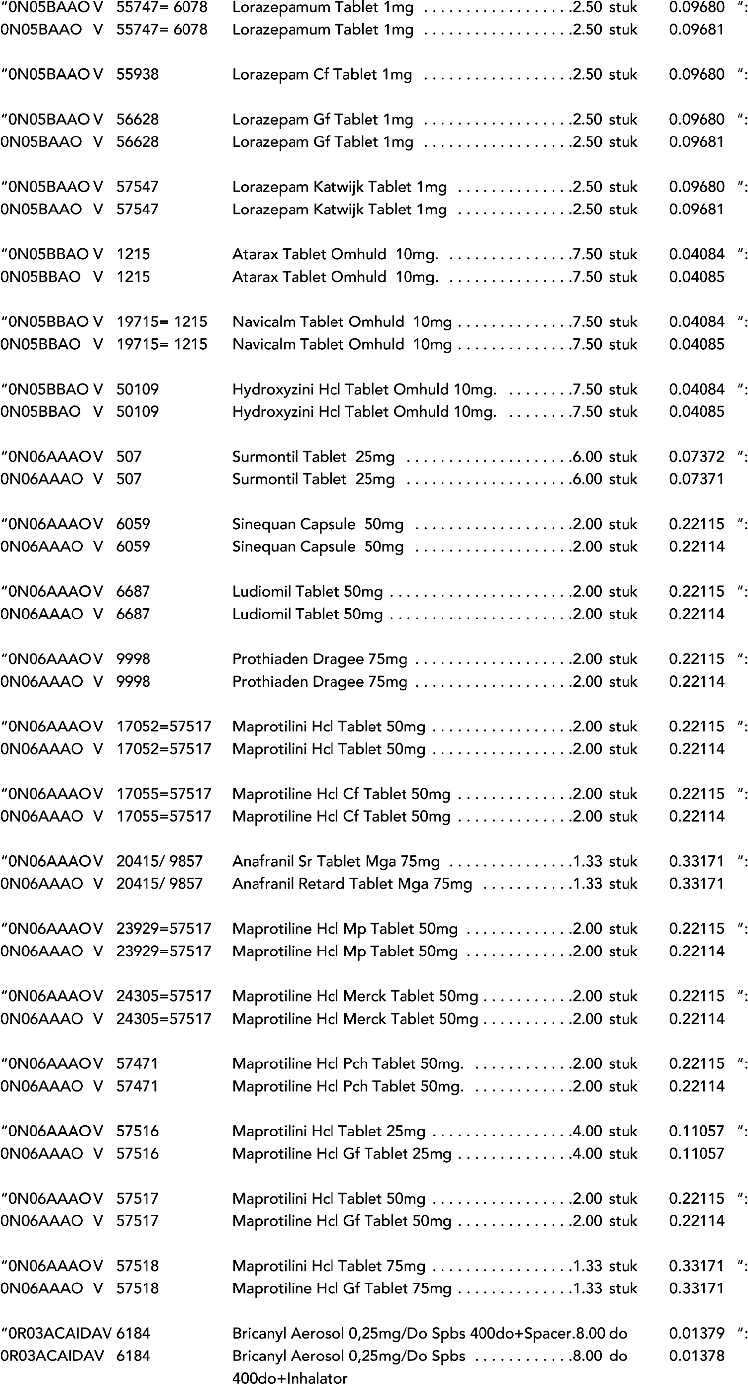
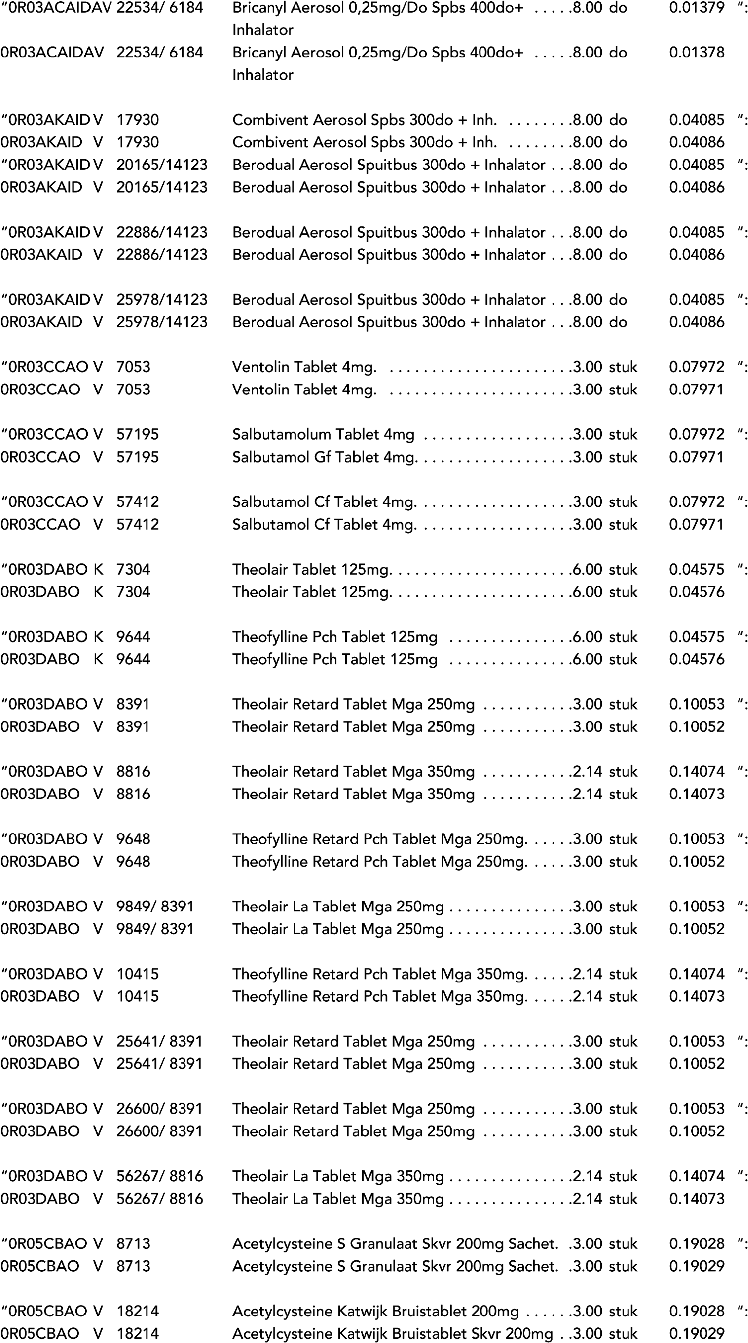
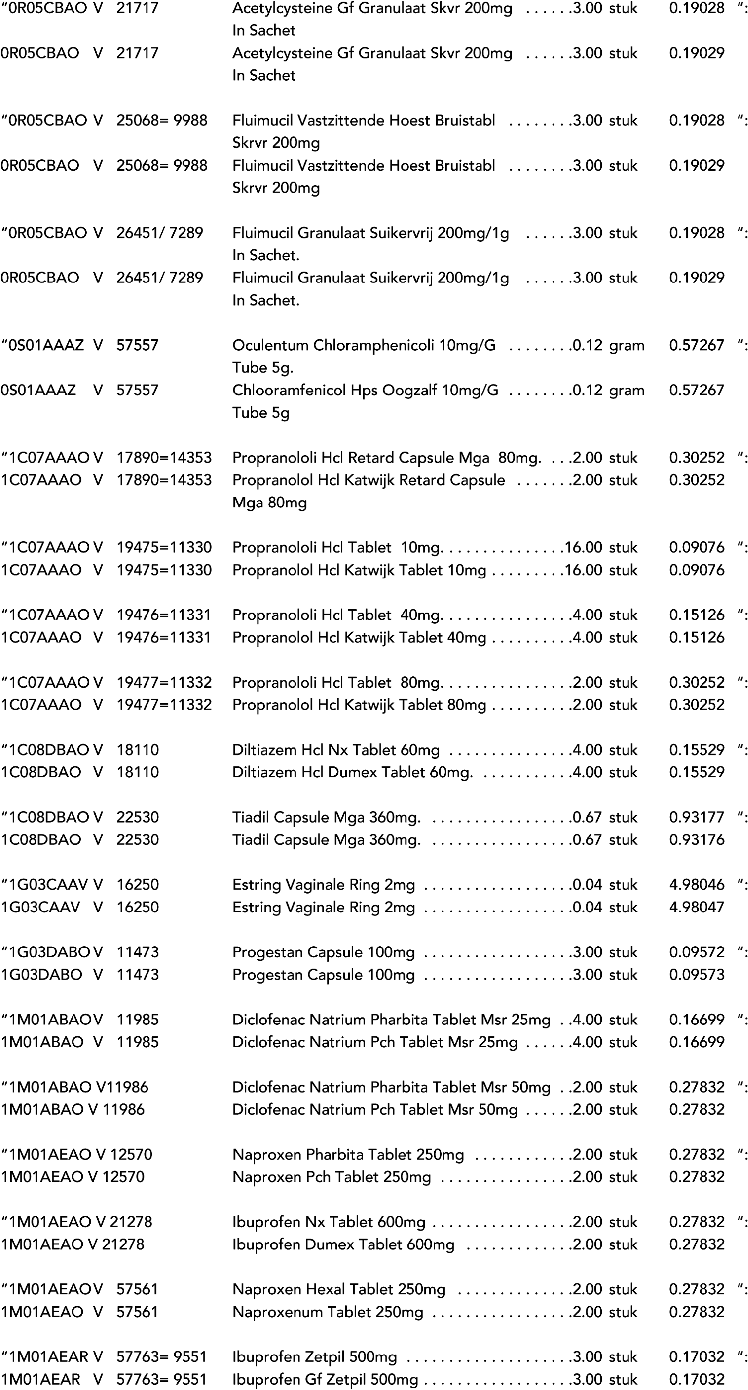
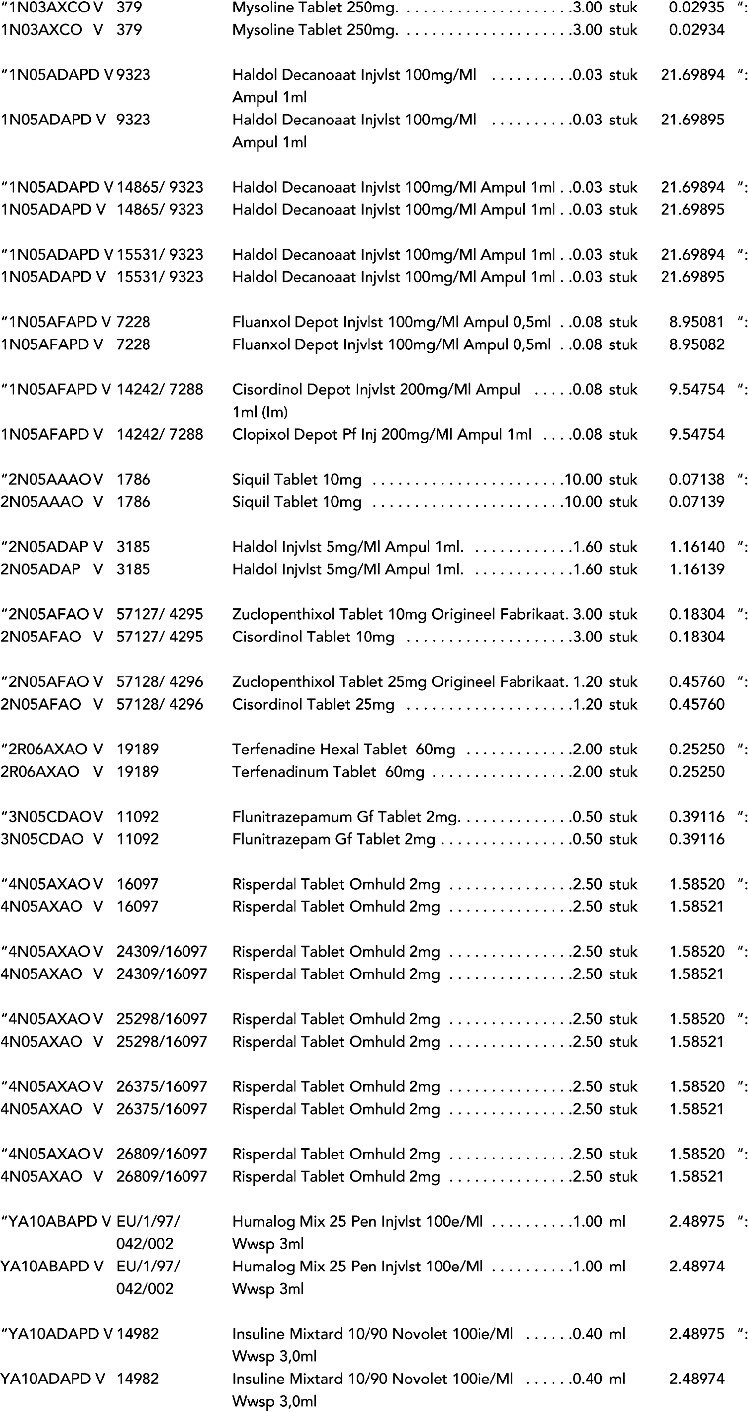
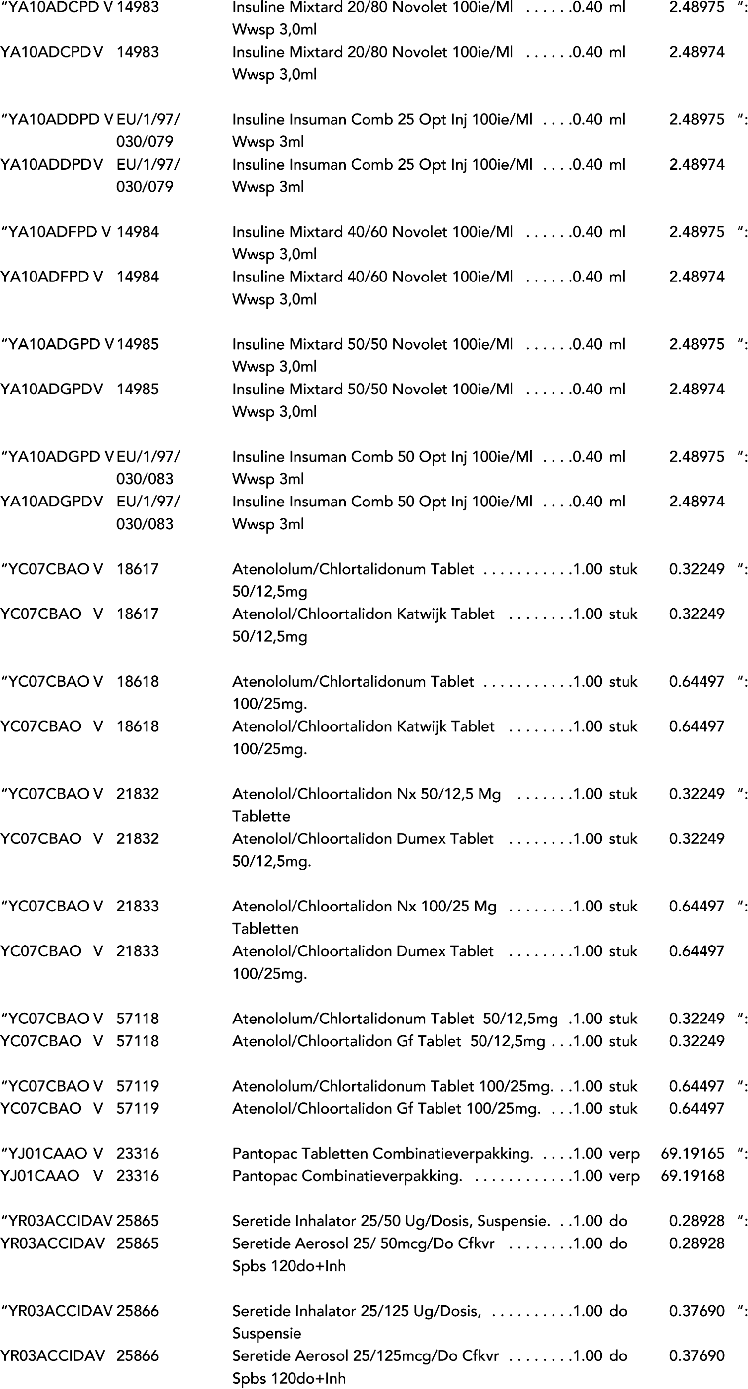
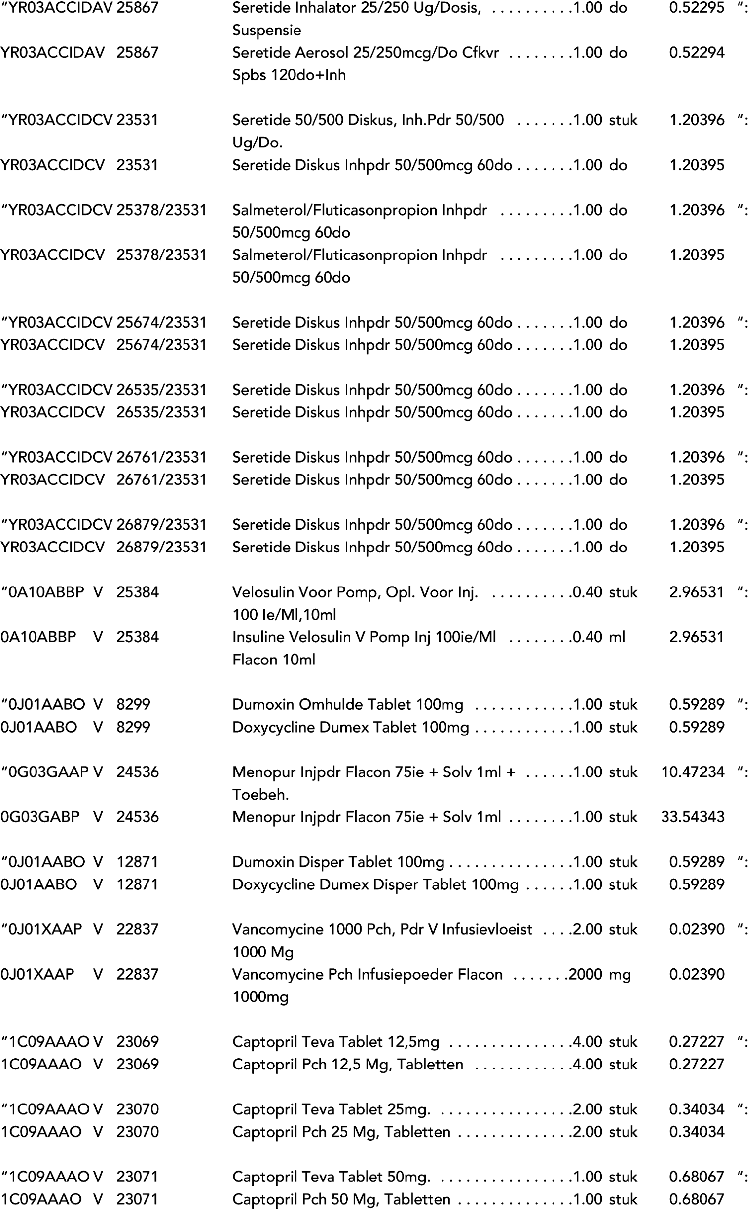
3. In onderdeel A worden de volgende regels verwijderd:

4. In onderdeel B worden de volgende regels opgenomen:

5. In onderdeel B worden de volgende regels verwijderd:

B
Bijlage 2 wordt als volgt gewijzigd:
1. Het opschrift van onderdeel 9 komt te luiden:
9 Erytropoëtine en analoga
2. Onderdeel 19 komt te luiden:
Uitsluitend voor een verzekerde die voor de behandeling met dit middel een algemeen aanvaarde medische indicatie heeft, het middel is voorgeschreven door de behandelend specialist conform het behandelprotocol Alzheimer en het ziekenfonds vooraf toestemming heeft verleend.
Deze regeling treedt in werking met ingang van 1 januari 2002.
Deze regeling zal met de toelichting in de Staatscourant worden geplaatst.
1 Supplement bij Stcrt. 1995, 251, laatstelijk gewijzigd bij ministeriële regeling van 3 december 2001, Z/VU-2237695.
Maandelijks wordt bijlage 1 van de Regeling farmaceutische hulp 1996 gewijzigd. De onderhavige regeling betreft de wijzigingen per 1 januari 2002. Behalve de `normale' uitvoering van het geneesmiddelenvergoedingssysteem is nog een aantal andere wijzigingen aangebracht. Daarop wordt hierna ingegaan.
Met de ministeriële regeling van 3 december 2001, Z/VU-2237695, is bijlage 1, onderdeel A, aangepast in verband met de vervanging van de limieten in de guldenbedragen door eurobedragen. Deze regeling zal binnenkort in een supplement van de Staatscourant bekend worden gemaakt. In de bijlage waren de wijzigingen van onderdeel A die per 1 november 2001 en onderscheidenlijk per 1 december 2001 zijn getroffen, nog niet aangebracht. Dit is eveneens met deze regeling geregeld. Verder zijn met deze regeling nog aantal correcties aangebracht aan bijlage 1, onderdeel A, zoals die met de regeling van 3 december 2001 is komen te luiden.
In de Beleidsvisie Hemofilie van augustus 1999 (Staatscourant nr. 161, pagina 8) heb ik de beleidsvoornemens ten aanzien van de hemofiliezorg in Nederland vastgesteld. Het beleid is erop gericht het proces van concentratie rondom de behandeling, controle en begeleiding van hemofiliepatiënten verder te stimuleren. Door gespecialiseerde behandelcentra die de vereiste specifieke kennis en vaardigheden bezitten hierin een centrale rol te geven, wordt een doeltreffende zorg aan hemofiliepatiënten gewaarborgd. De doelstelling is dat deze centra tevens overzicht houden over de verstrekking van stollingsproducten (haemostatica), een essentieel onderdeel van hemofiliebehandeling. Met dit beleid sluit ik aan bij de opvattingen van de Nederlandse Vereniging van Hemofiliebehandelaren en de Nederlandse Vereniging van Hemofilie Patiënten.
Als gevolg van de beleidsvisie zijn met ingang van 1 januari 2000 16 ziekenhuizen in Nederland aangewezen als Hemofilie Behandelcentrum zoals bedoeld in artikel 8 van de Wet op de Bijzondere Medische Verrichtingen. Deze behandelcentra krijgen de kosten voor zowel intra- als extramuraal toegepaste stollingsproducten volledig vergoed op grond van een beleidsregel van het College tarieven gezondheidszorg van 1 januari 2000. In lijn hiermee dienen ook de aanspraken in het kader van het ziekenfonds- en standaardpakket worden aangepast. Ten gevolge van de beleidsvisie kan de extramurale verstrekking van stollingsproducten worden beschouwd als onderdeel van de aanspraak op medisch-specialistische zorg door of vanwege een ziekenhuis. Teneinde een dubbele aanspraak te vermijden, dient de aanspraak op genoemde stollingsproducten op grond van de Regeling farmaceutische hulp 1996 met ingang van 1 januari 2002 te vervallen. Deze producten zijn derhalve van bijlage 1 verwijderd (artikel I, onderdeel A, subonderdelen 3 en 5).
Overigens laat de wijziging van de aanspraak op extramuraal toegepaste stollingsproducten onverlet dat deze via de openbare apotheek aan patiÎnten kunnen worden afgeleverd teneinde nadelige gevolgen voor de patiënten te vermijden. Ik ga ervan uit dat de betrokken partijen (aangewezen behandelcentra, verzekeraars en apothekers) er zorg voor zullen dragen dat logistieke en financiële aspecten van de extramurale aflevering van stollingsproducten vanaf de genoemde datum door middel van onderlinge afspraken geregeld zullen zijn. Tussen betrokken partijen heeft hierover afstemming plaatsgevonden.
Het College voor zorgverzekeringen (CVZ) heeft in zijn rapport van 3 augustus 2001, Farmacie/21034253, geoordeeld dat darbepoëtine beschouwd kan worden als onderling vervangbaar met epoëtine, het recombinant humaan erytropoëtine. Darbepoëtine is een analogon van erytropoëtine. Om aanspraak te kunnen maken op epoëtine moet de verzekerde voldoen aan de voorwaarden die vermeld staan in onderdeel 9 van bijlage 2 van de Regeling farmaceutische hulp 1996. Gezien de onderlinge vervangbaarheid van beide producten is thans geregeld dat deze voorwaarden ook van toepassing zijn op het tot gelding brengen van de aanspraak op darbepoëtine.
Sinds 1 januari 1999 is het geneesmiddel rivastigmine opgenomen op bijlage 2 van de Regeling farmaceutische hulp 1996. Aanleiding om nadere voorwaarden aan de aanspraak op rivastigmine te stellen, waren de verwachte omvang van het gebruik en de eisen die aan diagnostiek en behandeling dienen te worden gesteld. Tegelijkertijd heb ik de toenmalige Ziekenfondsraad gevraagd te rapporteren over een behandelprotocol dat wordt gedragen door behandelaren en de patiëntenbelangenvereniging.
Het CVZ heeft mij bij brief van 28 september 2000, Farmacie/20046717, het rapport `De ziekte van Alzheimer, diagnostiek en medicamenteuze behandeling; richtlijnen voor de praktijk' aangeboden. Aan het rapport hebben vertegenwoordigers van de diverse beroepsverenigingen en de Stichting Alzheimer Nederland meegewerkt.
Volgens het behandelprotocol dat deel uit maakt van de rapportage verdient het, gegeven de complexiteit van het dementiesyndroom en de zich nog steeds ontwikkelende diagnostiek, de voorkeur de diagnostiek geprotocolleerd plaats te laten vinden binnen gespecialiseerde, multidisciplinaire teams. Verder dienen artsen die rivastigmine voorschrijven te beschikken over expertise met betrekking tot het interpreteren van meetresultaten.
Ik heb besloten de aanspraak op rivastigmine te verbinden aan de voorwaarde dat behandeling plaats vindt conform het door het CVZ opgestelde behandelprotocol. Met de onderhavige regeling heb ik daartoe het desbetreffende onderdeel (onderdeel 19) op bijlage 2 van de Regeling farmaceutische hulp 1996 gewijzigd.
Het protocol is inmiddels door zowel het CVZ, de beroepsverenigingen, Zorgverzekeraars Nederland en de patiëntenbelangenvereniging verspreid en geïmplementeerd. Het CVZ heeft toegezegd het protocol na twee tot drie jaar op effectiviteit en bruikbaarheid te evalueren en in overleg met de diverse partijen te actualiseren, indien daartoe aanleiding bestaat.
De Minister van Volksgezondheid, Welzijn en Sport,
E. Borst-Eilers.
Kopieer de link naar uw clipboard
https://zoek.officielebekendmakingen.nl/stcrt-2001-250-p74-SC32567.html
De hier aangeboden pdf-bestanden van het Staatsblad, Staatscourant, Tractatenblad, provinciaal blad, gemeenteblad, waterschapsblad en blad gemeenschappelijke regeling vormen de formele bekendmakingen in de zin van de Bekendmakingswet en de Rijkswet goedkeuring en bekendmaking verdragen voor zover ze na 1 juli 2009 zijn uitgegeven. Voor pdf-publicaties van vóór deze datum geldt dat alleen de in papieren vorm uitgegeven bladen formele status hebben; de hier aangeboden elektronische versies daarvan worden bij wijze van service aangeboden.
