Kamerstuk
| Datum publicatie | Organisatie | Vergaderjaar | Dossier- en ondernummer |
|---|---|---|---|
| Tweede Kamer der Staten-Generaal | 2020-2021 | 32805 nr. 109 |
Zoals vergunningen, bouwplannen en lokale regelgeving.
Adressen en contactpersonen van overheidsorganisaties.
U bent hier:

| Datum publicatie | Organisatie | Vergaderjaar | Dossier- en ondernummer |
|---|---|---|---|
| Tweede Kamer der Staten-Generaal | 2020-2021 | 32805 nr. 109 |
Aan de Voorzitter van de Tweede Kamer der Staten-Generaal
Den Haag, 9 oktober 2020
Medische hulpmiddelen zijn niet meer weg te denken uit de gezondheidszorg en worden toegepast in alle zorgdomeinen: preventie, diagnostiek, curatieve en langdurige zorg. Dankzij hulpmiddelen worden mensen dagelijks geholpen bij een veelheid aan gezondheidsproblemen. Of het nu gaat om het plakken van een pleister op een kleine wond, complexe diagnostiek met een MRI-scanner, arbeidsparticipatie met behulp van een cochleair implantaat, of het vergroten van de mobiliteit door een rolstoel: medische hulpmiddelen dragen voor een belangrijk deel bij aan concrete verbetering van de kwaliteit van leven. De Nederlandse hulpmiddelenmarkt heeft een omvang van ongeveer € 4,7 miljard.1 Dat is zo’n 5% van de totale zorguitgaven in Nederland. Het overgrote deel van het gebruik van medische hulpmiddelen (zo’n 85%) wordt in Nederland vergoed, vooral uit de Zorgverzekeringswet of Wmo 2015. Aan het gebruik van deze producten kunnen natuurlijk wel altijd risico’s kleven. Dat is helaas maar al te duidelijk geworden door de verschillende incidenten die de laatste jaren bekend zijn geworden, vooral die met implantaten. Patiënten hebben soms te maken met veel leed en pijn, zonder uitzicht op verbetering. Dat is hartverscheurend. Net zoals bij mijn voorganger staat de veiligheid van implantaten dus hoog op mijn agenda. De uitdaging is dan om risico’s zoveel mogelijk te beperken, zonder dat daardoor de innovatie ten behoeve van de patiënt wordt beperkt.
Het is even geleden dat uw Kamer is geïnformeerd over het medische hulpmiddelenbeleid. Dat komt door de coronapandemie. Bij de aanpak van het coronavirus is veel aandacht uitgegaan naar corona gerelateerde medische hulpmiddelen. Denk aan chirurgische maskers, testmaterialen en beademingsapparatuur. Uw Kamer is hierover regelmatig door mij en mijn ambtsvoorgangers geïnformeerd. Deze recente ontwikkelingen betekenen ook dat we het laatste halfjaar minder energie hebben kunnen besteden aan andere onderdelen van het hulpmiddelenbeleid. Ter voorbereiding op het Algemeen Overleg medische hulpmiddelen en geneesmiddelen van 15 oktober a.s. bericht ik u over de stand van zaken van specifiek het hulpmiddelenbeleid.2 Ik zal daarbij aangeven als activiteiten door de coronapandemie vertraging hebben opgelopen.
Leeswijzer
Ik zal u eerst informeren over de veiligheid van implantaten. Hierna zal ik mij richten op initiatieven gericht op de langere termijn, de aanspraak en bekostiging van medische hulpmiddelen en tenslotte op de voortgang van de implementatie van de MDR-IVDR.
Veiligheid van implantaten
Mesh
In de Kamerbrief over de verschillende typen mesh implantaten van 17 februari 20203 heeft mijn ambtsvoorganger u geïnformeerd over de acties die in samenwerking met de IGJ (en haar buitenlandse collega-toezichthouders), het RIVM, de Nederlandse Vereniging voor Obstetrie en Gynaecologie en cliënt- en patiëntorganisaties worden ondernomen op het gebied van mesh-implantaten. Zoals in de brief destijds gemeld is het RIVM in opdracht van de IGJ bezig met dossier- en laboratoriumonderzoek naar transvaginale en transabdominale mesh voor de behandeling van bekkenbodemverzakking. Momenteel bevindt het dossieronderzoek zich in de afrondende fase en het is de verwachting dat de resultaten voor het einde van het jaar worden gepubliceerd. Het laboratoriumonderzoek heeft meer vertraging opgelopen en zal naar verwachting in 2021 worden gepubliceerd. Als gevolg hiervan is het onderzoek naar andere mesh implantaten ook vertraagd. Het RIVM is bezig met het formuleren van eenzelfde soort onderzoek naar overige mesh-implantaten (incontinentieslings, buikwand- en liesbreukmatten). De verwachting is dat dit onderzoek voor het einde van het jaar zal starten. Resultaten zullen niet eerder dan 2022 worden verwacht.
De nazorg voor patiënten met een mesh implantaat en langdurige gezondheidsklachten moet goed georganiseerd zijn. Mijn voorganger heeft de betrokken beroepsgroepen gevraagd om een leidraad op te stellen met een overzicht van de goede nazorg behandelingen die nu al beschikbaar zijn. Het streven was om de leidraad begin 2021 gereed te hebben. Vanwege de coronapandemie konden de beroepsgroepen echter geen prioriteit geven aan de leidraad. De leidraad zal daarom later gereed zijn. Er zijn wel goede stappen gezet bij de ontwikkeling van een patiënten brochure over nazorg. De brochure zal specifiek ingaan op de momenteel beschikbare verschillende behandelmogelijkheden voor nazorg, en aangeven waar patiënten terecht kunnen als zij klachten ervaren. Zowel patiëntenorganisatie Bekkenbodem4All als lotgenotenorganisatie MeshedUp zijn betrokken. De brochure zal volgens planning dit najaar gereed zijn.
Tot slot is aangekondigd dat het RIVM een onderzoek doet naar het inzichtelijk krijgen van de patiëntenpopulatie met een mesh implantaat en langdurige gezondheidsklachten en het inzichtelijk krijgen van passende zorg voor deze patiënten. De resultaten zouden in de tweede helft van 2021 worden opgeleverd. Het RIVM heeft door de coronapandemie echter andere werkzaamheden voorrang moeten geven. Het streven is om de onderzoeksresultaten in de eerste helft van 2022 te publiceren.
Kwaliteitsregisters
In de hierboven genoemde Kamerbrief over de verschillende typen mesh implantaten heeft mijn ambtsvoorganger toegezegd u te informeren over de voortgang van de kwartiermaker over de governance van kwaliteitsregistraties. Het advies van de kwartiermaker heb ik onlangs met uw Kamer gedeeld4. De partijen van het Hoofdlijnenakkoord Medisch Specialistische Zorg hebben op 16 juli 2020 ingestemd met de aanbevelingen. In de komende maanden zullen de genoemde partijen de implementatie van de voorgestelde maatregelen verder oppakken. Zoals aangegeven zal ik uw Kamer later verder informeren over de uitwerking hiervan.
Dit advies van de kwartiermaker en de implementatie ervan is ook belangrijk in het licht van de motie van het lid Van den Berg c.s. over een kwaliteitsregister voor implantaten (Kamerstuk 35 043, nr. 21). Eerder heeft mijn ambtsvoorganger u gemeld dat de Federatie Medisch Specialisten (FMS) gesprekken met desbetreffende wetenschappelijke verenigingen zou voeren over het al dan niet opzetten van een kwaliteitsregister voor implantaten.
Ook vroeg de motie om het verbinden van de verschillende registers die er op dit moment bestaan, waaronder het LIR, Eudamed, het MEBI en de verschillende kwaliteitsregisters. Ik heb het RIVM gevraagd om te kijken op welke manier dit mogelijk zou kunnen zijn en hoe de informatie uit de verschillende registers het beste uitgewisseld kan worden. Helaas hebben de verschillende onderdelen, waaronder de gesprekken en de uitwerking daarvan, vertraging opgelopen door de coronapandemie. Ik streef ernaar u aan het einde van het jaar een update over deze motie te kunnen sturen.
Controle documentatie
Naar aanleiding van het AO Hulpmiddelenbeleid van 27 november 2019 (Kamerstuk 32 805, nr. 101) is een motie van het lid Van Gerven aangenomen (Kamerstuk 32 805, nr. 89), waarin de regering wordt verzocht de inspectie de taak op te leggen tot een steekproefsgewijze controle en beoordeling van de documentatie die ten grondslag heeft gelegen aan markttoegang voor een implantaat.
Het controleren van documentatie die ten grondslag ligt aan de markttoelating, maakt op dit moment al onderdeel uit van het toezicht op implantaten. De inspectie vraagt fabrikanten en notified bodies regelmatig om technische documentatie en inzicht in de klinische onderbouwing van een implantaat, bijvoorbeeld in het kader van het toezicht op het werk van notified bodies of de onderzoeken die het RIVM voor de IGJ uitvoert naar bepaalde typen implantaten. Zo nodig neemt de inspectie maatregelen. Gaat het om een buitenlands bedrijf, dan vraagt de inspectie de toezichthouder in dat land om maatregelen te nemen. Omdat hier sprake is van Europese samenwerking, werkt de inspectie in het toezicht ook veel samen met andere toezichthouders van de EU-lidstaten.
Audit Landelijk Meldpunt Zorg
In voornoemd AO Hulpmiddelenbeleid heeft mijn ambtsvoorganger toegezegd om een audit uit te laten voeren naar de bereikbaarheid en reactie van het Landelijk Meldpunt Zorg (LMZ), onderdeel van de IGJ. Dit vanwege signalen dat patiënten aangeven onvoldoende gehoord te worden als zij klachten hebben gerelateerd aan een implantaat. Dit onderzoek heeft vanwege de coronapandemie vertraging opgelopen, onder meer omdat hierdoor de periode van het voorjaar van 2020 niet representatief was. Inmiddels zijn de voorbereidingen weer opgestart. Onder voorbehoud van het verdere verloop van de coronapandemie, vindt de audit dit najaar plaats en ik ben voornemens de resultaten daarna aan uw Kamer toe te sturen.
Verantwoordelijkheid en aansprakelijkheid arts en ziekenhuis
Ook tijdens het AO Hulpmiddelenbeleid van 27 november 2019 heeft mijn ambtsvoorganger naar aanleiding van vragen van de fractie van SP, toegezegd een brief te sturen over het vraagstuk van verantwoordelijkheid en aansprakelijkheid van een arts bij het gebruik van een hulpmiddel/implantaat.
Op 19 juni 2020 heeft de hoogste rechtbank van Nederland, de Hoge Raad, uitspraak gedaan in twee zaken over de aansprakelijkheid van arts en ziekenhuis voor schade die is geleden door een medisch implantaat (ECLI:NL:HR:2020:1090 en ECLI:NL:HR:2020:1082). In beide gevallen heeft de Hoge Raad geoordeeld dat de arts en het ziekenhuis niet aansprakelijk kunnen worden gehouden.
In de eerste zaak ging het om een patiënte die schade had geleden als gevolg van een bij haar in 2000 geplaatst PIP-borstimplantaat. Zij stelde het ziekenhuis aansprakelijk voor de geleden schade. Bij de fabricage en keuring van de PIP-borstimplantaten, die tussen 2000 en 2010 wereldwijd veelvuldig werden gebruikt, was door de Franse producent gedurende een aantal jaren op grote schaal gefraudeerd. Bij de fabricage werd gebruik gemaakt van industriële (in plaats van medische) siliconen, en daarnaast misleidde de producent de keuringsinstanties. PIP-implantaten hadden namelijk een grotere kans op scheuren en lekken.
De Hoge Raad heeft nu geoordeeld dat een arts en een ziekenhuis niet aansprakelijk zijn voor schade bij patiënten die het gevolg zijn van door fraude veroorzaakte ondeugdelijkheid van de PIP-borstimplantaten. De Hoge Raad oordeelde dat het ziekenhuis wel een tekortkoming heeft begaan in de medische behandelovereenkomst, maar dat de tekortkoming niet aan het ziekenhuis kan worden toegerekend en daarmee niet voor rekening van het ziekenhuis komt. Dit heeft onder andere te maken met het feit dat het hier ging om ernstige fraude door de producent, dat Nederlandse ziekenhuizen zich maar in beperkte mate tegen dergelijke schade kunnen verzekeren en dat door het faillissement van de fabrikant de kosten van de schade ook niet meer te verhalen zouden zijn door het ziekenhuis.
In de andere zaak ging het om een patiënt die in 1992 geopereerd was in verband met een netvliesloslating. Daarbij is een zogeheten «Miragelplombe» (hiermee wordt het netvlies aangedrukt na een operatie) in het oog aangebracht. Na het ontstaan van complicaties is het implantaat uiteindelijk verwijderd. Jaren later bleek dat de Miragelplombe ongeschikt is voor dergelijk gebruik vanwege het risico op complicaties. De patiënt heeft vervolgens het ziekenhuis aansprakelijk gesteld voor de schade die door de plombe was ontstaan en het gerechtshof Arnhem-Leeuwarden heeft dat bekrachtigd.
Het ziekenhuis ging tegen de uitspraak van het hof in cassatie bij de Hoge Raad. De Hoge Raad heeft op 19 juni 2020 geoordeeld dat het gerechtshof ten onrechte heeft aangenomen dat het niet uit zou maken of ten tijde van de operatie de plombe «state of the art» was. Als bij een behandeling een implantaat in het lichaam van de patiënt wordt gebracht die op dat moment «state of the art» is, wordt het gebruik van dat implantaat geen tekortkoming alleen maar omdat later door nieuwe medische inzichten blijkt dat die zaak voor deze behandeling ongeschikt was, aldus de Hoge Raad. De Hoge Raad trekt bij haar oordeel een parallel met een behandeling van een arts en concludeert «dit strookt ermee dat evenmin een tekortkoming bestaat indien een arts een behandeling toepast die op dat moment naar gangbare medische inzichten de juiste is, maar die nadien als gevolg van nieuw opgekomen medische inzichten niet langer als state of the art wordt beoordeeld. (rechtsoverweging 3.2.2.)».
Door middel van beide uitspraken vult de Hoge Raad de letter van de wet – over de mogelijke aansprakelijkheid van een arts bij het gebruik van een implantaat – verder in. Uiteraard worden in een specifieke zaak ook altijd de omstandigheden van het geval meegewogen. Kort gezegd concludeer ik uit de verschillende uitspraken van het hof als de Hoge Raad dat een arts of ziekenhuis niet achteraf aansprakelijk kan worden gesteld voor schade door een implantaat, indien op het moment dat het implantaat gezet werd er geen aanleiding was om aan te nemen dat het om een gebrekkig of niet geschikt implantaat ging.
Acties voor de langere termijn en HI-NL
In de voortgangsbrief van 22 november 2019 en de visie op medische technologie5, heeft mijn ambtsvoorganger aangekondigd om in het voorjaar van 2020 met een Nationale Agenda MedTech te komen. De huidige omstandigheden en uitdagingen waar wij voor staan in het kader van de coronapandemie, hebben mij doen besluiten om voor dit moment te kiezen voor een pragmatische insteek. Dit betekent dat ik mij zal richten op een beperkt aantal concrete acties die u in bijgaand overzicht aantreft6.
Ik vind het van belang om naast de korte termijn, waarin de aandacht grotendeels is gericht op diagnostiek, behandeling en het voorkomen van verdere verspreiding van COVID-19, ook aandacht te hebben voor vraagstukken op de langere termijn. Als er immers juist één ding is benadrukt door de coronapandemie is het wel het belang van medische technologie en hulpmiddelen voor het waarborgen van de continuïteit van zorg. Of het nu gaat om IC-apparatuur, mondmaskers of bloedtesten: de beschikbaarheid van medische producten zoals deze is van vitaal belang gebleken voor het redden van levens en het beschermen en ondersteunen van zorgpersoneel.
Ook voor de lange termijn kan MedTech een belangrijke bijdrage leveren aan goede zorg voor patiënten. Slimme technologische oplossingen, zoals «wearables» voor leefstijlmonitoring en sensortechnologie om langer thuis te kunnen blijven wonen, kunnen van meerwaarde zijn bij de toenemende vergrijzing, waarbij mensen vaker meerdere aandoeningen tegelijk hebben en behoefte hebben aan meer eigen regie. De inzet van technologie zoals kunstmatige intelligentie en robotica kan de zorg ook minder arbeidsintensief maken waardoor zorgverleners meer tijd kunnen besteden aan patiëntencontact. Technologie kan zelfs een deel van de oplossing zijn voor het personeelstekort in de zorg. Kortom, een toekomstbestendig zorgstelsel is mede afhankelijk van snelle beschikbaarheid en flexibele productie van MedTech die op de juiste manier wordt ingezet. De grote uitdaging is hoe onze samenleving hier maximaal baat bij kan hebben en hoe we tegelijkertijd de risico’s ondervangen van medische technologie en hulpmiddelen die te duur zijn (niet kosteneffectief) of te weinig meerwaarde bieden.
Bijgaand overzicht (zie bijlage) met acties is een weergave van de vele gesprekken die zijn gevoerd met een brede vertegenwoordiging uit de sector, zoals patiënten, zorgverleners, verzekeraars, fabrikanten en kennisinstellingen. Ik zal in gesprek blijven met de sector om deze acties de komende tijd verder te brengen.
Health Innovation Netherlands (HI-NL)
Mijn ambtsvoorganger heeft toegezegd de eerste resultaten van het initiatief Health Innovation Netherlands (HI-NL, voorheen Hii Holland) met uw Kamer te delen. Tot nu toe zijn acht zogenoemde ronde tafels met innovators (variërend van startups tot kleine en grotere bedrijven) en andere relevante partijen (o.a. patiënten, zorgverzekeraars, zorgverleners en het Zorginstituut) georganiseerd. Voor dit jaar staan nog vier tafels in de planning. De tafels hebben de innovators expertise en inzicht geboden in hoe het zorglandschap werkt en waar innovaties aan moeten voldoen. Andersom hebben de tafels bij o.a. patiënten, zorgverleners en verzekeraars beter begrip opgeleverd voor de innovaties.
De innovaties betroffen een implantaat, een chirurgische innovatie, medische diagnostische en prognostische testen, medische apps en eHealth innovaties in de gebieden kanker, oogheelkunde, niertransplantatie, chirurgie, infectie, hart-en-vaatziekten en COVID-19.
Ik geef u graag twee voorbeelden:
1. 3D printen voor chirurgische mallen: de vraag van de innovator aan HI-NL was wat nodig was voor markttoelating (CE-markering) van deze technologische innovatie. Uitdaging daarbij vormt de strengere aankomende Europese regelgeving (Medical Devices Regulation, MDR) en dan specifiek de regels die gaan gelden voor naar maat gemaakte (3D geprinte) medische hulpmiddelen. HI-NL heeft in dat licht geadviseerd over de risicoclassificering van het hulpmiddel en de noodzakelijke bewijslast voor markttoelating van deze specifieke innovatie.
2. Prognostische test voor hematologische kanker: hier was de vraag van de innovator hoe zijn reeds tot de markt toegelaten product in de zorgrichtlijnen en zorgpraktijk geïmplementeerd en opgeschaald kan worden. De betrokken experts van HI-NL hebben een aantal vervolgstudies voorgesteld hoe de nodige bewijslast geleverd kan worden om o.a. patiënten, zorgverleners en verzekeraars te overtuigen van de meerwaarde van de innovatie. Dit heeft de innovator geholpen bij het verdere onderzoek en de te nemen stappen naar implementatie en opschaling.
Ik vind het heel positief om te constateren dat patiënten direct en actief betrokken zijn bij de ronde tafels van HI-NL. Zo is de Patiëntenfederatie een formele partner van HI-NL en selecteren zij samen zorgvuldig patiënten-experts om de stem van de patiënt voor die betreffende innovatie te verwoorden. De inbreng van patiënten wordt op dezelfde manier meegenomen in het eindadvies als dat van alle andere betrokken partijen.
Aanspraak en bekostiging
Bestuurlijk Overleg Hulpmiddelenzorg
Het Bestuurlijk Overleg Hulpmiddelenzorg (BOH) is bedoeld om de Zorgverzekeringswet (Zvw) hulpmiddelenzorg voor de gebruiker merkbaar beter te maken. In het BOH maken bestuurders van patiënten-vertegenwoordigers, zorgaanbieders en zorgverzekeraars afspraken die onder andere worden verwerkt in kwaliteitsstandaarden. Tijdens het laatste BOH is besproken waarom het implementeren van die standaarden in de praktijk soms moeizaam verloopt. Er is afgesproken dat betrokken partijen met elkaar in gesprek gaan om obstakels weg te nemen en in een volgend BOH daarover te rapporteren. Die obstakels komen vooral voort uit een gebrek aan transparantie over de beoogde kwaliteit en daaruit volgende overeenkomsten met zorgaanbieders. Het eerstvolgend BOH is gepland op 4 november aanstaande. In 2019 zijn tevens twee nieuwe platforms gestart met het ontwikkelen van een kwaliteitsstandaard, namelijk voor prothese- en voor compressiezorghulpmiddelen. Deze kwaliteitstandaarden worden dit jaar ter autorisatie aan het Zorginstituut aangeboden.
Hoorzorg
In het eerder genoemde AO hulpmiddelenbeleid van 27 november 2019 heeft mijn ambtsvoorganger toegezegd om u het verslag van de Dialooogtafel Hoorzorg toe te sturen. In januari, juli en september 2020 heeft een dialoog met veldpartijen binnen de hoorzorg plaatsgevonden. Betrokken organisaties, waaronder vertegenwoordigers van patiënten, audiciens, en zorgverzekeraars werken momenteel aan een informatiebrochure bedoeld om de cliënt goed te informeren over het proces van verstrekking van een hoortoestel. Met deze brochure kan de cliënt goed geïnformeerd een keuze maken en weet hij wat de vergoedingsregelingen zijn. Daarnaast is aandacht besteed aan de effecten van de coronapandemie en implementatie van het kwaliteitsprotocol 2.0 per 2021. De partijen zijn in goed overleg om de knelpunten hiervoor op te lossen en de kwaliteit van hoorzorg samen te borgen.
Innovatieve hulpmiddelen
De Kamer heeft naar aanleiding van het laatste AO Hulpmiddelen van
27 november 2019 per motie verzocht om de vergoedingsrichtlijnen voor hulpmiddelen tegen het licht te laten houden zodat innovatieve hulpmiddelen snel bij de patiënt terechtkomen7.
Als uitgangspunt bij de instroom van alle hulpmiddelen, zoals innovatieve hulpmiddelen, is in de Zvw opgenomen dat medische hulpmiddelen die voldoen aan de pakketcriteria automatisch tot het Zvw pakket behoren. Het effectiviteit criterium «stand van wetenschap en praktijk» is daarin doorslaggevend.
In eerste instantie bepalen zorgverleners en zorgverzekeraars zelf of een innovatief medisch hulpmiddel – naar stand van wetenschap en praktijk – bewezen effectief is en tot het basispakket behoort. Mochten zij er onderling niet uitkomen, dan kan het Zorginstituut Nederland (hierna: Zorginstituut) duidelijkheid verschaffen met een standpunt. Daarnaast kan het Zorginstituut zelfstandig een standpunt innemen over wat tot de verzekerde zorg behoort. Het Zorginstituut verzoekt partijen daarbij alle beschikbare en actuele gegevens over onderzoeken en de toepassing in de praktijk aan te reiken, waarna zij dit in het licht van de Zvw beoordelen. Het innemen van standpunten is een wettelijke bevoegdheid van het Zorginstituut en behoeft geen aanpassing van de wet.
In de Regeling zorgverzekering (Rzv), waarmee wordt geregeld hoe de Zvw uitgevoerd moet worden, is gekozen om de aanspraak op hulpmiddelen grotendeels functiegericht te omschrijven. Dat betekent dat aanspraak in algemene termen is beschreven en dat er geen sprake is van een limitatieve opsomming van (bestaande) hulpmiddelen. Uitgangspunt bij de hulpmiddelenzorg is dat hulpmiddelen bepaalde functioneringsprobleem als gevolg van een stoornis kunnen opheffen of compenseren. Tot de aanspraak behoren hulpmiddelen die een functioneringsprobleem adequaat compenseert wanneer iemand daar redelijkerwijs op aangewezen is. Deze formulering biedt ruimte voor innovatieve hulpmiddelen die aan de pakketcriteria voldoen. Voor de juiste invulling zijn door het veld ontwikkelde kwaliteitsstandaarden essentieel.
Het al dan niet snel beschikbaar komen van een innovatief medisch hulpmiddel ligt dus vooral bij de aanbieder (de fabrikant) van het hulpmiddel en of deze zorgverleners en zorgverzekeraars weet te overtuigen dat het hulpmiddel voldoet aan de stand van wetenschap en praktijk. Dit betekent dat het hulpmiddel bewezen effectief is (evidence based) op basis van het best beschikbare bewijsmateriaal.
Ik vind dit in de basis een goed uitgangspunt. Er zijn heel veel medische hulpmiddelen en er komen steeds meer innovaties op de markt waarbij verantwoorde keuzes moeten worden gemaakt. Het is zowel voor de patiënt als voor de premiebetaler immers onwenselijk dat niet-effectieve of ondoelmatige hulpmiddelen in het pakket worden opgenomen. Innovatieve hulpmiddelen moeten daarom bewezen meerwaarde hebben en aansluiten op de maatschappelijke of medische behoeften. Dat is juist ook een van de doelstellingen van de acties gericht op de langere termijn die ik hierboven en in de bijlage heb beschreven. Tegelijkertijd signaleer ik een spanningsveld omdat we willen voorkomen dat zinvolle innovaties onnodig langzaam in het pakket worden opgenomen.
Daarom laat ik voor de sector een overzicht opstellen van gepaste methoden om de veiligheid en (kosten)effectiviteit van MedTech innovaties aan te tonen. Ook laat ik in het kader van de kaderwetevaluatie van het Zorginstituut onderzoeken of het Zorginstituut bij het uitvoeren van zijn rol als pakketbeheerder voldoende inspeelt op nieuwe ontwikkelingen zodat de wijze van beoordeling en pakkettoelating voldoende waarborgen dat ook in de toekomst effectieve en innovatieve hulpmiddelen het pakket instromen. De uitkomsten van de kaderwetevaluatie verwacht ik voor het einde van het jaar aan uw Kamer toe te sturen.
Uitbreiding Continue Glucose Monitoring (CGM)
De kamer heeft gevraagd of de aanspraak op real-time Continue Glucose Monitoring (rt-CGM) niet kan worden uitgebreid8. Op uw verzoek heb ik met het Zorginstituut gesproken over hun standpunt. Volgens het standpunt van het Zorginstituut bestaat nu aanspraak op CGM bij onderstaande indicaties:
– Kinderen met diabetes type 1;
– Volwassenen met slecht ingesteld diabetes type 1 (ondanks standaard controle blijvend hoog HbA1c (>8% of >64 mmol/mol));
– Zwangere vrouwen met diabetes type 1 en 2 (geen zwangerschapsdiabetes);
– Vrouwen met diabetes types I en II die een zwangerschapswens hebben.
In de Zvw is vastgelegd dat verzekerde zorg moet voldoen aan «de stand van de wetenschap en praktijk». Alleen zorg die als bewezen effectief wordt beschouwd, behoort tot verzekerde zorg. Zoals ik hierboven heb aangegeven, heeft het Zorginstituut de wettelijke verantwoordelijkheid voor het pakketbeheer en kan vanuit die hoedanigheid een standpunt innemen over wat tot de verzekerde zorg behoort. Het Zorginstituut beoordeelt dan of zorg voldoet aan «de stand van de wetenschap en praktijk».
Deze beoordeling verloopt via een proces dat waarborgt dat de benodigde relevante gegevens beschikbaar komen en dat een weloverwogen standpunt kan worden ingenomen. Zo worden zorgprofessionals, patiëntenverenigingen en zorgverzekeraars van begin af aan bij een beoordeling betrokken. Verder laat het Zorginstituut zich bij de beoordelingen adviseren door de Wetenschappelijke Adviesraad en de Adviescommissie Pakket.
Dit zijn onafhankelijke commissies van externe deskundigen. Dit zorgt voor de benodigde inbreng van actuele wetenschappelijke kennis en ervaring met de behandelpraktijk. Ook het standpunt met betrekking tot de rt-CGM is volgens dit proces tot stand gekomen. Ik heb gemerkt dat het standpunt van de rt-CGM vragen oproept. Daarom heeft het Zorginstituut op haar website een nadere toelichting over de vergoeding van rt-CM gepubliceerd.
Kostenontwikkeling hulpmiddelen
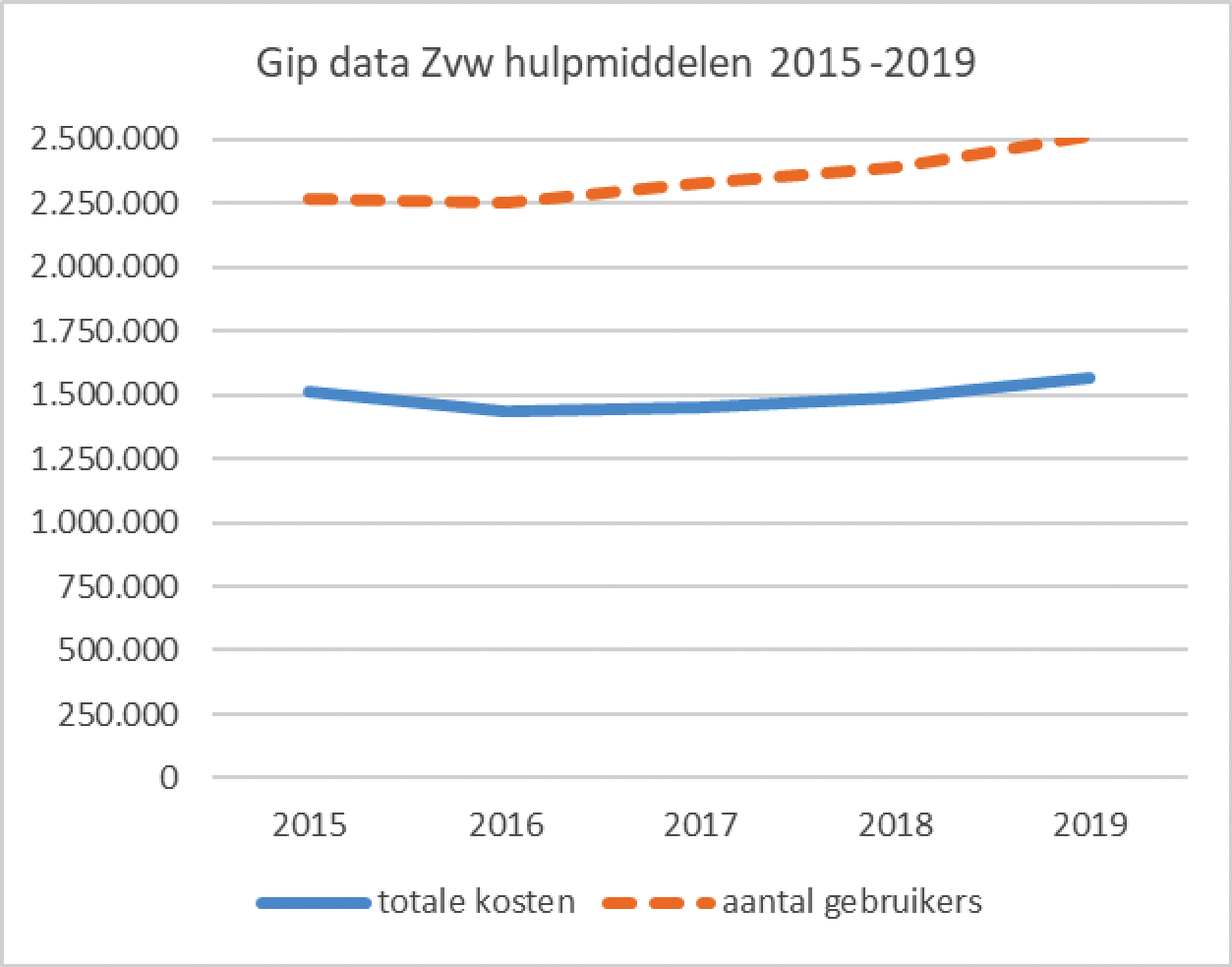
In het Algemeen Overleg hulpmiddelenbeleid van 27 november 2019 heeft de Kamer gesignaleerd dat de kosten voor hulpmiddelen sterk zou zijn gestegen en gevraagd9 om de kostenontwikkeling van medische hulpmiddelen te onderzoeken. Ik heb daartoe het Genees- en hulpmiddelen Informatie Project (GIP) van het Zorginstituut geraadpleegd. Met de GIP brengt het Zorginstituut de ontwikkelingen in het gebruik van hulpmiddelen en de bijbehorende kosten in kaart. Uit de GIP-data blijkt dat in 2019 de totale uitgaven aan Zvw hulpmiddelen met 5% is gestegen naar bijna € 1,6 miljard euro. Het aantal hulpmiddelgebruikers steeg in 2019 met 5% naar ruim 2,5 miljoen. Volgens het Zorginstituut is de uitgavenstijging voornamelijk te verklaren door de toename van het aantal gebruikers. Van een grote prijsstijging lijkt geen sprake te zijn en daarom zie ik geen aanleiding voor een nader onderzoek. Onderstaande tabel toont de ontwikkeling over de periode 2015–2019.
Onderzoek eigen bijdrage
In het AO van 27 november 2019 is door Kamerleden gevraagd om een vervolg op het onderzoek naar eigen bijdragen voor medische hulpmiddelen en met name naar de effecten van stapeling.
Het uitzetten van dit onderzoek heeft vertraging opgelopen vanwege de coronapandemie. Op dit moment wordt het onderzoek in gang gezet, in samenspraak met de Nederlandse Patiëntenfederatie. Ik verwacht u eind tweede kwartaal 2021 de uitkomsten toe te kunnen zenden.
Voortgang implementatie MDR-IVDR
Op 23 april 2020 is in het Europees Parlement een voorstel aangenomen waarmee de toepassing van de Verordening betreffende medische hulpmiddelen (MDR) met een jaar wordt uitgesteld naar 26 mei 2021. Dit uitstel biedt lidstaten, zorginstituten en private partijen de kans om alle mogelijke aandacht te geven aan de bestrijding van de coronapandemie. De Europese Commissie heeft ondertussen hard doorgewerkt aan de Europese database, Eudamed. De lidstaten en Europese Commissie zijn overeengekomen dat de verschillende modules van Eudamed stapsgewijs beschikbaar komen, zodat afzonderlijke modules in gebruik kunnen worden genomen zodra ze klaar zijn. De eerste module, de actor registratie module, zal uiterlijk 1 december 2020 in gebruik worden genomen. In deze module worden marktdeelnemers (fabrikanten, importeurs en gemachtigden) geregistreerd. Lidstaten zullen deze module op vrijwillige basis in gebruik nemen en marktdeelnemers nadrukkelijk oproepen om zich te registreren.
Onderdelen van de MDR worden geïmplementeerd via het wetsvoorstel medische hulpmiddelen. Naar aanleiding van een toezegging van mijn ambtsvoorganger aan uw Kamer is in dit wetsvoorstel een meldplicht opgenomen voor incidenten met medische hulpmiddelen door zorgverleners. Vanwege het uitstel van de MDR wordt de nieuwe wet medische hulpmiddelen ook een jaar later van kracht. Dit betekent dat de meldplicht voor zorgverleners ook vertraging oploopt. Deze vertraging acht ik acceptabel, omdat zorgverleners prioriteit (hebben) moeten geven aan de bestrijding van en omgang met de coronapandemie. Ik ben in overleg met koepels in de zorg om te onderzoeken hoe de meldplicht kan worden vormgegeven en welke termijn, gelet op de gevolgen van de coronapandemie in het zorgveld, realistisch is.
Ik concludeer dat de coronapandemie logischerwijs tot vertraging of aanpassing heeft geleid van een aantal onderdelen van het lopende hulpmiddelenbeleid. Zoals uit de brief blijkt betekent uitstel echter geen afstel en ik heb inmiddels verschillende stappen gezet om voorgenomen activiteiten weer op te pakken. Ik heb er daarom vertrouwen in dat de komende jaren belangrijke stappen gezet kunnen worden in het verder verbeteren van het hulpmiddelenbeleid in Nederland.
De Minister voor Medische Zorg, T. van Ark
Zo blijkt uit het u eerder toegestuurde KPMG rapport uit 2018, zie Kamerstuk 32 805, nr. 58.
Ik kom hiermee tevens terug op het verzoek van de vaste commissie voor VWS van 14 februari 2020 (om een stand van zakenbrief over het bredere hulpmiddelenbeleid). Mijn ambtsvoorganger is in zijn antwoord op schriftelijke vragen van het lid Van Gerven d.d. 2 maart 2020 reeds ingegaan op de buitenlandse rechtszaken tegen fabrikant Johnson&Johnson (Aanhangsel Handelingen II 2019/20, nr. 1882).
Kopieer de link naar uw clipboard
https://zoek.officielebekendmakingen.nl/kst-32805-109.html
De hier aangeboden pdf-bestanden van het Staatsblad, Staatscourant, Tractatenblad, provinciaal blad, gemeenteblad, waterschapsblad en blad gemeenschappelijke regeling vormen de formele bekendmakingen in de zin van de Bekendmakingswet en de Rijkswet goedkeuring en bekendmaking verdragen voor zover ze na 1 juli 2009 zijn uitgegeven. Voor pdf-publicaties van vóór deze datum geldt dat alleen de in papieren vorm uitgegeven bladen formele status hebben; de hier aangeboden elektronische versies daarvan worden bij wijze van service aangeboden.
