Kamerstuk
| Datum publicatie | Organisatie | Vergaderjaar | Dossier- en ondernummer |
|---|---|---|---|
| Tweede Kamer der Staten-Generaal | 2016-2017 | 29477 nr. 397 |
Zoals vergunningen, bouwplannen en lokale regelgeving.
Adressen en contactpersonen van overheidsorganisaties.
U bent hier:

| Datum publicatie | Organisatie | Vergaderjaar | Dossier- en ondernummer |
|---|---|---|---|
| Tweede Kamer der Staten-Generaal | 2016-2017 | 29477 nr. 397 |
Aan de Voorzitter van de Tweede Kamer der Staten-Generaal
Den Haag, 7 november 2016
Op 29 januari van dit jaar heb ik uw Kamer mijn geneesmiddelenvisie toegestuurd (Kamerstuk 29 477, nr. 358). In deze «Visie op geneesmiddelen: Nieuwe geneesmiddelen snel bij de patiënt tegen aanvaardbare kosten» staat het toegankelijk houden van innovatieve geneesmiddelen tegen aanvaardbare prijzen voor de patiënt centraal. In het Algemeen Overleg van 13 april jl. (Kamerstuk 29 477, nr. 384) heb ik toegezegd uw Kamer nader te informeren over de planning van de diverse acties. In deze brief informeer ik u over de acties die zijn ondernomen en de voortgang die sinds januari is geboekt. In bijlage I vindt u een overzicht met de stand van zaken van alle acties uit de ontwikkelagenda visie geneesmiddelen1.
Samenvatting
De geneesmiddelenvisie bestaat uit een samenhangend pakket aan maatregelen, acties en activiteiten. Dit pakket heeft tot doel om innovatieve, dure geneesmiddelen toegankelijk te houden tegen aanvaardbare prijzen. De acties zijn grofweg in te delen in drie pijlers:
1. een duurzame verandering in de farmaceutische sector. Ik zet mij in voor een andere benadering van de ontwikkeling en het op de markt brengen van geneesmiddelen. Ik zoek daarbij naar een nieuwe balans tussen Europese wetgeving, markt en overheid, waarbij beschermingsconstructies intellectueel eigendom en de structuur en het functioneren van de geneesmiddelenmarkt het publiek belang dienen. De Europese Commissie onderzoekt momenteel hoe deze beschermingsconstructies in de praktijk uitwerken en ik zoek daarnaast naar nieuwe businessmodellen in overleg met andere EU-landen, NGO’s en de industrie. Hierbij staan het voldoende ruimte blijven bieden voor nieuwe ontwikkelingen en innovaties en tegelijkertijd het op de lange termijn betaalbaar en toegankelijk houden van de zorg centraal.
2. het aanpakken van ongewenst hoge prijzen. Samenwerking in de inkoop van dure geneesmiddelen door zorgverzekeraars en ziekenhuizen is nodig om in een aantal gevallen de prijs voor geneesmiddelen naar beneden te krijgen. Met het nieuwe platform inkoopkracht dure geneesmiddelen investeer ik in gemeenschappelijke onderhandelingen van deze partijen op landelijk niveau, waarmee de countervailing power ten opzichte van de industrie wordt versterkt. Ook zal in dit kader de kennisdeling worden geïntensiveerd en gezamenlijk inzicht worden gezocht in de ontwikkelingen die er op het terrein van innovatieve middelen aankomt. Waar nodig neem ik zelf centrale, landelijke maatregelen om de betaalbaarheid en toegankelijkheid van de zorg ook op de lange termijn beter te borgen, zoals het sluiten financiële arrangementen op nationaal niveau en wettelijke verankering van de sluis. Onze positie wordt door verdergaande Europese samenwerking versterkt bij de onderhandelingen met farmaceutische bedrijven over de prijzen van dure geneesmiddelen;
3. het gepast gebruik van geneesmiddelen. Naast acties op marktstructuur en prijzen vind ik het van belang om ook het gepast gebruik van geneesmiddelen te stimuleren. Gepast gebruik betekent dat de patiënt de geneesmiddelen krijgt die nodig zijn voor zijn behandeling. Niet meer en niet minder. Diagnostiek is hierin bijvoorbeeld belangrijk, start/stop criteria en een goed systeem van registraties.
Om een gelijkwaardige gesprekspartner van de mondiaal georganiseerde farmaceutische industrie te kunnen zijn, moeten overheden in EU-verband meer kennis en informatie delen en waar mogelijk veel meer gaan samenwerken. Europese samenwerking is een belangrijke voorwaarde voor een duurzame geneesmiddelenvoorziening. Als wij daarin slagen, kunnen we ook op langere termijn zorgen voor een aantrekkelijke markt voor geneesmiddelen en de juiste zorg voor patiënten. In de eerste helft van 2016 heb ik daarom prioriteit gegeven aan het Nederlandse EU-voorzitterschap.
In algemene zin constateer ik dat de geneesmiddelenvisie én de Europese geneesmiddelenagenda hebben gezorgd voor een intensief debat, zowel nationaal als internationaal, over de toekomst van de farmaceutische sector en de mogelijke maatregelen die kunnen bijdragen aan een duurzame en betaalbare farmaceutische zorg.
Het Nederlands voorzitterschap van de Europese Unie
In het verlengde van de nationale geneesmiddelenvisie, heb ik de ontwikkeling van een Europese geneesmiddelenagenda als centraal thema opgepakt tijdens het Nederlands EU-voorzitterschap in de eerste helft van 2016. Als EU-voorzitter heb ik daarbij flink ingezet op het initiëren van een fundamenteel debat over de werking en toekomst van het EU-geneesmiddelensysteem, met name rondom markttoelating en bescherming intellectueel eigendom, prijs en «markt». Daarnaast heb ik verschillende prioriteiten die in de geneesmiddelenvisie zijn opgenomen en waar EU-samenwerking voor nodig is, aan de orde laten komen tijdens diverse bijeenkomsten die Nederland tijdens het voorzitterschap heeft georganiseerd.
Een belangrijk resultaat van het EU-voorzitterschap op het vlak van geneesmiddelen is de aanname door de EU-gezondheidsraad van succesvolle en betekenisvolle raadsconclusies waarin ook vervolgacties zijn opgenomen voor zowel lidstaten als de Europese Commissie (zie bijlage II)2.
Daarin is afgesproken dat:
– er een analyse zal worden uitgevoerd door de Europese Commissie naar de voor- en nadelen van de bestaande (aanvullende) beschermingsmechanismen voor intellectueel eigendom die specifiek voor geneesmiddelen in het EU-markttoelatingssysteem zijn gecreëerd (denk aan monopolieposities voor weesgeneesmiddelen of mogelijkheden voor patentverlenging);
– via vrijwillige samenwerking rondom prijs- en vergoedingenbeleid lidstaten onderlinge informatie-uitwisseling vergroten en hun (onderhandelings-) posities ten opzichte van de industrie verbeteren, bijvoorbeeld door samen te onderhandelen;
– versnelde markttoelatingsinstrumenten verder ontwikkeld kunnen worden, maar wel onder juiste en afdwingbare voorwaarden;
– oorzaken van geneesmiddelentekorten en/of gebrekkig functionerende geneesmiddelenmarkten nader in kaart worden gebracht en waar mogelijk (gezamenlijk) aangepakt.
Met deze conclusies wenst Nederland een politiek signaal af te geven over de groeiende disbalans in het huidige systeem en wordt tevens beoogd samenwerking tussen EU-lidstaten te bevorderen, gezamenlijke knelpunten aan te pakken en oplossingsrichtingen aan te geven voor de (nabije) toekomst. Nederland heeft met zijn inzet tijdens het EU-voorzitterschap voor een belangrijk deel invulling gegeven aan de Europese aspecten van de geneesmiddelenvisie van het kabinet en tevens de toon gezet voor een fundamenteel debat op Europees niveau. In de komende jaren zal Nederland zich in samenwerking met andere lidstaten blijven inzetten voor het verder agenderen en uitvoeren van de hierboven genoemde acties.
Er zijn ook verschillende bewegingen in gang gezet. Zo zijn er verschillende andere landen die coalitievorming onderzoeken. Zo werken vier Scandinavische landen samen in het «Nordic forum» en zijn er diverse lidstaten, zoals Roemenië en Bulgarije die samenwerking onderzoeken om beschikbaarheidsproblemen en tekorten van geneesmiddelen gezamenlijk aan te pakken. Polen oriënteert zich ook op samenwerking met andere landen inzake de inkoop van geneesmiddelen. Nederland werkt hierin al breder samen met België, Luxemburg en Oostenrijk. Er lopen op dit moment gesprekken met twee landen die ons actief hebben benaderd om aan te sluiten. Ook is het van belang om op Europees niveau de Health Technologie Assessment, die momenteel in alle landen plaatsvindt te bundelen. Met het huidige draagvlak op EU-niveau is het zaak dit verder op te pakken en vorm te geven.
De farmaceutische sector is een innovatieve sector waarin we willen stimuleren dat nieuwe producten worden ontwikkeld ten behoeve van de patiënt. Hier zijn kosten en investeringen mee gemoeid die terugverdiend worden met behulp van het systeem van patenten. Traditioneel is het verdienmodel van de farmaceutische industrie gebaseerd op het optimaal benutten van een marktbescherming en/of exclusiviteit. Farmaceutische bedrijven worden op verschillende niveaus beschermd door octrooiwetgeving en aanvullende beschermingsmechanismen, zoals de marktbescherming voor weesgeneesmiddelen. Deze beschermingsmechanismen zijn destijds bedoeld om innovatie te stimuleren en staan mede aan de wieg van nieuwe, werkzame medicijnen. Ze kunnen echter ook leiden tot het ongewenst gebruik van de geboden bescherming om de winst van producten te maximaliseren. We moeten daarom goed analyseren of deze beschermingsconstructies werken zoals ze bedoeld zijn en daarbij nadrukkelijk ook open staan voor alternatieve businessmodellen. Daarmee kunnen we onderzoekers, ondernemers en partijen in de zorg in staat stellen te werken aan waardevolle producten tegen aanvaardbare prijzen. Dat zijn ook producten die in het huidige verdienmodel niet altijd als commercieel aantrekkelijk gezien worden.
Daarnaast zien we dat veel innovatie op het terrein van geneesmiddelen voortkomt uit collectief gefinancierd onderzoek door universiteiten en zogenaamde spin-offs van universiteiten. Ik stel voorwaarden aan de collectieve financiering van ontwikkeling en innovatie (vanuit bijvoorbeeld een ZonMw-programma) van geneesmiddelen om te voorkomen dat er dubbel wordt betaald (eerst subsidie voor de ontwikkeling en vervolgens in de hoge prijs van het product). Tegelijkertijd kan er binnen het bestaande model gezocht worden naar mogelijkheden om voor specifieke groepen innovatieve geneesmiddelen te experimenteren met flexibele vormen van markttoelating.
In de geneesmiddelenvisie heb ik aangekondigd een onderzoek te laten doen naar de positieve en de negatieve effecten van de huidige beschermingsmechanismes op het terrein van intellectueel eigendom, specifiek voor geneesmiddelen.
Momenteel lopen er twee initiatieven waarvan we de onderzoeksresultaten de komende jaren kunnen verwachten. Zoals hierboven aangegeven, heeft de EU-gezondheidsraad richtinggevende conclusies aangenomen over onderzoek naar de gewenste en ongewenste effecten van beschermingsmechanismen. De Europese Commissie heeft hiermee een eerste aanvang gemaakt, waarbij de uitvoering van het onderzoek in 2017 is voorzien. Daarnaast doen we in Nederland samen met het Ministerie van Economische Zaken ook onderzoek naar aanvullende beschermingsmechanismen in het patentsysteem.
Ik vind het belangrijk om het initiatief te nemen bij de vraag hoe flexibele vormen van markttoelating (voorwaardelijke markttoelating, adaptive pathways) beter kunnen worden ingezet om innovatieve producten die voorzien in een duidelijke medische behoefte, sneller maar ook veilig en betaalbaar naar de patiënt te krijgen. Tijdens verschillende expertbijeenkomsten die door het Ministerie van VWS georganiseerd zijn gedurende ons EU-voorzitterschap heb ik hiervoor aandacht gevraagd bij de lidstaten.
In de komende tijd zal ik hier op Europees niveau actief aandacht voor blijven vragen, waarbij ik blij ben dat ook de Europese Commissie en de Europese Geneesmiddelenautoriteit (EMA) aandacht blijven besteden aan dit onderwerp.
Ook heb ik aangegeven ruimte te willen scheppen voor nieuwe ideeën en modellen om geneesmiddelen op de markt te brengen. De subsidie van 2,8 miljoen euro die ik dit jaar heb toegekend voor de activiteiten van de Stichting Fair Medicine is een voorbeeld van de wijze waarop ik hieraan bij wil dragen. Ik heb uw Kamer hierover tijdens het algemeen overleg op 13 april jongstleden en per brief van 30 september geïnformeerd. Ik ben in afwachting van een advies van de Raad voor Volksgezondheid en Samenleving (RVS) over alternatieve ontwikkelmodellen. Ik heb uw Kamer op 24 maart per brief geïnformeerd over de adviesaanvraag. De resultaten hiervan zal ik meenemen bij de vervolgacties om gerichter alternatieve businessmodellen te stimuleren.
ZonMW stelt openheid en transparantie rondom onderzoeksdata als standaardeis bij de financiering van onderzoek. Hiermee voldoe ik aan de voorwaarden die we stellen aan collectieve financiering op het gebied van datamanagement. Ik verwacht dat ook op EU-niveau gewerkt zal gaan worden aan grotere transparantie rondom onderzoeksdata.
Ik vind het belangrijk om met alle belanghebbenden samen maatschappelijk aanvaardbare prijzen voor geneesmiddelen te realiseren. Ik zie het als mijn verantwoordelijkheid om alle betrokkenen in staat te stellen die bijdrage te leveren en de regie te voeren op verschillende acties op dit terrein die het hart van de geneesmiddelenvisie vormen. Waar nodig neem ik zelf maatregelen om prijzen en uitgaven te beheersen. De maatregelen strekken zich uit over drie niveaus: Europese samenwerking, het vergroten van de (gezamenlijke) inkoopmacht van zorgverzekeraars en ziekenhuizen en centrale, landelijke maatregelen in het systeem.
Ook in Europa heb ik het afgelopen jaar aandacht gevraagd voor de samenwerking op de dure geneesmiddelen. Nederland werkt samen met België en Luxemburg en recent heeft ook Oostenrijk zich bij deze samenwerking gevoegd. De samenwerking focust op vier thema’s: (1) het onderling uitwisselen van informatie, (2) het ontwikkelen en uitvoeren van een Europese horizonscan die ook de basis moet vormen voor een gezamenlijk werkplan, (3) samenwerking op het terrein van Health Technology Assessment (HTA, «pakketbeoordelingen») en (4) het voeren van gezamenlijke prijsonderhandelingen met de farmaceutische industrie. Dit helpt onze positie te versterken bij de onderhandelingen met farmaceutische bedrijven over de prijzen van dure geneesmiddelen. Dit jaar zijn duidelijke samenwerkingsafspraken gemaakt, die ook toetreding van andere landen mogelijk moeten maken. De soms sterk verschillende systemen en juridische verschillen, maar ook taalvereisten in de verschillende landen vragen om een zorgvuldige benadering en praktische oplossingen. Op basis daarvan worden de procedures voor samenwerking op het terrein van HTA en gezamenlijke onderhandelingen nu vastgesteld. Daarmee is de inrichting van het initiatief definitief vormgegeven.
Naast de organisatieopzet zijn er pilots gestart met het doen van gezamenlijke pakketbeoordelingen en daaropvolgende gezamenlijke onderhandelingen. In 2016 zijn de eerste drie gezamenlijke pakketbeoordelingen succesvol afgerond. De ervaringen zijn positief. Immers, door gezamenlijk uitvoering te geven bereiken we ook gezamenlijk eenzelfde beeld en opinie over nieuwe producten. Na de uitbreiding met Oostenrijk wordt in 2017 niet alleen verder gewerkt aan gezamenlijke beoordelingen, maar ook onderzocht hoe HTA-rapporten onderling erkend kunnen worden. Op basis van gezamenlijke rapporten worden besprekingen gehouden in het kader van prijsonderhandelingen. Dit betreft op dit moment drie producten. Ik verwacht dat eerste resultaten van gezamenlijke onderhandelingen begin 2017 zijn voltooid. De werkplannen voor de verschillende terreinen voor de komende periode zijn naar verwachting gereed in december 2016. Doel is om in 2017 ten minste voor drie nieuwe geneesmiddelen gezamenlijke beoordelingen en prijsarrangementen uit te voeren.
Met deze toelichting ga ik er van uit dat ik mijn toezegging uit het Algemeen Overleg Geneesmiddelen van 13 april jongstleden, om u over de voortgang van de pilots rond onderhandelingen in het BeNeLuxA-initiatief te informeren, heb ingelost.
Ook heb ik het initiatief genomen voor een rondetafelconferentie tussen Ministers van volksgezondheid en de top van internationale farmaceutische bedrijven. Een eerste sessie is gehouden in Den Haag in mei 2016. Mijn Portugese collega zal een tweede conferentie organiseren op 7 december 2016 in Lissabon. In deze conferenties spreken wij met de leiders binnen farmaceutische industrie over wat zij kunnen bijdragen aan nieuwe businessmodellen en prijsstelling.
Er is een grote rol weggelegd voor partijen als zorgverzekeraars en zorgaanbieders om ongewenst hoge prijzen van geneesmiddelen terug te dringen. Samenwerking tussen zorgverzekeraars en/of zorgaanbieders kan al op kortere termijn leiden tot lagere inkoopkosten. Ik vind het belangrijk dat ziekenhuizen en zorgverzekeraars de krachten bundelen bij de inkoop van geneesmiddelen en het delen van expertise omtrent inkoop. Ik ben blij met de acties die partijen op dit moment al ondernemen. Tegelijkertijd vind ik dat wij dit als overheid structureel moeten borgen. Het op te richten platform inkoopkracht dure geneesmiddelen speelt hierbij een cruciale rol.
Op bestuurlijk niveau hebben zowel de Nederlandse Vereniging Ziekenhuizen (NVZ) in samenwerking met de Nederlandse Vereniging van Ziekenhuis Apothekers (NVZA) als de Nederlandse Federatie van Universitair medische centra (NFU) respectievelijk een Taskforce en Dedicated Group samengesteld die zich bezighouden met vraagstukken op het terrein van dure geneesmiddelen. Zo wordt bij alle partijen verder uitgewerkt hoe de inkoop van geneesmiddelen versterkt kan worden. Zowel door te kijken naar de inkoopprocessen en de organisatie als naar samenwerking tussen zorgaanbieders onderling als ook door te kijken naar de mogelijkheden om samen te werken met verzekeraars. Zorgverzekeraars Nederland (ZN) heeft besloten in te zetten op gezamenlijke inkoop van dure geneesmiddelen in het oligopolistische segment, waarbij samenwerking zal worden gezocht met de voorschrijvers, ziekenhuizen en patiënten(verenigingen). Door het bundelen van volume wordt de marktmacht vergroot. Doel is om te komen tot lagere prijzen voor dure geneesmiddelen vanuit het maatschappelijk belang om de totale kosten van de medisch specialistische zorg te beheersen en verdringing van zorg tegen te gaan.
Daarnaast heeft de NVZ aan adviesbureau SiRM de opdracht gegeven een advies op te stellen hoe ziekenhuizen de inkoop van geneesmiddelen kunnen versterken. Het advies wordt in november gepubliceerd en de NVZ verspreidt het onder alle stakeholders. Ook worden door de NFU, NVZ en NVZA gezamenlijk best practices op het terrein van de inkoop van geneesmiddelen opgesteld om met partijen te delen.
Om partijen meer te faciliteren in het versterken van de inkoop van geneesmiddelen en sneller resultaat te kunnen behalen heb ik in de visie aangekondigd een platform inkoopkracht dure geneesmiddelen op te richten.
Ik zie hier een belangrijk aanjaag- en regierol voor VWS om te borgen dat acties in samenhang worden opgepakt teneinde een sterkere onderhandelingspositie voor zorgverzekeraars en ziekenhuizen te realiseren. Ik ben voornemens hiervoor een procesbegeleider aan te stellen.
Het platform focust op hoofdlijnen op: (1) het delen van relevante informatie, zoals de gepubliceerde leidraad samenwerking inkoop geneesmiddelen van de Autoriteit Consument en Markt en de horizonscan+, (2) het uitwisselen van ervaringen, waaronder best practices, tussen partijen en (3) het samenbrengen van partijen om gezamenlijk in te kopen (zie figuur 1).
Figuur 1- Platform inkoopkracht dure geneesmiddelen
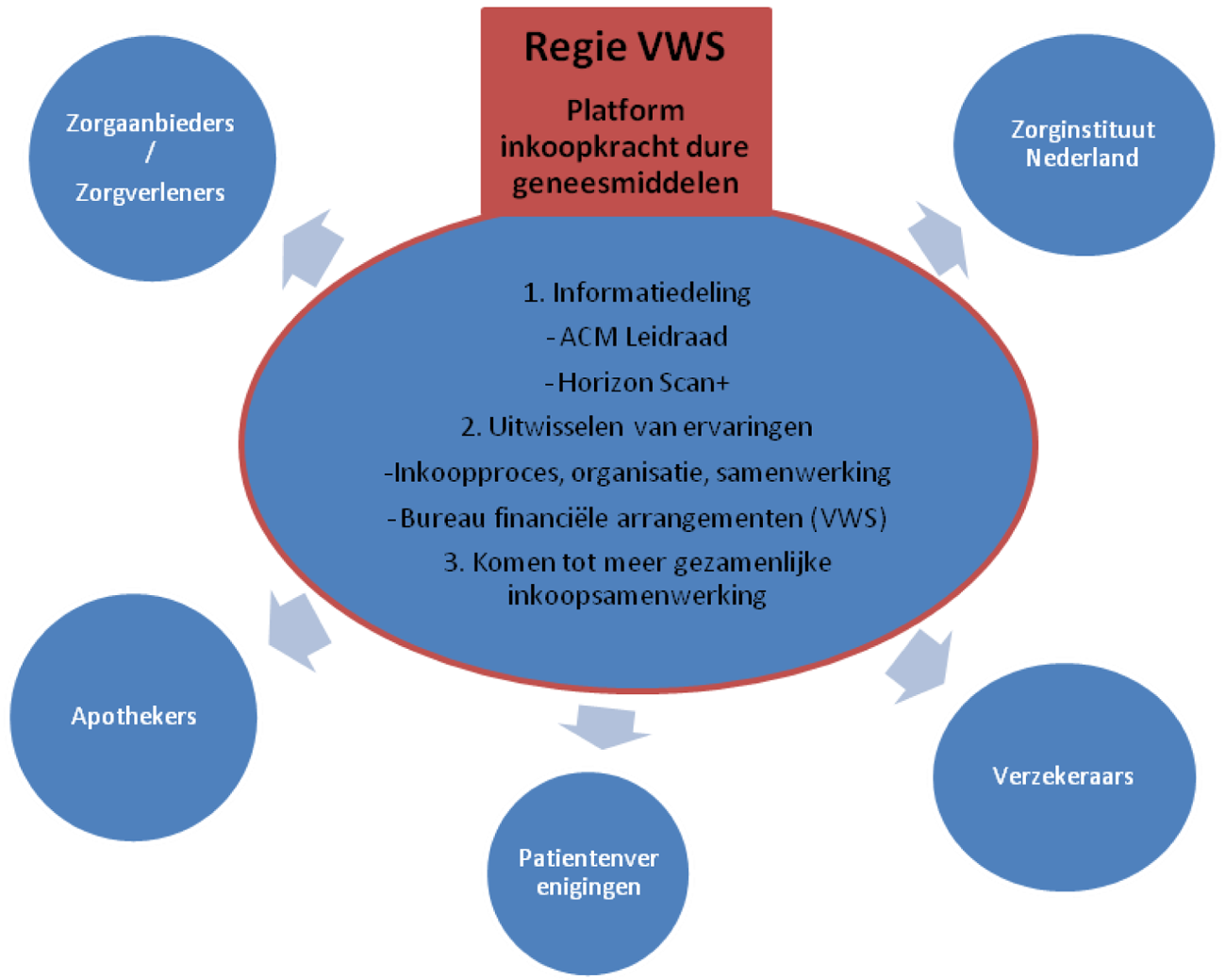
Op verschillende onderdelen van het op te richten platform zijn al de nodige stappen gezet:
1. ACM-leidraad samenwerking inkoop geneesmiddelen. Voor de zomer heeft de Autoriteit Consument en Markt (ACM) een leidraad opgesteld waarin duidelijk wordt gemaakt wat de mogelijkheden van samenwerking op de inkoop van geneesmiddelen voor medisch-specialistische zorg binnen de mededingingsregels zijn. Op 21 juni jl. heeft er een bijeenkomst plaatsgevonden met zorgaanbieders, behandelaren en zorgverzekeraars waar de ACM-leidraad en de mogelijkheden en ideeën van samenwerking op de inkoop van dure geneesmiddelen is besproken. Het doel is elkaar informeren en inspireren om gezamenlijke inkoop van geneesmiddelen voor medisch-specialistische zorg vorm te geven.
2. Horizonscan+. De horizonscan+ vergroot het inzicht in de ontwikkelingen van dure geneesmiddelen die op de markt komen. Afgelopen periode is er gewerkt aan de doorontwikkeling van de bestaande horizonscan naar de horizonscan+. In dit traject wordt ook waar nuttig samengewerkt met onze Europese inkoop partners.
De vormgeving (structuur en proces) staat nu op hoofdlijnen en er is brede steun en medewerking om aan deze scan bij te dragen bijpartijen. Zorgaanbieders, zorgverzekeraars, ziekenhuisapothekers, medisch specialisten en patiëntenorganisaties participeren in werkgroepen voor de horizonscan+. Ook de industrie krijgt gelegenheid om input te leveren. De verwachting is dat de uitvoering en verdere doorontwikkeling van de horizonscan+ vanaf begin 2017 kan worden overgedragen aan het Zorginstituut. Het delen en bespreken van de uitkomsten van de horizonscan+ met de partijen zal deel uitmaken van de taken van het platform.
3. Best practices. Binnen het platform kunnen best practices rond de inkoop geneesmiddelen uit het veld worden gedeeld en verder verspreid. Het kan hierbij bijvoorbeeld gaan om ervaringen omtrent het inkoopproces, organisatie- en samenwerkingsvormen. Samenwerking kan immers in verschillende vormen worden toegepast door ziekenhuizen en/of ziekenhuizen en verzekeraars. Ook de ervaringen van het Bureau Financiële Arrangementen Geneesmiddelen van het Ministerie van VWS zullen worden gedeeld op het platform.
4. Komen tot meer gezamenlijke inkoopsamenwerking. Het platform brengt tevens partijen samen om gezamenlijk in te kopen.
Ik neem ook zelf maatregelen om de prijzen van geneesmiddelen beter te beheersen, zodat we ook op langere termijn ruimte blijven houden voor nieuwe, innovatieve geneesmiddelen. Ik breng waar nodig meer prijsdruk in onze bekostigings- en vergoedingssystemen en ik sluit en veranker financiële arrangementen. Dit geldt zowel voor intramurale als extramurale geneesmiddelen.
Ik heb uw Kamer recentelijk een rapport doen toekomen over de mogelijkheid tot selectief herberekenen van het geneesmiddelenvergoedingssysteem (GVS). Zoals ik in de begeleidende brief heb aangegeven zal ik eind 2016 bepalen welke clusters ik in de vorm van een pilot wil gaan herberekenen. We zullen de mogelijke gevolgen en impact met diverse partijen bespreken (patiënten, behandelaren, apothekers en verzekeraars).
Het beleid van het sluiten van financiële arrangementen op nationaal niveau is succesvol gebleken om met beheersing van uitgaven, de patiënt toegang te geven tot nieuwe geneesmiddelen. De capaciteit van het Bureau Financiële Arrangementen Geneesmiddelen is dit jaar uitgebreid. De samenwerking van het Bureau Financiële Arrangementen Geneesmiddelen met belanghebbende partijen is verder versterkt.
In 2015 en 2016 zijn enkele dure geneesmiddelen in een zogenaamde sluis geplaatst. In deze constructie worden deze middelen tijdelijk buiten het pakket geplaatst als niet verzekerde zorg. In deze periode kan het Zorginstituut een pakketadvies uitbrengen over deze middelen, kan een financieel arrangement worden afgesloten en kunnen met partijen afspraken worden gemaakt over gepast gebruik. Daarmee wordt voorzien dat dure intramurale geneesmiddelen tegen aanvaardbare kosten via het pakket beschikbaar komen en de doelmatige toepassing ervan in de praktijk is geborgd. Deze sluis wordt structureel verankerd in de Zorgverzekeringswet door middel van een algemene maatregel van bestuur. Deze wordt eind 2016 voorgehangen bij uw Kamer, waarbij gestreefd wordt dat deze per 1 juli 2017 in werking kan treden.
Ik verwacht u voor het eind van dit jaar een brief te kunnen sturen met mijn antwoord op de motie-Otwin van Dijk (Kamerstuk 29 477, nr. 378). De zogeheten artikel 5-route, zoals in het plan van de Vereniging van Doorgeleverde Bereidingsapotheken (VDB) wordt voorgesteld, heb ik met een positieve grondhouding ter hand genomen. Bij nadere analyse blijken er diverse secundaire effecten op de markt van doorgeleverde bereidingen, op de vergoedingen en op de Europees rechtelijke aspecten te kunnen optreden. Overigens ben ik in overleg met betrokken partijen welke mogelijkheden er zijn om doorgeleverde bereidingen aantrekkelijker te maken. De resultaten daarvan neem ik mee in dezelfde brief.
Met deze samenhangende en intensieve set van acties op lokaal, nationaal en Europees niveau verwacht ik een stevige bijdrage te leveren aan het betaalbaar en toegankelijk houden van de dure geneesmiddelen. De uitvoering van de visie is nog in volle gang. Om maximaal effect te bereiken zal ik de komende periode stevig blijven inzetten op een gecoördineerde aanpak van de dure geneesmiddelen.
Ook op het gebruik van geneesmiddelen is nog winst te behalen. Gepast gebruik-acties dragen bij aan optimaal gebruik van geneesmiddelen en hebben als doel om de kwaliteit van zorg te verbeteren en om de uitgaven aan geneesmiddelen te beheersen. Onder andere door doelmatig voor te schrijven, het vaststellen van goede start- en stopcriteria en dosisoptimalisatie kan de inzet van geneesmiddelen verder worden verbeterd. Al deze aspecten zullen een plek krijgen in het actieplan Gepast Gebruik.
Ook het gebruik van zogenaamde biosimilars (een variant van een biologisch geneesmiddel die over het algemeen goedkoper zijn dan de specialité) zal deel uitmaken van het actieplan Gepast Gebruik. De inzet van biosimilars voorkomt immers onnodig duur geneesmiddelengebruik, omdat het een vergelijkbaar, maar goedkoper, alternatief betreft.
Het actieplan Gepast Gebruik gaat ook in op geneesmiddelenregistraties waarmee in de praktijk de effectiviteit en (bij)werking van (nieuwe) geneesmiddelen worden gevolgd. Ik werk aan duidelijkheid omtrent te behalen doelen, werkwijzen, rollen, taken en verantwoordelijkheden en de financiering van deze registraties.
Het actieplan geeft een gestructureerd overzicht van de acties en verantwoordelijkheden op het terrein van gepast gebruik van geneesmiddelen. Ik zal daarin nadrukkelijk aangeven waar ik een rol zie voor VWS. Het actieplan stuur ik rond de jaarwisseling naar uw Kamer.
Betrokken partijen hebben actiepunten geformuleerd op het gebied van gepast gebruik. Dit staat hoog op de agenda. Het is ook een van de thema’s die binnen de eerdergenoemde Taskforce en Dedicated Group van respectievelijk de NVZ in samenwerking met de NVZA en de NFU verder wordt uitgewerkt. Concrete acties waar partijen op dit moment mee bezig zijn of hebben afgerond betreffen bijvoorbeeld:
– De NVZ werkt samen met de NVZA en Initiatiefgroep Biosimilars Nederland uit hoe ze de inzet van biosimilars het beste kan stimuleren. De komende drie jaar zal ZN de Initiatiefgroep financieel steunen. De Patiëntenfederatie Nederland en haar leden en het College ter Beoordeling van Geneesmiddelen (CBG) hebben een informatiebrochure ontwikkeld over biosimilars om goede informatie aan patiënten te geven.
– De Federatie Medisch Specialisten (FMS) heeft een visiedocument dure geneesmiddelen gepubliceerd waarin wordt beschreven hoe medisch specialisten en wetenschappelijke verenigingen met hun expertise vanuit verschillende rollen kunnen bijdragen aan een verantwoorde en doelmatige inzet van deze geneesmiddelen. Op dit moment is de FMS bezig om de uitwerking van deze visie in de praktijk verder vorm te geven.
– De NVZ, NFU en FMS werken aan een procedure voor het opstellen van (kwaliteits)criteria bij de introductie van nieuwe dure geneesmiddelen die belangrijk zijn bij een goede introductie van deze middelen.
– Geneesmiddelencommissies in de umc's en ziekenhuizen hebben de afgelopen periode een steeds belangrijkere rol gekregen als het gaat om sturing op doelmatige inzet van dure geneesmiddelen. Dat juich ik toe. De inrichting en werkwijze van deze geneesmiddelencommissies zijn lokaal bepaald.
– Programma’s «Verstandig kiezen» en «Samen beslissen» zijn opgezet. Om de aandacht voor Samen Beslissen bij medisch specialisten én patiënten nog verder te vergroten, zijn de FMS en de Patiëntenfederatie op 4 oktober 2016 een campagne gestart «Betere zorg begint met een goed gesprek».
Binnen het actieplan gepast gebruik zullen de maatregelen van partijen die voorzien in een verbeterde inzet van geneesmiddelen eveneens aan bod komen.
Apotheekhoudenden kunnen een belangrijke rol spelen bij het gepast gebruik van geneesmiddelen, met name waar het gaat om het coachen van de patiënt in zijn medicijngebruik. Dit is een nieuwe rol voor de apotheker, waarbij hij zich steeds meer als zorgverlener zal gaan gedragen. Om van de apotheker een volwaardige zorgverlener te maken is er een aantal acties in gang gezet. Via het opleidingsgprogramma StiPCO ontvangen apothekers jaarlijks een bijdrage voor de bijscholing op het gebied van zorgverlenen. Sinds januari 2016 is de apotheker erkend als specialist. Het beroep apotheker is enorm in ontwikkeling, en het komende jaar zal in het teken staan van de het opstellen van een gedragen visie op de toekomst van de farmaceutische zorg, en de rol van de apotheker hierin. Van belang blijft de samenwerking met andere professionals in de zorg, zodat de patiënt snel en veilig wordt behandeld.
Vervolgproces
Aangezien de geneesmiddelenvisie en bijbehorende agenda een groot aantal acties omvat en bijvoorbeeld ook de verschillende Europese activiteiten weer leiden tot vervolgacties, stel ik voor uw Kamer periodiek een overzichtsbrief te sturen waarin gerapporteerd wordt over de uitkomsten en resultaten.
De Minister van Volksgezondheid, Welzijn en Sport, E.I. Schippers
Kopieer de link naar uw clipboard
https://zoek.officielebekendmakingen.nl/kst-29477-397.html
De hier aangeboden pdf-bestanden van het Staatsblad, Staatscourant, Tractatenblad, provinciaal blad, gemeenteblad, waterschapsblad en blad gemeenschappelijke regeling vormen de formele bekendmakingen in de zin van de Bekendmakingswet en de Rijkswet goedkeuring en bekendmaking verdragen voor zover ze na 1 juli 2009 zijn uitgegeven. Voor pdf-publicaties van vóór deze datum geldt dat alleen de in papieren vorm uitgegeven bladen formele status hebben; de hier aangeboden elektronische versies daarvan worden bij wijze van service aangeboden.
