Kamerstuk
| Datum publicatie | Organisatie | Vergaderjaar | Dossier- en ondernummer |
|---|---|---|---|
| Tweede Kamer der Staten-Generaal | 2011-2012 | 29477 nr. 186 |
Zoals vergunningen, bouwplannen en lokale regelgeving.
Adressen en contactpersonen van overheidsorganisaties.
U bent hier:

| Datum publicatie | Organisatie | Vergaderjaar | Dossier- en ondernummer |
|---|---|---|---|
| Tweede Kamer der Staten-Generaal | 2011-2012 | 29477 nr. 186 |
Aan de Voorzitter van de Tweede Kamer der Staten-Generaal
Den Haag, 28 maart 2012
Deze brief is een vervolg op mijn brief van 19 mei 20111 over voorwaardelijke pakkettoelating in de geneesmiddelenvoorziening. Inzet van voorwaardelijke pakkettoelating is om meer inzicht te krijgen in de verwachte therapeutische meerwaarde, de verhouding tussen de (meer)kosten en de baten (kosteneffectiviteit) en de effectieve toepassing van het nieuwe geneesmiddel. Met die informatie kan later worden besloten over definitieve pakketinstroom, dan wel uitstroom van de behandeling. Het is niet bedoeld voor nog niet bewezen effectieve geneesmiddelen, of voor middelen waarvan de meerwaarde niet aannemelijk is. Vanaf 1-1-2012 pas ik het instrument al toe bij intramurale (geregistreerde) geneesmiddelen2, en hierbij informeer ik u dat ik het nu ook extramuraal ga inzetten. Daarnaast informeer ik u hierbij over mijn voornemen om gebruik te gaan maken van nieuwe financiële instrumenten (intra- en extramuraal). Indien – bij de initiële pakketbeslissing, dan wel na voorwaardelijke pakkettoelating – bij een geneesmiddel sprake is van geen of een beperkte meerwaarde, maar een veel hogere prijs (ongunstige kosteneffectiviteit), of van een zeer hoog macrokostenbeslag, stroomt het middel uit het pakket. Als de toelating vastzit op de kosteneffectiviteit, kan de fabrikant, om eventuele pakketuitstroom te voorkomen, een financieel arrangement voorstellen. Ik ga hier pilots mee doen. Doel van dit beleid is het (blijven) borgen van snelle verzekerde toegang tot waardevolle innovatieve geneesmiddelen tegen aanvaardbare kosten.
Achtergrond en voornemens
Ieder jaar komen veel nieuwe geneesmiddelen beschikbaar. Het merendeel daarvan vormt een gelijkwaardig alternatief voor bestaande behandelingen. De bestaande regelgeving is zo ingericht dat die middelen snel en kostenneutraal in het basispakket stromen.
Hier is m.i. geen dringende aanleiding voor nieuw beleid. Nieuw beleid is wel nodig voor pakketbeslissingen over innovatieve en/of duurdere geneesmiddelen. Het gaat hier om jaarlijks circa vijf tot vijftien gevallen van nieuwe producten, veelal bedoeld voor ernstige ziekten zoals kanker, en waarvan verondersteld wordt dat ze een aanvulling/verbetering vormen op bestaande behandelmogelijkheden. Met deze middelen zijn doorgaans ook aanzienlijke meerkosten gemoeid. Hier speelt enerzijds dat artsen en patiënten snel toegang willen krijgen tot deze nieuwe behandelmogelijkheden, maar anderzijds dat het aanvankelijk niet altijd voldoende zeker is dat de meerkosten opwegen tegen de baten en ook de betaalbaarheid een rol speelt. Ik wil dat deze innovaties snel beschikbaar komen voor arts en patiënt. Ook mogen die innovaties natuurlijk worden beloond met een hogere prijs, maar dan wil ik wel weten of die hogere prijs ook wordt gerechtvaardigd door navenant betere behandeluitkomsten voor de patiënt en/of besparingen elders in de zorg (kosteneffectiviteit). Ook kan de prijs niet los worden gezien van het volume: het totale kostenbeslag (de p x q) moet betaalbaar blijven (macrokader) en ook niet uit de pas lopen met de private ontwikkelingskosten en principes van redelijke winst.
Om een juiste balans te vinden bij pakketbeslissingen over deze geneesmiddelen en het geheel van de hierboven genoemde uitgangspunten te borgen is maatwerk nodig. De stelselpartijen hebben hier op het moment dat de middelen op de markt komen aanvankelijk weinig handvatten. Het is voor aanbieders en zorgverzekeraars bijvoorbeeld lastig om bij een nieuw uniek middel (waarvoor geen concurrentie is) een lagere prijs te bedingen. Omdat de markt hier dus in zekere zin faalt, zie ik het als mijn verantwoordelijkheid om die taak via actief beleid zelf op te pakken. Dit beleid kent drie sporen:
a) er wordt via voorwaardelijke pakkettoelating actief ingezet op het nader inzichtelijk maken van de therapeutische meerwaarde en kosteneffectiviteit (verhouding tussen meerprijs en verbeterde behandeluitkomsten/besparingen elders in de zorg), van het nieuwe geneesmiddel (zie: «Voorwaardelijke pakkettoelating geneesmiddelen»),
b) daar waar sprake is van geen therapeutische meerwaarde en/of een hoog kostenbeslag waar de fabrikant aan vasthoudt, gaat het middel uit het pakket; dit is noodzakelijk om deze nieuwe, snelle toelating financieel houdbaar te laten zijn,
c) daar waar sprake is van een ongunstige kosteneffectiviteit óf van een hoog kostenbeslag, komt het geneesmiddel niet in het pakket, dan wel is er geen handhaving in het pakket , tenzij de fabrikant via een financieel arrangement de kosteneffectiviteit verbetert/het macrokostenbeslag verlaagt (zie: «Financiële instrumenten»).
Voorwaardelijke pakkettoelating geneesmiddelen (extramuraal)
Bij de dure «intramurale» geneesmiddelen is het per 1-1-2012 zo dat deze snel in het verzekerde pakket stromen, mits daarna wordt aangetoond dat de prijs/meerkosten gerechtvaardigd worden door navenant betere zorguitkomsten (minder ziekte, langer leven, kwaliteit van leven-winst), en/of besparingen elders in de zorg. Het extramurale geneesmiddelenvergoedingensysteem (GVS) biedt plaats voor duurdere (nieuwe) geneesmiddelen, mits de meerwaarde ervan is onderbouwd en deze de meerprijs legitimeert. Het gaat hier jaarlijks om circa vijf tot tien gevallen. Een enkele keer stroomt een middel niet in, hetzij omdat het CVZ van oordeel is dat er geen meerwaarde is, dan wel deze niet met zekerheid kan vaststellen. Omdat er aanvankelijk altijd beperkte (praktijk)informatie is voor een vergelijking met de bestaande behandeling, is er bij deze toetsingen (over de meerwaarde en kosteneffectiviteit) altijd enige onzekerheid, zowel bij een negatief als een positief oordeel.
De «ja/nee» vergoedingsbeslissing is dan ook niet altijd onomstreden, en leidt óf tot snelle verzekerde toegang – maar mogelijk onnodige meerkosten, óf tot vertraagde verzekerde patiënttoegang – met uitblijvende meerkosten. Omdat veel nieuwe geneesmiddelen gericht zijn op complexe aandoeningen, en ook vaak bedoeld zijn voor (kleinere) specifieke patiëntgroepen zal dit naar verwachting steeds vaker opspelen.
Met het oog op het voorgaande wil ik ook in het GVS de mogelijkheid introduceren om een geneesmiddel voorwaardelijk toe te laten: aan de hand van vervolgonderzoek naar meerwaarde en kosteneffectiviteit zal ik dan later besluiten over definitieve toelating dan wel uitstroom. Dit zal eerst alleen bij twijfelgevallen worden toegepast, maar later mogelijk bij alle (zg. bijlage 1B Rzv) opnames van duurdere geneesmiddelen in het GVS. Het opnamebeleid wordt daarmee feitelijk strenger3, maar biedt ook meer ruimte voor opname van innovatieve producten die anders mogelijk niet door de toetsing zouden komen. Het CVZ adviseert mij als voor een bepaald geneesmiddel voorwaardelijke pakkettoelating aan de orde is. In die gevallen is het aan betrokken partijen, zoals fabrikant, patiëntenorganisaties en wetenschappelijke beroepsverenigingen om met nadere gegevens/onderzoek de meerwaarde en kosteneffectiviteit te bevestigen. Het CVZ speelt hier een sturende rol. Laatstgenoemde partijen dienen voorschrijvers en patiënten op de hoogte te brengen over de tijdelijke betaling van het geneesmiddel dat zij voorschrijven respectievelijk gebruiken. Deze werkwijze past binnen mijn bevoegdheid en verantwoordelijkheid om geneesmiddelen aan te wijzen en op te nemen in het GVS, en waarin ik mij laat adviseren door het CVZ. Er volgt dan ook geen wijziging van het Besluit, dan wel de Regeling zorgverzekering. Voor alle voorwaardelijk toegelaten geneesmiddelen zijn de instroomcriteria voor het pakket (waaronder effectiviteit) van toepassing. In sommige gevallen is het denkbaar dat aan voorwaardelijke toelating van een geneesmiddel ook een zg. financieel arrangement wordt gekoppeld. Dit licht ik hierna toe.
Financiële instrumenten (intramuraal en extramuraal)
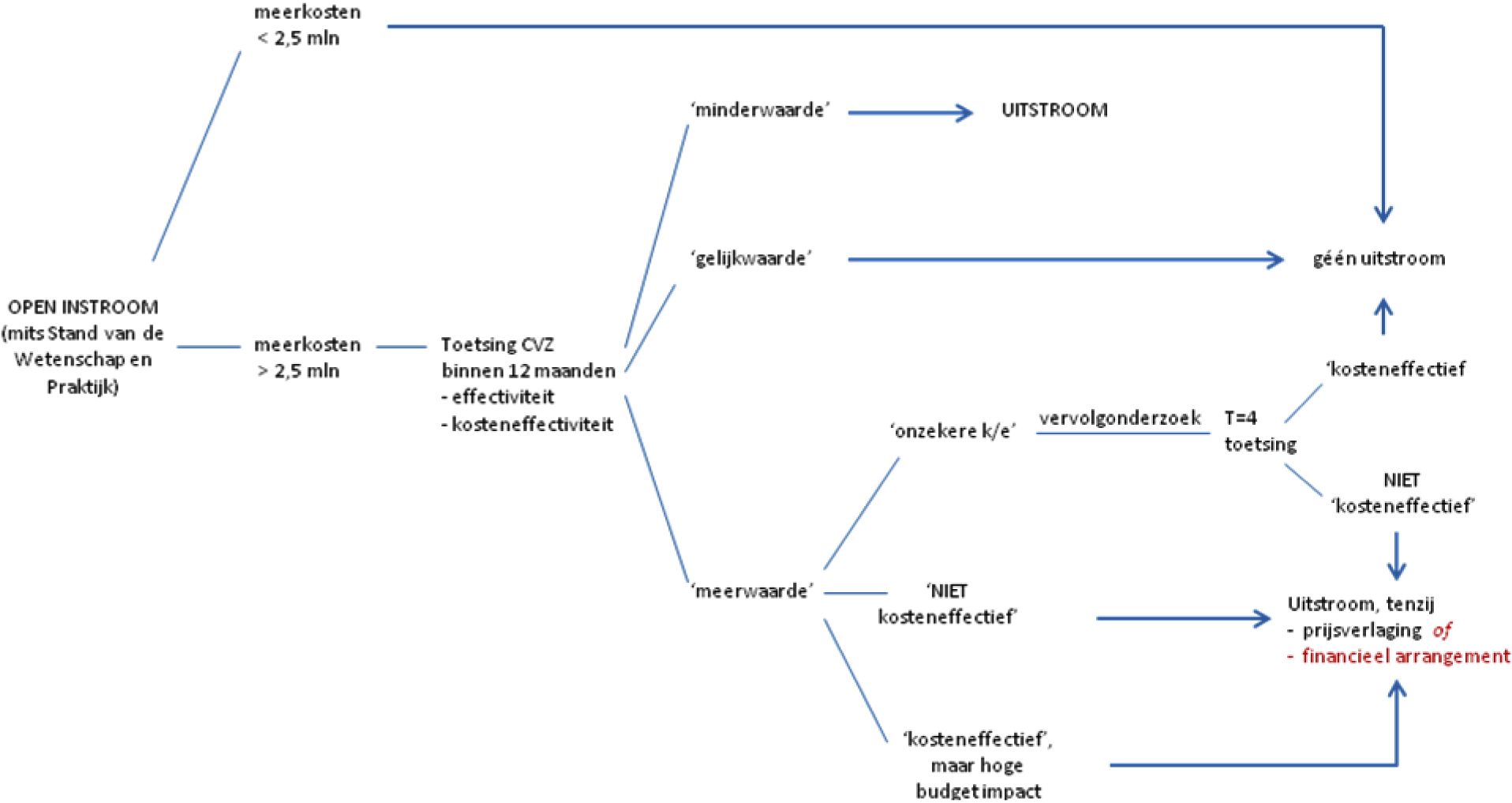
Zoals gezegd wil ik ruimte bieden voor duurdere innovatieve geneesmiddelen als deze ook waarde toevoegen. Als het echter – aanvankelijk, dan wel na voorwaardelijke pakkettoelating – niet aannemelijk is dat de hogere kosten door betere behandeluitkomsten worden gerechtvaardigd, kan dit reden zijn om een geneesmiddel bij die prijs niet op te nemen in het pakket, dan wel uit te laten stromen. Dit speelt niet alleen bij geneesmiddelen die in aanmerking komen voor voorwaardelijke toelating, maar ook bij geneesmiddelen die eerder zijn opgenomen op de «NZa beleidsregel dure geneesmiddelen» en binnenkort de zogenaamde «t=4» herbeoordeling ondergaan. Uitkomsten van die herbeoordeling kunnen voor het CVZ aanleiding zijn om te toetsen aan de pakketcriteria en op basis daarvan mij te adviseren over uitstroom uit het pakket.
Indien bij een geneesmiddel een ongunstige verhouding tussen meerkosten en additionele baten wordt vastgesteld, hoort het op basis van het pakketcriterium kosteneffectiviteit niet in het pakket. Omdat het wel om een effectieve behandeling gaat, is het op zich wel wenselijk dat het in het pakket zit: echter niet tegen die prijs. In dat geval moet de kosteneffectiviteit verbeterd worden, als alternatief voor het niet laten instromen, dan wel laten uitstromen van het geneesmiddel. Daartoe kan de fabrikant voorstellen doen om de kosten van de behandeling te beperken.
Behalve aan een prijsverlaging, kan hierbij worden gedacht aan een variant waarbij de fabrikant het middel tegen kortingen aanbiedt aan instellingen, of een variant waarbij de fabrikant alleen kosten rekent bij succesvolle behandelingen (prijs/prestatieafspraken). Er bestaan diverse varianten van financiële arrangementen. Ik wil in relevante casussen dergelijke voorstellen in overweging nemen bij de pakketbeslissing. Behalve overwegingen van kosteneffectiviteit kan ook het absolute kostenbeslag van een geneesmiddel aanleiding geven voor een financieel arrangement. Sommige individuele producten leggen een onevenredig beslag op de macrokosten.4 Dit is met name zo bij (veelal monopolistische) geneesmiddelen waarbij onvoldoende prijscompetitie los komt. Dit is niet wenselijk, daarnaast is de vraag of bij die gevallen nog wel sprake is van reasonable profit en een maatschappelijk aanvaardbaar verdienmodel van de fabrikant. Bij een hoog macrokostenbeslag is opname dan wel continuering van het geneesmiddel in het pakket dan ook niet zonder meer vanzelfsprekend. In relevante casussen (daar waar zorgverzekeraars zelf geen lagere prijzen kunnen bedingen) ga ik daarom bezien of een financieel arrangement aangewezen is dat de macrokosten kan beperken met behoud van kwaliteit en onbelemmerde patiënttoegang. Denk hierbij aan zogenaamde prijs/ volume constructies of afspraken over terugbetalingen (aan overheid/ zorgverzekeraars) door de fabrikant.
Diverse andere landen passen deze financiële arrangementen al toe.5 Ook in ons (decentrale) stelsel is er m.i. een plaats en noodzaak voor dergelijke instrumenten. De arrangementen interveniëren niet met bestaande bekostigingsinstrumenten dan wel tarieven, maar richten zich op het marktgedrag van de geneesmiddelenleverancier en zijn daarom in principe direct toepasbaar. De bijlage bij deze brief gaat in op de aard en mogelijke plaats van toepassing van de financiële instrumenten in de intramurale en extramurale farmacie (figuur 1 en 2).
Inbedding in het zorgverzekeringsstelsel
Met de nieuwe instrumenten komen bestaande regels voor verzekerde aanspraak niet te vervallen. De instrumenten worden ook niet generiek, maar juist gericht, in individuele gevallen toegepast. De inzet van de instrumenten is uitsluitend voorzien bij nieuwe geneesmiddelen waarbij aanbieders en zorgverzekeraars t.o.v. de leverancier zelf onvoldoende handvatten hebben om te sturen op prijzen/kosten. Dit is in ieder geval het geval bij geneesmiddelen met een monopolistische marktpositie: geneesmiddelen die een unieke plaats in de behandelrichtlijn hebben en nog geen concurrentie ondervinden van vergelijkbare geneesmiddelen. De instrumenten worden in principe ook altijd slechts tijdelijk toegepast: zodra een breder aanbod van concurrerende producten tot meer prijscompetitie leidt, vervalt in principe de noodzaak voor overheidsinterventie en zijn genoemde partijen aan zet. Zo is bij de TNF-alfaremmers, waarbij sprake is van een zeer hoog kostenbeslag, ervoor gekozen om de prijscompetitie in de markt te versterken via de overheveling van deze producten naar de ziekenhuisbekostiging.
Welke stappen worden in 2012 gezet
Samengevat wil ik in 2012 de volgende stappen zetten:
1) Starten met voorwaardelijke toelating bij extramurale geneesmiddelen.
2) Pilot(s) met financiële arrangementen (intramuraal en extramuraal).
3) Nadere beleidsmatige en operationele uitwerking.
Ad 1) Op dit moment wordt voorwaardelijke toelating alleen bij de dure intramurale geneesmiddelen toegepast. Ik wil dit instrument nu ook extramuraal gaan toepassen, en laat me door het CVZ adviseren in welke gevallen dit wenselijk is. Vooralsnog komen alleen nieuwe casussen hiervoor in aanmerking. Op termijn wil ik dit instrument ook inzetten als uitstroomtoets voor bestaande geneesmiddelen. Dit wordt in 2013 bezien.
Ad 2) Indien een geneesmiddel niet kosteneffectief is volgt uitstroom uit het pakket. Dit kan echter voorkomen worden als de fabrikant de kosteneffectiviteit verbetert via een financieel arrangement. Ik wil pilots starten met dergelijke arrangementen. Dit speelt bijvoorbeeld bij intramurale casussen waarbij het doelmatigheidsonderzoek (bij de beleidsregels dure geneesmiddelen) inmiddels na vier jaar is afgerond en de kosteneffectiviteit ter discussie staat, dan wel bij eventuele extramurale geneesmiddelen die voorwaardelijk tot het pakket worden toegelaten. Ook bij geneesmiddelen met een zeer hoog kostenbeslag zal ik met het oog op opname/handhaving in het pakket een financieel arrangement (bv. prijs/volume) overwegen.
Ad 3) De pilots voor voorwaardelijke toelating en financiële arrangementen worden in 2012 in afstemming tussen VWS en CVZ uitgevoerd. Parallel daaraan wordt dit jaar door VWS en CVZ onderzocht hoe te komen tot een structurele inbedding van de instrumenten. Dat vereist inzicht in de operationele en organisatorische implicaties. Uitgezocht moet worden op welk moment in het proces van pakketbeoordeling een financieel arrangement geïnitieerd wordt, waar dit belegd wordt, en welke expertise/capaciteit nodig is. Hierbij worden de ervaringen van de pilots, de zienswijzen van belanghebbende partijen en best practices uit andere landen betrokken.
Hulpmiddelen en medische technologie
Ik wil dit jaar onderzoeken in hoeverre het in deze brief toegelichte systeem van voorwaardelijke pakkettoelating in combinatie met financiële instrumenten kan bijdragen aan verbeterde verzekerde toegankelijkheid en budgettaire beheersing van innovaties in de hulpmiddelensector en medische technologie. Omdat deze markten een andere dynamiek kennen, en ook de regelgeving over het pakketbeheer en de bekostiging afwijkt van die bij geneesmiddelen vereist dit een nadere analyse. Ik zal u in het najaar hier nader over informeren.
Financiële implicaties
Voorwaardelijke pakkettoelating van geneesmiddelen en de inzet van financiële instrumenten hebben zowel positieve als negatieve financiële consequenties. Ik verwacht echter dat de inzet van deze instrumenten op termijn per saldo zal voorzien in doelmatigheidsbesparingen. Bij het onder voorwaarden van vervolgonderzoek (CED) toelaten van een nieuw geneesmiddel dat volgens de huidige kaders ook zou zijn toegelaten, kan een latere aangescherpte pakketbeslissing, dan wel verkregen inzicht in het effectief (doelmatig) gebruik van het middel resulteren in besparingen. Ook eventuele financiële arrangementen bij nieuwe geneesmiddelen met een ongunstige kosteneffectiviteit of hoog kostenbeslag resulteren in besparingen.
Daar staat tegenover dat het voorwaardelijk toelaten van een extramuraal geneesmiddel dat anders niet was toegelaten (omdat de meerwaarde/ kosteneffectiviteit wel aannemelijk was, maar niet voldoende was vastgesteld) tot meeruitgaven kan leiden. Deze laatste meeruitgaven zal ik echter alleen dan honoreren indien daar minderuitgaven tegenover staan, zoals die kunnen voortvloeien uit de financiële instrumenten of eventueel andersoortige maatregelen. Op deze wijze moet geborgd worden dat de nieuwe instrumenten niet leiden tot meeruitgaven en daarmee passen in het financiële kader.
In 2013 zal op basis van de pilots worden bezien hoe de voorwaardelijke toelating (extramuraal) en de financiële instrumenten (intra- en extramuraal) structureel worden ingericht en ingebed, met als randvoorwaarde passendheid in het financiële kader. Dan kan ook bezien worden of de scope voor voorwaardelijke toelating (ook toepassen als uitstroomtoets bij bestaande geneesmiddelen en/of bij alle 1B opnames i.p.v. alleen twijfelgevallen) en financiële instrumenten (uitbreiding naar oligopolistische productgroepen waarbij geen prijscompetitie ontstaat) verbreed kan worden.
Risicogericht pakketbeheer
Onlangs adviseerde het CVZ mij over risicogericht pakketbeheer in de extramurale farmacie.6 Daarin bepleit het CVZ om niet automatisch alle nieuwe geneesmiddelen aan de poort te toetsen (voor pakketopname), maar alleen tot toetsing over te gaan als er met het specifieke geneesmiddel (o.a. financiële) risico’s zijn gemoeid. Daarnaast wil het CVZ ook bij extramurale vergoeding voorwaardelijke pakkettoelating toepassen. Ik neem de voorstellen van het CVZ op hoofdlijnen over. Zoals gezegd zal ik ook extramuraal starten met voorwaardelijke pakkettoelating. Ook ga ik mee in het voorstel voor een meer risicogerichte benadering bij de pakkettoetsing van nieuwe extramurale geneesmiddelen. In afwijking van het advies van CVZ handhaaf ik echter de toetsing aan de poort voor extramurale geneesmiddelen. Die toetsing kan echter wel worden verlicht in gevallen waarbij geen of kleine financiële risico’s zijn gemoeid. Zo is wat mij betreft voor nieuwe geneesmiddelen waarvoor de leverancier géén meerwaarde claimt (de zg. GVS bijlage 1A aanvragen) slechts nog een marginale toetsing door het CVZ vereist. Daarnaast is het wat mij betreft niet langer nodig om de kosteneffectiviteit te toetsen als de verwachte meerkosten van een nieuw geneesmiddel niet hoger zijn dan € 2,5 mln.
Afsluitend
In deze brief heb ik toegelicht op welke wijze voorwaardelijke pakkettoelating in de geneesmiddelenvoorziening een vervolg krijgt en hoe nieuwe financiële instrumenten hier een complementaire rol bij kunnen vervullen. Dit beleid dient een snelle toegang van de patiënt tot waardevolle innovaties te bevorderen tegen betaalbare kosten en meer inzicht te verschaffen in de effectieve toepassing van de innovaties. Met voorwaardelijke pakkettoelating kan ik waardevolle innovaties toch tot het pakket toelaten ook als de grootte van de meerwaarde en de kosteneffectiviteit nog niet vaststaan. Dat is een innovatievriendelijk alternatief voor het model waarbij pakketinstroom wordt opgeschort totdat er meer informatie beschikbaar komt. Daar hoort wel bij dat niet kosteneffectieve geneesmiddelen uit het pakket stromen. Dat is niet altijd makkelijk, maar het is wel een voorwaarde om deze voorwaardelijke toelating in te kunnen voeren. Met de financiële instrumenten adresseer ik de financiële bezwaren van niet-kosteneffectieve behandelingen, dan wel geneesmiddelen met een hoog kostenbeslag.
Ik benadruk dat ik nieuwe maar duurdere geneesmiddelen alleen snel (dat wil zeggen: ook als er nog onzekerheden zijn) tot het pakket kan toelaten als we erop kunnen vertrouwen dat onzekerheden over de kosten en de baten van de innovaties tijdig en gericht worden geadresseerd. Dat betekent dat artsen, beroepsgroepen, ziekenhuizen en de fabrikant zich ook committeren aan vervolgonderzoek als hen dat gevraagd wordt. Er ligt hier een verantwoordelijkheid van alle betrokkenen. Het is van belang dat partijen heldere afspraken maken over de doelen, uitgangspunten en mogelijke implicaties van het vervolgonderzoek. Het CVZ zal hier met partijen invulling aan geven. Vanuit de overheid is er de verantwoordelijkheid om op gepaste en pragmatische wijze met dit instrument om te gaan. Ik heb er alle vertrouwen in dat we gezamenlijk een succesvol vervolg kunnen geven aan dit beleid.
De minister van Volksgezondheid, Welzijn en Sport, E. I. Schippers
Toelichting voorwaardelijke pakkettoelating en financiële instrumenten
In diverse landen is in toenemende sprake van de toepassing van zogenoemde «managed entry arrangements»7 8 9 10. Dit zijn arrangementen tussen een geneesmiddelleverancier en een betaler/zorgaanbieder die onder bepaalde condities verzekerde toegang (voor patiënten) tot een innovatieve technologie mogelijk maakt. Deze arrangementen kunnen via allerlei typen instrumenten worden uitgevoerd met als doel:
a) het bij pakketbeslissingen omgaan met onzekerheid over de relatieve meerwaarde, dan wel kosteneffectiviteit van een innovatief geneesmiddel en/of,
b) het bevorderen van de effectieve toepassing van een innovatief geneesmiddel, en/of
c) het adresseren van financiële bezwaren
Bij doelen a) en b) wordt bij pakketinstroom de voorwaarde gesteld dat binnen een bepaalde termijn de therapeutische meerwaarde, kosteneffectiviteit dan wel de effectieve toepassing van een nieuwe behandeling nader inzichtelijk worden gemaakt. In de brief wordt dit aangeduid als «voorwaardelijke pakkettoelating». Bij doel c) worden financiële bezwaren van pakketopname beperkt via een door de fabrikant voorgesteld financieel arrangement. In de brief wordt dit aangeduid als «financiële instrumenten». Hieronder wordt in algemene zin nader ingegaan op deze arrangementen.
Ad a) en b) Voorwaardelijke Pakkettoelating: omgaan met onzekerheid
Bij dit type arrangement wordt de pakkettoelating van het geneesmiddel, en eventueel daarbij ook besluitvorming over prijs/kosten, gekoppeld aan (het via vervolgonderzoek verplicht inzichtelijk maken van) de therapeutische meerwaarde en/of de doelmatigheid van de behandeling. Dit instrument ondersteunt besluitvorming over pakkettoelatingen in het geval van onzekere of beperkte gegevens. Bij nieuwe producten kunnen er nog twijfels bestaan over de relatieve effectiviteit (meerwaarde), veiligheid of doelmatigheid van het middel, zowel bij de hele patiëntenpopulatie waarvoor het middel is geregistreerd, als bij bepaalde subgroepen van patiënten. Hier speelt dat de middelen enkel nog in onderzoekssetting zijn gebruikt; er kunnen dus twijfels zijn over effectiviteit of veiligheid in de praktijk, bijvoorbeeld als gevolg van het effect van therapietrouw, of als gevolg van de inzet bij een bredere patiëntenpopulatie.
Een instrument dat hier wordt toegepast is Coverage with Evidence Development (CED). Bij CED wordt de afspraak gemaakt dat een middel tijdelijk wordt opgenomen, onder de voorwaarde dat aanvullend onderzoek wordt gedaan om de onzekerheden op te lossen. Na een bepaalde periode (doorgaans een aantal jaar) vindt een herbeoordeling plaats en volgt een definitieve pakketbeslissing. Het kan hier gaan om producten waarbij door de bestaande onzekerheden volgens de huidige criteria opname in het pakket niet mogelijk is. Het kan echter ook gaan om middelen waarbij opname in het pakket wel mogelijk is, maar waarbij desondanks onzekerheden bestaan die opgelost dienen te worden, bijvoorbeeld om de effectieve (doelmatige) inzet van de middelen te bevorderen.
In beide gevallen kan de oplossing zijn om een geneesmiddel op te nemen in het pakket onder de voorwaarde dat aanvullend onderzoek plaatsvindt om de bestaande onzekerheden op te lossen.
Met fabrikant en/of met veldpartijen moeten goede afspraken gemaakt worden over de onderzoeksvragen en de termijn waarbinnen de uitkomsten aangeleverd moeten worden. Dit instrument wordt bij de dure intramurale geneesmiddelen al in Nederland toegepast.
Het CVZ toetst of dergelijk aanvullend onderzoek een vereiste is voor pakketopname. Hierbij zijn de volgend criteria denkbaar:
• Het betreft een geregistreerde indicatie
• De therapeutische meerwaarde is onzeker
• Het betreft een «unmet medical need» (geen alternatieve behandeling mogelijk; aanzienlijke ziektelast)
• Het is niet te verwachten dat fabrikant of veld de onzekerheid op voorhand zelf zal oplossen of de medical need is dermate groot, dat het niet wenselijk is hierop te wachten
• Het is aannemelijk dat de onzekerheid binnen afzienbare tijd opgelost wordt
• Het kostenbeslag is, in het licht van de bestaande onzekerheden, acceptabel
Ad c) Financiële Arrangementen
Een financieel arrangement is aan de orde als de pakketopname van een geneesmiddel gepaard gaat met de volgende financiële bezwaren:
− het geneesmiddel leidt tot een zeer hoog kostenbeslag
− er is een ongunstige verhouding tussen de meerprijs en de toegevoegde waarde (kosteneffectiviteit) van een nieuw geneesmiddel, of deze kan niet goed worden vastgesteld. In deze gevallen kan via een financieel arrangement een behandeling toch instromen in het pakket, dan wel uitstroom worden voorkomen.
Kostenbeslag als financieel risico
In het huidige systeem kunnen verschillende partijen onderling over de prijs van een geneesmiddel onderhandelen. Echter, bij nieuwe innovatieve geneesmiddelen met weinig concurrentie, is er een grote marktmacht voor de leverancier van het product, zeker als via de Zorgverzekeringswet de aanspraak op het nieuwe middel is geregeld en het middel ook een plaats in de behandelrichtlijn heeft. De situatie bestaat dan dat de arts het middel voor moet schrijven, de patiënt er aanspraak op heeft en de zorgverzekeraar het middel moet vergoeden, terwijl de fabrikant zelf de prijs stelt. De prijs wordt wel beperkt door de Wet Geneesmiddelen Prijzen, en mogelijk ook door de kosteneffectiviteittoets voor de pakketbeslissing, maar er kan afhankelijk van het volume dan toch sprake zijn van een hoog kostenbeslag. Dit risico kan via een financieel arrangement worden geadresseerd/beperkt, mét waarborgen voor behoud van toegang en kwaliteit van zorg, door op het niveau van de overheid te komen tot arrangementen m.b.t. de prijs van het geneesmiddel, de behandelingskosten dan wel een prijs/volume arrangement. Essentie bij deze arrangementen is dat de toegang voor patiënten die zijn aangewezen op het geneesmiddel gewaarborgd is.
Ongunstige of onzekere verhouding tussen kosten en baten
Indien er sprake van een ongunstige kosteneffectiviteit van de behandeling (de meerkosten worden niet door substantiële meerwaarde gerechtvaardigd), of de kosteneffectiviteit kan niet goed worden vastgesteld, kunnen zogenoemde risk-sharing instrumenten worden toegepast om tot een meer gunstige kosten-baten verhouding te komen. Met een pay for performance arrangement kan de fabrikant bijvoorbeeld toezeggen dat alleen succesvolle behandelingen in rekening worden gebracht. Doordat de betaler (overheid of zorgverzekering) en fabrikant afspraken maken om de uitgaven aan het middel te verminderen, en daarmee de doelmatigheid te vergroten, kan aan het bezwaar van onvoldoende kosteneffectiviteit, dan wel onvoldoende informatie daarover, tegemoet worden gekomen.
Als het instrument wordt toegepast bij onvoldoende informatie over de kosteneffectiviteit, blijven de onzekerheden bestaan, maar wordt het bijbehorende risico gedeeld door de betaler (die wellicht te veel betaalt) en de fabrikant (die wellicht te weinig ontvangt). Als onzekerheden bestaan die een doorslaggevende rol spelen bij de pakketbeslissing bestaat in principe de voorkeur voor een CED traject, omdat er dan wordt toegewerkt naar een definitieve beslissing. Als dit echter om praktische of uitvoeringstechnische redenen niet mogelijk blijkt, is het pay for performance arrangement een mogelijkheid. Hieronder volgen enkele casussen uit het buitenland:
• Een ziekenhuis of zorgverzekeraar betaalt alleen voor een middel als bewezen is dat het effectief is bij patiënt. Voorbeeld: In Engeland bestond er een overeenkomst met de fabrikant waarbij het dure geneesmiddel bortezomib door fabrikant om niet werd verstrekt in gevallen waarbij het middel niet aansloeg, te bepalen via een eiwittest.
• De fabrikant betaalt de eerste x maanden van het gebruik; pas als het middel langer gebruikt omdat het aanslaat moet het ziekenhuis of zorgverzekeraar betalen. Voorbeeld: In Italië hebben dat fabrikanten van Alzheimer middelen toegezegd de eerste drie maanden van het gebruik betalen. Pas als therapie wordt voortgezet, zijn de kosten voor de zorgverzekeraar.
• Zolang werkzaamheid of doelmatigheid niet voldoende bewezen is, krijgt een geneesmiddel een lagere prijs of moet er korting worden gegeven aan de betaler.
Figuur 1 en 2 geven weer in welke situaties, intramuraal dan wel extramuraal, vervolgonderzoek en/of een financieel arrangement is aangewezen (voorlopige invulling).
FIGUUR 1 – Voorwaardelijke pakkettoelating intramuraal (Zvw prestatie Geneeskundige Zorg) – concept
FIGUUR 2 – Voorwaardelijke pakkettoelating extramuraal (Zvw prestatie Farmaceutische Zorg) – concept
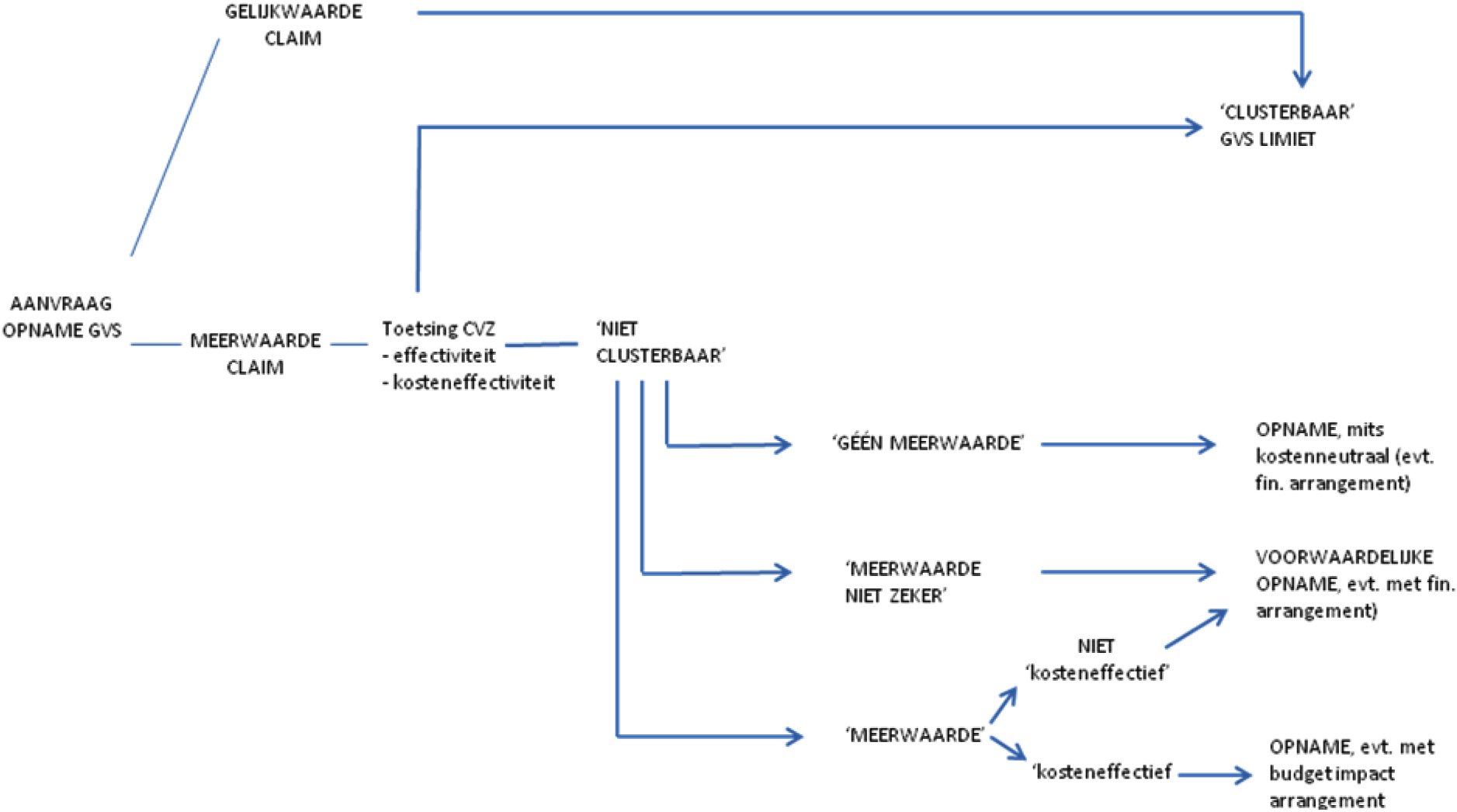
Hierbij stromen nieuwe geregistreerde geneesmiddelen in het pakket onder voorwaarde dat later wordt besloten over definitieve instroom dan wel uitstroom o.b.v. bij pakketinstroom uitgevraagde nadere gegevens over de therapeutische (meer)waarde, kosteneffectiviteit en effectieve toepassing (coverage with evidence development (CED)).
bij het huidige « ja/nee» systeem stroomt het merendeel van de gevallen immers op basis van een eenmalige toets in het GVS, terwijl straks een hertoetsing aan de orde kan zijn.
In 2010 en 2011 (bron: SFK en NZa) hadden in totaal 41 geneesmiddelen een budget impact > € 20 mln, (bij minimaal 2 daarvan was de budget impact > € 50 mln, bij één > € 70 mln, bij twee > € 100 mln en bij twee > € 150 mln).
Risk sharing schemes for pharmaceuticals: terminology, classification and experiences; Eminet, 2009.
Experiences and impact of European risk-sharing schemes focusing on oncology drugs; Eminet, 2011.
Sharing the burden: could risk-sharing change the way for healthcare?; Stockholm Network, 2010.
Risk sharing arrangements for pharmaceuticals: potential considerations and recommendations for European payers; Adamski et al.; BMC Health Services Research, 2010.
Kopieer de link naar uw clipboard
https://zoek.officielebekendmakingen.nl/kst-29477-186.html
De hier aangeboden pdf-bestanden van het Staatsblad, Staatscourant, Tractatenblad, provinciaal blad, gemeenteblad, waterschapsblad en blad gemeenschappelijke regeling vormen de formele bekendmakingen in de zin van de Bekendmakingswet en de Rijkswet goedkeuring en bekendmaking verdragen voor zover ze na 1 juli 2009 zijn uitgegeven. Voor pdf-publicaties van vóór deze datum geldt dat alleen de in papieren vorm uitgegeven bladen formele status hebben; de hier aangeboden elektronische versies daarvan worden bij wijze van service aangeboden.
