Kamerstuk
| Datum publicatie | Organisatie | Vergaderjaar | Dossier- en ondernummer | Datum ontvangst |
|---|---|---|---|---|
| Eerste Kamer der Staten-Generaal | 2006-2007 | 29359 nr. D |
Zoals vergunningen, bouwplannen en lokale regelgeving.
Adressen en contactpersonen van overheidsorganisaties.
U bent hier:

| Datum publicatie | Organisatie | Vergaderjaar | Dossier- en ondernummer | Datum ontvangst |
|---|---|---|---|---|
| Eerste Kamer der Staten-Generaal | 2006-2007 | 29359 nr. D |
Ontvangen 16 oktober 2006
Met belangstelling heb ik kennis genomen van de bijdragen van de fracties aan het Voorlopig Verslag bij het onderhavige voorstel van wet. De leden van de fracties hadden nog een aantal vragen en opmerkingen, waarop ik in deze memorie graag in zal gaan.
Voorts wil ik de aandacht van uw Kamer vragen voor het volgende. Dit wetsvoorstel bevat de implementatie van twee Europese richtlijnen uit 2004 die uiterlijk op 30 oktober 2005 in Nederlandse wetgeving verwerkt hadden moeten zijn.
Omdat eind 2003 het voorstel voor een nieuwe Geneesmiddelenwet reeds bij de Tweede Kamer aanhangig was, werd geoordeeld dat implementatie van deze richtlijnen via een nota van wijziging op dit wetsvoorstel de snelste weg zou zijn. Implementatie in de bestaande Wet op de Geneesmiddelenvoorziening lag bovendien niet voor de hand omdat die wet wordt ingetrokken bij de inwerkingtreding van de Geneesmiddelenwet.
De voorbereiding en behandeling in de Tweede Kamer hebben echter meer echter tijd gevergd dat aanvankelijk was voorzien. Nederland is op 5 december 2005 door de Europese Commissie in gebreke gesteld wegens het niet voldoen aan de verplichting tot tijdige implementatie van de richtlijnen 2004/24 en 2004/27. In het antwoord aan de Europese Commissie op haar met redenen omklede advies van 28 juni 2006, waarin Nederland wordt verzocht om binnen twee maanden na die datum aan het advies te voldoen, heeft de regering toegezegd alles in het werk te zullen stellen om het wetsvoorstel zo spoedig mogelijk in werking te laten treden. Ik zou het op prijs stellen indien uw Kamer hieraan zoveel als mogelijk mee zou willen werken.
De leden van de fractie van de PvdA vinden het wetsvoorstel niet altijd even toegankelijk en menen dat een andere structuur een betere wettekst had opgeleverd.
Bij het ontwerpen van het oorspronkelijke wetsvoorstel, dat bij koninklijke boodschap van 8 december 2003 bij de Tweede Kamer is ingediend, is zoveel mogelijk de structuur gevolgd van Richtlijn 2001/83/EG van het Europees Parlement en de Raad van 6 november 2001 tot vaststelling van een communautair wetboek betreffende geneesmiddelen voor menselijk gebruik (PbEG L 311). De structuur van Richtlijn 2001/83/EG is ten tijde van haar totstandkoming door Nederland niet ter discussie gesteld. Voor de Raad van de Europese Gemeenschappen is het geen onderhandelingspunt geweest. Het maken van een wetsvoorstel met een andere structuur zou overigens meer tijd hebben gevergd. Richtlijn 2001/83/EG is van oorsprong een codificatierichtlijn; zij bevatte derhalve in 2001 geen inhoudelijke aanpassingen aan nieuwe ontwikkelingen op het gebied van wetenschap en techniek en aan de jurisprudentie van het Hof van Justitie op het gebied van geneesmiddelen. Een jaar na de indiening van dit wetsvoorstel bij de Tweede Kamer is codificatierichtlijn 2001/83/EG ingrijpend gewijzigd door de richtlijnen 2004/24/EG en 2004/27/EG. De structuur van richtlijn 2001/83/EG is evenwel niet gewijzigd. Ik meen ten slotte dat de hoofdstukindeling van de Geneesmiddelenwet overzichtelijk en duidelijk is. Zij volgt als het ware de «levenscyclus» van het produkt geneesmiddel: van fabricage tot terhandstelling aan de patiënt, aangevuld met voortdurende activiteiten als geneesmiddelenbewaking, geneesmiddelenreclame en het toezicht op de naleving.
De leden van de SP-fractie merken op dat met het aannemen van het wetsvoorstel Wijziging van Hoofdstuk III van de Wet op de Geneesmiddelenvoorziening en van afdeling 5 van titel 7 van Boek 7 van het Burgerlijk Wetboek (Kamerstuk 28 494) artikel 19 van de WOG wordt afgeschaft. Dit artikel verbood apothekers om in meer dan één apotheek de artsenijbereidkunst uit te oefenen. Het aangenomen amendement van de leden Buijs en Arib (Kamerstuk 29 359, nr. 72) op artikel 61 van wetsvoorstel 29 359 waarborgt volgens de leden van de SP-fractie dat er in een apotheek tenminste één apotheker in persoon aanwezig is om de vereiste taken en verantwoordelijkheden voor de farmaceutische zorg en dienstverlening te vervullen. Naar de mening van deze leden zou het logischer zijn geweest artikel 19 niet af te schaffen. Of is er juridisch een verschil tussen artikel 19 en het aangenomen amendement, zo vragen deze leden.
Ik kan mij voorstellen dat de leden van de SP-fractie het logischer hadden gevonden om artikel 19 WOG niet af te schaffen. Er is namelijk geen inhoudelijk verschil tussen artikel 19 en het aangenomen amendement 72. Dit amendement strekte er immers toe de ook in de Geneesmiddelenwet voorgenomen afschaffing van artikel 19 ongedaan te maken en de bepaling opnieuw op te nemen. Het lag dan ook voor de hand dat de Tweede Kamer de in voorstel 28 494 voorgestelde afschaffing eveneens zou verwerpen. Ik heb de Tweede Kamer daarom in overweging gegeven om over de beide onderdelen van wetsvoorstel 28 494 (wijziging WOG, wijziging BW) afzonderlijk te stemmen (brief van 3 april 2006, 29 359, nr. 80, blz. 1). De Tweede Kamer heeft wetsvoorstel 28 494 echter in zijn geheel aangenomen, waardoor artikel 19 uit de WOG wordt geschrapt. Dit heeft echter geen consequenties omdat gelijktijdig met de inwerkingtreding van de Geneesmiddelenwet de WOG komt te vervallen. Op één moment wordt artikel 19 WOG afgeschaft, vervalt de WOG, en treedt de Geneesmiddelenwet in werking waarin de materiële opvolger van artikel 19 WOG is opgenomen (artikel 61 lid 3). Vanuit dit gezichtspunt bezien is er voor Uw Kamer geen beletsel om wetsvoorstel 28 494 in zijn geheel aan te nemen.
De leden van de fracties van de SGP en van de ChristenUnie vragen zich af waarom in het wetsvoorstel niet geanticipeerd wordt op de Apotheker Specialist.
In het algemeen wordt het aan de beroepsgroepen zelf overgelaten om al dan niet normen te ontwikkelen voor specialisaties. Ook is het mogelijk dat de beroepsgroep zelf certificeringen maakt voor gespecialiseerde apotheken. De nieuwe Geneesmiddelenwet staat verdere specialisering van de apotheker op geen enkele wijze in de weg.
1. Belangenverstrengeling artsen en apothekers
De leden van de CDA-fractie vragen naar de stand van zaken naar aanleiding van een uitspraak van het Gerechtshof te ’s-Hertogenbosch inzake belangverstrengeling.
Er is cassatieberoep ingesteld tegen de uitspraak van het Gerechtshof te ’s-Hertogenbosch van 11 april 2006 door SOFA B.V., de beherende vennootschap van apotheek Boxmeer. Naar verwachting zal de Hoge Raad eind 2007 of begin 2008 arrest wijzen in deze aangelegenheid.
De tekst van artikel 18 Besluit uitoefening artsenijbereidkunst (BUA) is in aangescherpte vorm opgenomen in het concept-Besluit houdende uitvoeringsvoorschriften krachtens de Geneesmiddelenwet (Besluit geneesmiddelenwet), dat voor advies aan de Raad van State is gezonden. Inmiddels heeft de Raad van State advies uitgebracht.
In het voorliggende wetsvoorstel hebben de leden van de CDA-fractie terzake van de belangenverstrengeling arts-apotheker geen grondslag aangetroffen voor het opleggen van enige straf, een bestuurlijke boete daaronder begrepen. Deze leden merken op dat de minister heeft aangegeven (Handelingen Tweede Kamer 68, pagina 4343, linkerkolom), dat naar zijn verwachting de door hem gedane uitspraak in de Kamer in eventuele procedures bij de rechter een rol zullen spelen. Voorzover de minister daarbij denkt aan de mogelijkheid, dat met terugwerkende kracht alsnog sancties zouden kunnen worden uitgesproken lijkt dat de leden van de CDA-fractie wel tamelijk vergaand. Anders gezegd: in het kader van de afweging of wetgeving op dit onderwerp nodig is, achten de leden van de CDA-fractie het niet verstandig om er vanuit te gaan, dat terugwerkende kracht aanvaardbaar is.
De leden van de CDA-fractie hebben gelijk dat het met terugwerkende kracht opleggen van boetes niet aan de orde kan zijn. Mijn opmerking tijdens het plenair overleg had betrekking op de juridische aanvaardbaarheid van constructies die leiden tot belangenverstrengeling, niet op het (met terugwerkende kracht) beboeten ervan.
De wettelijke grondslag voor strafoplegging is gelegen in artikel 101, dat stelt dat niet alleen bij, maar ook krachtens de aldaar genoemde artikelen bestuurlijke boetes kunnen worden opgelegd.
De leden van de SP-fractie vragen of de NMa al onderzoek doet naar ongewenste belangenverstrengeling.
De Nederlandse Zorgautoriteit heeft laten weten dat zij dit onderzoek zal gaan doen. Dit onderzoek zal in 2007 worden uitgevoerd. Op basis van de uitkomsten van dat onderzoek kan worden bezien of de aanscherping zoals opgenomen in het Besluit Geneesmiddelenwet voldoende is of aanvulling behoeft.
De leden van de fracties van de SGP en de ChristenUnie vragen hoe kan worden voorkomen dat er financiële belangenverstrengeling ontstaat tussen artsen en apothekers.
Ook thans is belangenverstrengeling reeds verboden in artikel 18 van het Besluit Uitoefening Artsenijbereidkunst (BUA). De tekst van dit artikel zal in aangescherpte vorm terugkeren in het Besluit Geneesmiddelenwet. Daarbij zal ook de belangenverstrengeling tussen artsen en apothekers meer expliciet dan thans worden verboden.
De leden van de CDA-fractie zouden graag willen vernemen wat de ontwikkeling is van de beroepsprocedures tegen besluiten van het CBG.
Er zijn mij geen gevallen bekend waarbij de rechter het CBG heeft bevolen om een eerder geweigerde handelsvergunning toch af te geven. Op dit punt is dus geen sprake van een te signaleren ontwikkeling. Ten aanzien van procedures tegen beslissingen van het CBG om een generiek geneesmiddel toe te laten, kan wel vastgesteld worden dat het steeds vaker voorkomt dat dergelijke procedures worden gestart door de innovatieve industrie.
3. Juridisch-technische bedenkingen
De vraag van de leden van de CDA-fractie of het woord «vervalt» in artikel 47 van het wetsvoorstel betekent dat de handelsvergunning van rechtswege vervalt, beantwoord ik bevestigend. De taak van het College ter beoordeling van geneesmiddelen hierbij is dat hij de vergunninghouder daarvan op de hoogte stelt.
De leden van de CDA-fractie wijzen er in dit verband op dat artikel 47, vierde lid, dat bepaalt dat een willekeurige periode van drie opeenvolgende jaren leidt tot het vervallen van de vergunning. Hierover merk ik het volgende op. Artikel 47, vierde lid, eerste volzin, bevat de implementatie van zowel het vierde lid als het vijfde lid van artikel 24 van de richtlijn. Het vierde lid van artikel 24 van de richtlijn heeft betrekking op een geneesmiddel dat nooit in de handel is gebracht binnen een periode van drie jaar na de verlening van de handelsvergunning. Het vijfde lid van artikel 24 van de richtlijn heeft betrekking op een geneesmiddel dat in de handel was gebracht maar vervolgens gedurende een periode van drie jaar niet meer in de handel is. De formulering van artikel 47, vierde lid, eerste volzin, «een geneesmiddel gedurende drie opeenvolgende jaren niet daadwerkelijk in de handel is gebracht of is geweest» impliceert dat de periode van drie jaar ingaat op de dag dat het geneesmiddel verhandeld mag worden, onderscheidenlijk op de dag waarop de handel in het geneesmiddel wordt gestopt. Ingevolge artikel 49 van het wetsvoorstel is de vergunninghouder verplicht het College op de hoogte te brengen van de datum van het in de handel brengen, onderscheidenlijk van het tijdelijk of blijvend stoppen met de handel.
Anders dan de leden van de CDA-fractie, zie ik geen inhoudelijk verschil tussen artikel 47, vierde lid, eerste volzin, van het wetsvoorstel en artikel 24, vierde en vijfde lid, van de richtlijn. Er is dus geen verdergaande beperking dan waartoe de richtlijn verplicht.
De leden van de CDA-fractie constateren dat op overtreding van artikel 78 ten onrechte geen sanctie is gesteld. Zij hebben hierin gelijk Ik zal mij inspannen om op korte termijn alsnog in een passende sanctiestelling te voorzien.
De leden van de fractie van het CDA hebben een bedenking met betrekking tot artikel 80, eerste lid. Zij kenschetsen de mogelijkheid om, zonodig in afwijking van de wet, bij ministeriële regeling tijdig te kunnen voorzien in implementatie van comitologierichtlijnen inzake geneesmiddelenbewaking als bepaald vergaand. Tegelijk stellen zij de vraag of de in de Geneesmidelenwet neergelegde regels op dit punt zich er wel voor lenen in de wet te worden neergelegd of dat die juist beter in een algemene maatregel van bestuur hadden kunnen worden opgenomen. Voorts vragen zij of de voorliggende regeling zich verdraagt met de Grondwet.
Ik kan de gedachtelijn van de leden van de CDA-fractie op dit punt niet geheel volgen. Immers, in ons staatsrechtelijk bestel brengt het primaat van de wetgever mee dat de essentiële elementen van een regeling worden neergelegd in de wet in formele zin, zodat de volksvertegenwoordiging als medewetgever bij de vaststelling daarvan ten volle haar invloed kan doen gelden. Geneesmiddelenbewaking is uit oogpunt van bescherming van de volksgezondheid een activiteit die qua volksgezondheidsbelang gelijk is te achten aan het belang van het toetsen van geneesmiddelen door het College ter beoordeling van geneesmiddelen. Dat is voor de Europese Commissie en voor het Europees Parlement en de Raad gezamenlijk kennelijk de reden geweest om het onderwerp geneesmiddelenbewaking in het communautaire wetboek voor geneesmiddelen voor menselijk gebruik zelf op te nemen. Regeling daarvan op wetsniveau, voorzover dat mogelijk is, is dan ook aangewezen. Ik zie dan ook niet in waarom het overlaten van de vaststelling van deze regels aan de Kroon, zoals de leden van de CDA-fractie lijken te bepleiten, met het oog op het primaat van de wetgever een goed alternatief voor regeling bij wet zou zijn.
De richtlijn voorziet er voorts in dat via een snellere (comitologie)procedure aanvullende regels kunnen worden gesteld. Dat brengt mee dat ons land ook gehouden is in voorkomend geval, soms binnen zeer korte tijd, te voorzien in implementatie van uit die Europese regelgeving voortvloeiende wijzigingen van de bepalingen inzake geneesmiddelenbewaking. Louter met het oog daarop is in artikel 80 voorzien in de mogelijkheid om zonodig bij ministeriele regeling in die tijdige implementatie te voorzien, zelfs indien daarbij onverhoopt tijdelijk van de desbetreffende artikelen van de Geneesmiddelenwet zou moeten worden afgeweken. Die regeling moet vervolgens zo snel mogelijk alsnog door regelgeving bij amvb worden vervangen. Daarmee is, maar dan beperkt tot het geval dat van de artikelen van de wet zou moeten afgeweken, gekozen voor het niveau van regelgeving dat de leden van de CDA-fractie voor de hele regeling zouden willen overwegen.
Overigens ben ik alleszins bereid om te bevorderen dat bij een komende wetswijziging alsnog een clausulering in artikel 80, eerste lid, wordt opgenomen die duidelijk maakt dat de bevoegdheid slechts kan worden gebruikt als dat noodzakelijk is voor de implementatie van een bindend besluit van het Europees Parlement en de Raad gezamenlijk of van de Commissie van de Europese Gemeenschappen. Bij een dergelijke wijziging kan er eventueel in worden voorzien dat definitieve regeling in plaats van bij amvb plaatsvindt door middel van wetswijziging.
De leden van de fractie van de PvdA vragen of kan worden uiteengezet welke rol bij het opstellen van deze wet aan de apotheker is toegedacht ten aanzien van de voorlichting aan artsen. Kan de bepaling met betrekking tot de aanwezigheid van apothekers in hun winkel niet contraproductief zijn voor het inhoud geven aan de taak om artsen goed voor te lichten dan wel behulpzaam te zijn bij het instellen van een adequate medicatie? Moet er geen voorrang worden gegeven aan de voorlichting aan artsen boven die aan patiënten. Welke rol is toegedacht aan de arts of de apothekersassistent bij de voorlichting aan cliënten?
Ik deel de opvatting van de leden van de fractie van de PvdA dat de adviserende rol van de apotheker belangrijk is. De voorlichtende rol van de apotheker richting zowel voorschrijver als richting patiënt waardeer ik als belangrijk. Het een hoeft het ander echter niet in de weg te staan. In de praktijk worden beide rollen doorgaans vervuld terwijl de apotheker beschikbaar is in de apotheek. Artsen bellen bij twijfel uit eigen initiatief met de apotheker of de apotheker neemt naar aanleiding van een afgegeven recept contact op met de behandelende arts. Voorts maken artsen en apothekers via het farmacotherapeutisch overleg tijd vrij voor spiegelinformatie over het voorschrijfgedrag, staan stil bij nieuwe geneesmiddelen en maken afspraken over het voorschrijven bij specifieke indicaties. Dit overleg vindt plaats buiten de reguliere openingstijden van de huisartsenpraktijk en apotheek.
5. College ter beoordeling van geneesmiddelen
De leden van de PvdA fractie vragen zich af waarom er geen maximale zittingstermijn is verbonden aan het lidmaatschap van het CBG.
Het CBG is een zelfstandig bestuursorgaan zoals bedoeld in het voorstel voor een Kaderwet zelfstandige bestuursorganen, dat momenteel bij de Eerste Kamer voorligt. Voornoemd wetsvoorstel beoogt via het stellen van algemene regels ordening aan te brengen in de organisatieregeling van zelfstandige bestuursorganen. Deze wet is in het algemeen ook van toepassing op het CBG. Alleen onderwerpen die specifiek voor het CBG zouden moeten gelden zijn geregeld in de nieuwe Geneesmiddelenwet. De termijn van benoeming wijkt af van die in voornoemd wetsvoorstel voor een Kaderwet. Een benoeming is voor ten hoogste vier jaren, korter kan derhalve ook. De leden zijn ook herbenoembaar. Een maximale zittingstermijn is niet noodzakelijk. De leden worden om de vier jaar benoemd op grond van hun wetenschappelijke deskundigheid. Deze wetenschappelijke deskundigheid kan door de tijdsbepaling van de benoeming telkens worden geverifieerd en de eisen die hier aan gesteld kunnen worden aangepast aan huidige wetenschappelijke stand van zaken. Een maximale zittingstermijn wordt niet noodzakelijk geacht.
Voorts vragen deze leden zich af waarom de term «ongewenste nevenfuncties» niet gedefinieerd is. Deze is niet nader gedefinieerd omdat deze term zeer breed opgevat dient te worden. De grens is gelegen in de eis dat een andere (neven)functie niet aan een goede functievervulling of de handhaving van de onafhankelijkheid van het lid in de weg mag staan.
Artikel 8, derde lid, is opgenomen om de onafhankelijkheid van het CBG te waarborgen: de desbetreffende ambtenaren staan onder gezag van het CBG.
De leden van de SP-fractie stellen een aantal vragen over het College ter beoordeling van geneesmiddelen en de openbaarheid van gegevens.
– Wie toetst de onafhankelijkheid van de leden van het CBG? Als er toch banden zijn met de farmaceutische industrie, wat zijn dan de sanctiemogelijkheden? Is er een instantie waar burgers/beroepsbeoefenaren eventueel hun zorgen over gebrek aan onafhankelijkheid kunnen neerleggen?
De (neven)functies van de leden van het CBG worden openbaar gemaakt door terinzagelegging bij het CBG en bij het ministerie van VWS. De leden van het CBG melden het voornemen tot het aanvaarden van nieuwe nevenfuncties bij de minister van VWS. De minister van VWS toetst of er sprake is van ongewenste belangenverstrengeling. In het uiterste geval kan de minister van VWS een lid van het CBG om die reden ontslaan. Iedereen kan zorgen over de onafhankelijkheid van leden van het College bij de minister neerleggen.
– Kan de minister optreden bij onvoldoende alert optreden van het CBG?
De minister van VWS kan optreden in geval van taakverwaarlozing door het CBG. De minister kan dan de voorziening treffen die hij passend acht. Voordat de minister zo’n voorziening treft zal hij eerst het College in de gelegenheid stellen zijn taak alsnog uit te voeren. Het moet hierbij overigens gaan om ernstige gevallen van taakverwaarlozing.
– De industrie moet het CBG alle informatie verschaffen die nodig is voor zijn taak. Het beoordelingsrapport van het CBG is openbaar, met uitzondering van vertrouwelijke gegevens. Wie bepaalt wat vertrouwelijke gegevens zijn? Wat zijn daar criteria voor? Wordt het rapport ook openbaar als de registratie wordt afgewezen? Als een fabrikant ziet aankomen dat het CBG negatief zal beschikken kan hij het verzoek tot registratie ook intrekken. Wat doet het CBG in zo’n geval? Dezelfde vraag geldt voor de Europese instantie de EMEA.
Artikel 46 lid 6 van de Geneesmiddelenwet bepaalt dat het College besluiten met betrekking tot het weigeren, schorsen, of intrekken van een handelsvergunning openbaar maakt, met weglating van commercieel vertrouwelijke gegevens. Dit geldt ook voor de voortijdige intrekking van een aanvraag. Ook EMEA handelt op deze manier bij de Europese aanvragen. De motivering van een negatief oordeel dat ten grondslag heeft gelegen aan de intrekking zal onderdeel uitmaken van het openbare vergaderverslag van het College, zeker indien hiermee een volksgezondheidsdoel wordt gediend.
De vraag wat commercieel vertrouwelijke gegevens zijn is een kwestie van uitleg van Europese regels. In laatste instantie is het de (Europese) rechter die bevoegd is dit begrip uit te leggen. De criteria die het College thans hanteert zijn vergelijkbaar met de criteria die in de Wet openbaarheid van bestuur worden genoemd als valide reden om niet op een verzoek om openbaarheid in te gaan. De Nederlandse rechter accepteert deze criteria. De EMEA heeft onlangs aangegeven hoe zij het begrip «commercieel vertrouwelijk» wil hanteren.
6. Positie apotheekhoudend huisarts
De leden van de VVD-fractie vragen zich ten aanzien van de regeling voor apotheekhoudende huisartsen af of het wel aan de overheid is om details te regelen zoals de kilometerafstand. Zijn dit nu eigenlijk geen zaken die gewoon aan de beroepsgroepen kunnen worden overgelaten? Het komt de VVD-fractie voor dat de wet niet verder zou moeten gaan dan een globale richtlijn.
Het in het wetsvoorstel genoemde kilometercriterium is ontleend aan de bestaande jurisprudentie. Aan de hand van het kilometercriterium wordt bepaald of een huisarts vergunning krijgt om een apotheek te houden. Ik zou dit geen detail willen noemen maar de kern van de regeling. In de praktijk wordt reeds lang met dit criterium gewerkt. Het criterium is bij amendement met zoveel woorden in de wet opgenomen met het oog op de rechtszekerheid.
Geldt het afstandscriterium, zoals geamendeerd is vastgelegd in de wet, voor de afstand huisarts – apotheek of patiënt – apotheek, zo vragen de leden van de SP-fractie. Is de afstand hemelsbreed gemeten of gerekend langs voor alle verkeer toegankelijke wegen? Een objectieve toets die ook onder de oude WOG werd gehanteerd was de frequentie van normaal openbaar vervoer. Wordt deze ook in de toekomst gehanteerd om het belang of de noodzaak tot het afgeven van een vergunning te wegen?
De bedoelde afstand is die tussen de woning van de patiënt en de apotheek, gemeten over de voor het gemotoriseerde verkeer toegankelijke weg. Indien aan het afstandcriterium van (meer dan) 4,5 kilometer is voldaan wordt altijd een vergunning verleend. Tussen de 3,5 en 4,5 kilometer kan de frequentie van normaal openbaar vervoer een rol spelen.
De apotheekvergunning wordt bij een afstand tussen de 3,5 en de 4,5 kilometer afgegeven als dat in het belang van de geneesmiddelenvoorziening is. De leden van de SP-fractie vragen of bij de afweging ook rekening wordt gehouden met niet in de wet geregelde zaken als uitdeelposten en bezorgdiensten? Ook de leden van de fracties van de SGP en van de CU vroegen of hiermee wordt afgeweken van de jurisprudentie.
Bij deze afweging worden inderdaad niet in de wet geregelde zaken betrokken. Deze omstandigheden kunnen niet in de wet worden opgenomen omdat zij zeer casuïstisch van aard zijn. Bij het maken van de afweging zal echter de jurisprudentie van de afgelopen jaren worden gevolgd.
In de wet staat dat apothekers pas mogen afleveren als zij zijn ingeschreven in het register van gevestigde apothekers, dat is ingesteld door het Staatstoezicht op de volksgezondheid. Deze verplichting is niet opgenomen voor apotheekhoudende huisartsen, in tegenstelling tot de oude WOG. Als de inspectie niet weet welke huisartsen apotheekhoudend zijn en dus afleveren, hoe kan zij dan de kwaliteit van handelen bewaken, vragen de leden van de SP-fractie.
De apotheekhoudend huisarts ontleent zijn bevoegdheid aan de vergunning; niet aan de inschrijving bij de IGZ. De vergunning wordt verleend door de minister van VWS. Het dienstonderdeel dat zorgdraagt voor de vergunning, het CIBG, zal hiervan melding maken aan de IGZ, zodat die op de hoogte is welke huisartsen apotheekhoudend zijn.
De leden van de fractie van de VVD reageren naar aanleiding van het amendement Buijs/Arib dat in elke apotheek in beginsel een apotheker aanwezig dient te zijn en vragen naar mijn reactie hierop.
Ik maak de leden van de VVD-fractie erop attent dat de amendementen die een aanwezigheidsplicht voor de apotheker introduceerden niet zijn aangenomen. Het amendement waar deze leden op doelen houdt in het beginsel dat één apotheker slechts verantwoordelijk kan zijn voor één apotheek (thans artikel 19 WOG, in de toekomst artikel 61 lid 3 Geneesmiddelenwet). Ik heb in de Tweede Kamer uitvoerig betoogd waarom ik van mening ben dat de wijze waarop de apotheker zijn beroep uitoefent in eerste instantie een verantwoordelijkheid is van de beroepsbeoefenaar zelf. Dit is ook de grondgedachte van de wet BIG. Indien men de verplichtingen van de apotheker uit hoofde van de wet BIG en van andere wetten overziet zal de apotheker doorgaans aanwezig moeten zijn om daaraan te kunnen voldoen. In die zin achtte ik het overbodig om een artikel met de strekking van artikel 19 WOG op te nemen. Met het aangenomen amendement ligt nu echter ook in de Geneesmiddelenwet vast dat de apotheker slechts in één apotheek de verantwoordelijke apotheker kan zijn (en daardoor dus in de regel ook aanwezig zal moeten zijn).
De leden van de PvdA-fractie vragen zich af of de apothekers wel worden aangemoedigd zich te specialiseren. Is het niet een vereiste voor apothekers om zich te specialiseren willen zij goede voorlichting en advies kunnen geven? Op welke wijze wordt de kwaliteit geborgd voor de apotheekhoudend huisarts?
De Geneesmiddelenwet bevat geen belemmeringen voor apothekers om zich te specialiseren. Voor goede voorlichting en advies is verdere specialisatie geen randvoorwaarde. Apothekers krijgen in Nederland een gedegen opleiding die voldoende basiskennis bevat om patiënten goed van advies te kunnen dienen en hun voorlichtingstaak uit te oefenen. Enkele jaren geleden heeft de Inspectie voor de Gezondheidszorg een rapport uitgebracht over de kwaliteit van de apotheekhoudende huisarts. De IGZ uitte kritiek op het functioneren van de apotheekhoudende huisarts ten aanzien van het farmaceutische deel van zijn werkzaamheden. Dit is voor de beroepsgroep aanleiding geweest om verbeteringen door te voeren.
Met betrekking tot de vraag van de leden van de fractie van de PvdA naar de vereiste aanwezigheid van de apotheker binnen zorginstellingen waarbij geneesmiddelen op naam worden gesteld, meld ik het volgende.
De Geneesmiddelenwet stelt beperkingen aan diegenen die geneesmiddelen ter hand mogen stellen aan patiënten: dat mag krachtens artikel 61 slechts een beperkt aantal personen. Het op naam stellen van geneesmiddelen geschiedt door de apotheker. Voor de goede orde: het ter hand stellen van geneesmiddelen is een andere handeling dan het toedienen van geneesmiddelen. Terhandstellen is het door de apotheker overhandigen van een door een arts voorgeschreven geneesmiddel. Binnen de zorginstellingen is veelal sprake van het toedienen van geneesmiddelen om direct de kwaal, geïndiceerd door de dienstdoende arts, te bestrijden.
Over de kwestie van de herinneringsreclame bestaat verwarring, als de leden van de VVD-fractie de signalen uit het veld goed interpreteren. Is het nu wel of niet zo dat het wetsvoorstel de herinneringsreclame verbiedt?
Herinneringsreclame wordt niet verboden. In het wetsvoorstel is echter niet de mogelijkheid opgenomen die de richtlijn biedt, om te regelen dat publieksreclame of reclame gericht tot beroepsbeoefenaren die alleen tot doel heeft de naam of het handelsmerk van het geneesmiddel in herinnering te brengen, niet hoeft te voldoen aan de voorwaarden waaraan verdergaande reclame moet voldoen. Dit betekent dat publieksreclame of reclame gericht op beroepsbeoefenaren in Nederland te allen tijde moet voldoen aan alle voorwaarden die de wet stelt ongeacht of het bedoeld is als herinneringsreclame.
9. De vrije verkrijgbaarheid van geneesmiddelen
De leden van de VVD-fractie hebben een aantal vragen gesteld met betrekking tot de procedure en de criteria bij de indeling van geneesmiddelen in al dan niet receptplichtig.
De indeling van geneesmiddelen als UR-geneesmiddel of niet-UR-geneesmiddel gebeurt in heel Europa op grond van de criteria in richtlijn 2001/83/EG.
De desbetreffende bepalingen in de Geneesmiddelenwet zijn volledig analoog met de bepalingen in de richtlijn en dus ook met de bepalingen in de wetgeving in andere lidstaten. Vele geneesmiddelen met een nieuwe werkzame stof worden overigens via de gecentraliseerde procedure toegelaten. Voor deze producten wordt dus een beslissing door de Gemeenschap genomen over al dan niet UR. Bij de uiteindelijke indeling van geneesmiddelen kan een rol spelen dat er verschillen zijn in de daadwerkelijke kanalisatie van zelfzorggeneesmiddelen. In sommige lidstaten kunnen zelfzorggeneesmiddelen uitsluitend via de apotheek worden verkregen, andere lidstaten hebben andere kanalen tot zelfs de algemene verkoop toe. De door de vragenstellers genoemde voorbeelden van stoffen die in Nederland UR zijn en in andere staten niet, zijn onjuist. Zowel diazepam als midazolam zijn stoffen die door het Psychotrope Stoffen Verdrag zijn gereguleerd. Verdragspartijen (inclusief alle lidstaten van de EU) mogen deze geneesmiddelen niet anders dan op recept af laten leveren. Nederland is niet «strenger» dan andere lidstaten bij de indeling van geneesmiddelen. Over het algemeen is er een grote mate van overeenstemming over de indeling van geneesmiddelen.
De leden van de VVD-fractie vragen waarom de minister zich niet heeft verzet tegen het amendement dat verbiedt dat geneesmiddelen worden voorgeschreven door een E-dokter die geen behandelrelatie met de patiënt heeft? De leden van de SP-fractie zouden graag een reactie willen zien op het standpunt van de Nederlandse vereniging voor E-Health. Deze vereniging vindt dat de zienswijze dat het internetvoorschrijven alleen mogelijk is binnen een bestaande behandelrelatie, op gespannen voet staat met de richtlijnen van de KNMG. Deze leden vragen ook naar de situatie op huisartsenposten.
Ik heb op zich geen bezwaar tegen E-Health, in tegendeel zelfs. Ik beschouw Internet als een niet meer weg te denken toevoeging aan de bestaande communicatiemiddelen. Onder voorwaarden, in een bestaande behandelrelatie, beschouw ik internetvoorschrijven ook als van meerwaarde. Het voorschrijven van geneesmiddelen door E-dokters aan patiënten die zij niet kennen, nooit hebben gezien, en waarvan zij de medicatiegeschiedenis niet kennen vind ik echter geen goede zaak. Het lijkt mij niet mogelijk om dan een goede diagnose te stellen.
Het desbetreffende amendement, dat de voorwaarden iets strakker formuleert dan de KNMG-richtlijnen, onderschrijf ik dan ook.
In het algemeen zullen artsen op huisartsenposten hun patiënten zien of spreken. Dat het regelmatig gebeurt dat beroepsbeoefenaren op huisartsenposten geneesmiddelen voorschrijven aan patiënten die zij niet zien, noch kennen is mij niet bekend. Verder wordt de huisarts per omgaande op de hoogte gesteld van de op de post voorgeschreven medicatie.
11. Onderzoek met geneesmiddelen
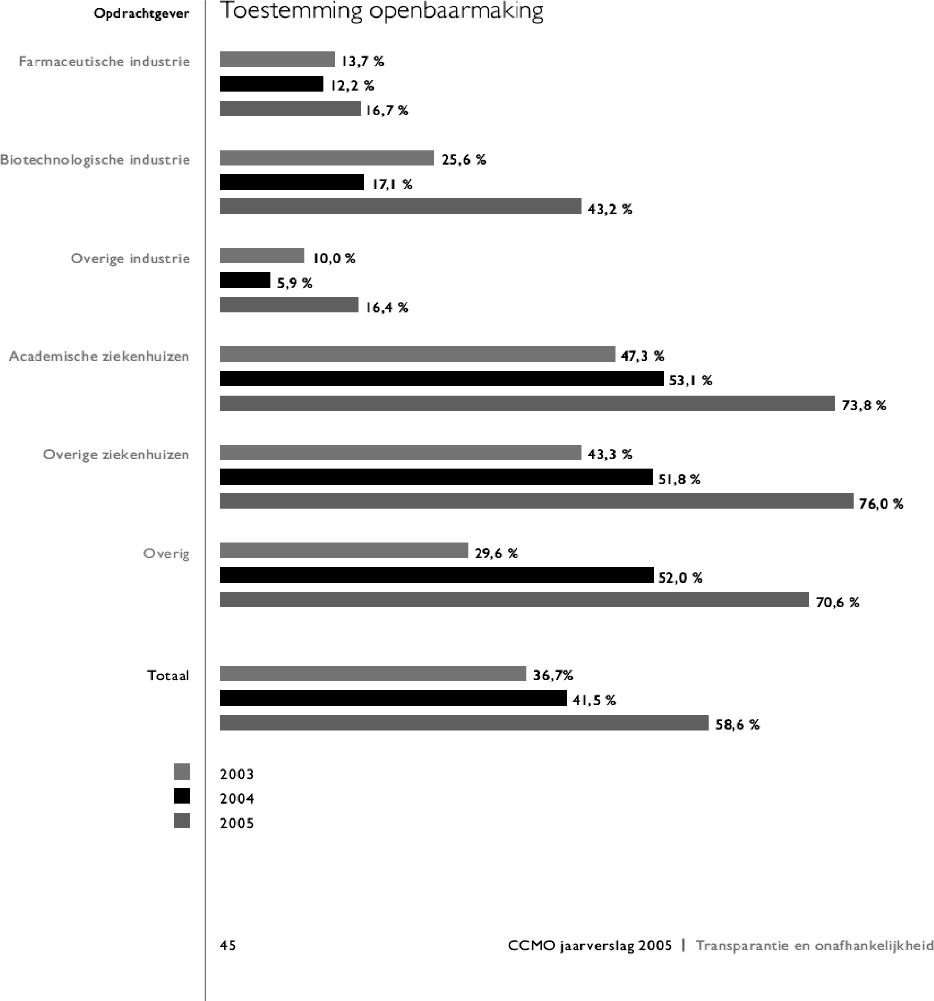
De leden van de SP-fractie ontvangen graag een overzicht van de cijfers uit het jaarverslag van de CCMO van 2005, vergeleken met de eerdere verslagen uit 2003 en 2004. Voorts vragen deze leden zich af of de door de WHO gehanteerde lijst van twintig items waarmee geneesmiddelenonderzoek in openbare registers moet worden opgenomen, ook door de CCMO gehanteerd wordt.
De CCMO hanteert het zogeheten ABR formulier, een elektronisch in te vullen aanvraagformulier ten behoeve de medisch-ethische beoordeling.
De bereidheid tot openbaarmaking van enkele kerngegevens uit het ABR-formulier van de afgelopen jaren staat in het openbaar jaarverslag 2005 van de CCMO (zie jaarverslag op de CCMO-website, pagina 45 en onderstaand overzicht). Hierin is te zien is dat vanaf 2003 tot 2005 de bereidheid tot openbaarmaking toeneemt en dit juich ik toe. Het nieuwe online ABR-formulier dat vanaf 1 maart 2006 gebruikt wordt bij de indiening van onderzoeksvoorstellen, bevat de twintig items van de WHO.
De leden van de SP-fractie vragen wat de stand van zaken is ten aanzien van de verplichting met betrekking tot een onderzoeksplan voor fabrikanten die een nieuwe registratie of een uitbreiding van een registratie van een geneesmiddel voor kinderen wensen. Voorts vragen deze leden of het Comité kindergeneeskunde, dat de onderzoeksplannen moet beoordelen, al is opgericht.
Het Europees Parlement en de Raad van de Europese Unie hebben ingestemd met het voorstel voor een Verordening betreffende geneesmiddelen voor pediatrisch gebruik. Bekendmaking van deze verordening in het Publicatieblad van de Gemeenschap zal, zo is mij meegedeeld, plaatsvinden vóór 1 januari 2007.
Een aspect van deze verordening betreft de instelling van een Comité Pediatrie. De belangrijkste taak van dit comité wordt het beoordelen van een door een farmaceutisch bedrijf bij het Europees Geneesmiddelenbureau ingediend onderzoeksplan voor het uitvoeren van klinische proeven met geneesmiddelen bij kinderen. Het doel van deze proeven is het verkrijgen van een vergunning voor het in de handel brengen van het geneesmiddel voor toepassing bij kinderen.
De verordening heeft in beginsel alleen betrekking op geneesmiddelen die voor de datum van inwerkingtreding van de verordening nog niet in de handel waren. Bij de aanvraag om een handelsvergunning na die datum moet de aanvrager een door het Europees Geneesmiddelenbureau goedgekeurd onderzoeksplan overleggen waarover het Comité Pediatrie advies heeft uitgebracht.
Met betrekking tot geneesmiddelen waarvoor reeds een handelsvergunning is verleend vóór de datum van inwerkingtreding van de verordening, zal het volgende gelden. Indien de houder van een handelsvergunning een nieuwe indicatie, waaronder een pediatrische indicatie, wil toevoegen aan zijn vergunning, is hij verplicht een dergelijk onderzoekplan in te dienen bij het Europees Geneesmiddelenbureau. Het Comité Pediatrie, dat advies moet uitbrengen over het plan, kan pas worden ingesteld na het van kracht worden van de verordening.
De leden van de SP-fractie vragen wat de minister vindt van een recent onderzoek in de Verenigde Staten dat uitwijst dat men zich bij geneesmiddelen voor kinderen vooral richt op geneesmiddelen die het goed doen in de markt en niet zozeer met geneesmiddelen die vooral voor kinderen bestemd zijn.
Ik ben niet in detail op de hoogte van de situatie in de Verenigde Staten. Ten aanzien van de situatie ter zake in Europa kan ik echter het volgende stellen. Uitgangspunt van de nieuwe verordening is dat bij elke aanvraag om een handelsvergunning een goedgekeurd onderzoeksplan met betrekking tot kinderen worden overgelegd. Het gaat dus niet alleen om commercieel aantrekkelijke geneesmiddelen. Het Comité Pediatrie moet beoordelen of een ingediend plan relevant is en veilig uitgevoerd kan worden. Dat wil zeggen dat de ziekte ook daadwerkelijk bij kinderen moet voorkomen en dat er voldoende over de veiligheid bij volwassenen bekend moet zijn. In het eerste geval – de ziekte komt niet voor bij kinderen – wordt door het Bureau vrijstelling verleend van de verplichting om bij de aanvraag om een handelsvergunning bij de desbetreffende bevoegde instantie een goedgekeurd pediatrisch onderzoeksplan te overleggen. In het tweede geval – er is nog onvoldoende over de veiligheid bekend – wordt uitstel verleend tot het uitvoeren van het plan.
Ziekten met een hoge prevalentie bij volwassenen komen meestal veel minder frequent voor bij kinderen. De nieuwe Europese verordening is juist bedoeld om de ontwikkeling van geneesmiddelen voor kleine markten – zoals in het geval van kinderen – te stimuleren. De nieuwe regels zijn ook van toepassing op commercieel interessante geneesmiddelen mits de ziekte waarvoor het geneesmiddel is bestemd, daadwerkelijk bij kinderen voorkomt.
De leden van de SP-fractie vragen of het bijwerkingencentrum Lareb als afzonderlijk onderdeel van het CBG de bijwerkingen registreert en openbaar maakt. Tevens vragen deze leden naar de taakverdeling en afbakening van CBG en Lareb.
Een duidelijke scheiding tussen het registreren van geneesmiddelen en de geneesmiddelenbewaking is niet de bedoeling van de Geneesmiddelenwet. Dit zou ook afwijken van de systemen die in alle andere lidstaten van de EU worden gehanteerd. Wat Lareb doet is het beheren van het systeem van spontane meldingen van beroepsbeoefenaren. Lareb verwerkt de meldingen en geeft deze door aan het CBG.
De uiteindelijke beoordelende rol berust bij het CBG. Ten aanzien van het openbaar maken van meldingen heeft Lareb een rol. Het CBG kan opdrachten geven aan de industrie om onderzoek te doen. Tevens kan het CBG alle gegevens die het nodig acht opvragen van de industrie. Het detecteren van signalen van bijwerkingen door beroepsbeoefenaren gebeurt door Lareb. Voor een uitgebreide toelichting op de organisatorische en financiële relatie tussen het CBG en Lareb verwijs ik naar mijn brief van 6 maart 2006 (29 359, nr. 62, blz. 4 t/m 6).
Wie houdt er toezicht op de verplichting (vermoedelijk) ernstige bijwerkingen te melden bij Lareb, vragen de leden van de SP-fractie. Wat zijn de sancties en door wie worden die uitgedeeld?
Het betreft hier de nieuwe, bij amendement ingevoegde verplichting van beroepsbeoefenaren van artikel 78. Op het niet nakomen van deze verplichting in artikel 78 is verzuimd een sanctie te stellen in artikel 101. Zoals ik op dezelfde vraag van de leden van de CDA-fractie heb geantwoord, zal ik mij inspannen om op korte termijn alsnog in een passende sanctionering van de overtreding van dit artikel te voorzien. De IGZ zal alsdan de instantie zijn die toezicht houdt op de naleving van artikel 78.
De leden van de SP-fractie vragen hoe de indeling in de diverse categorieën zelfzorggeneesmiddelen vordert, wie daarmee is belast en op grond van welke criteria de indeling geschiedt. Tevens vragen deze leden of de Eerste Kamer ook vooraf inzage kan krijgen in de desbetreffende ministeriële regeling.
Het College ter beoordeling van geneesmiddelen is belast met de indeling van zelfzorggeneesmiddelen in categorieën. Het uitgangspunt voor de indeling zijn de criteria die zijn opgenomen in artikel 58, eerste en tweede lid. Het College deelt een geneesmiddel in als UA indien dit naar zijn oordeel uit een oogpunt van medicatiebewaking, voorlichting of begeleiding bij de terhandstelling noodzakelijk is. Het College besluit tot indeling in de AV-categorie indien dit naar zijn oordeel uit een oogpunt van veilig gebruik verantwoord is, gelet op de werkzame stof, de dosering en verpakkingsgrootte. De woorden «naar zijn oordeel» geven aan dat het College hierbij enige, noodzakelijk geachte, beoordelingsvrijheid heeft. Het CBG heeft een advies aan mij uitgebracht over de nadere indelingscriteria voor de vaststelling van de drie zelfzorgcategorieën. Dit advies verwerk ik thans in een ontwerp ministeriële regeling. Ik streef ernaar deze regeling nog in oktober aan beide Kamers der Staten-Generaal ter voorhang toe te zenden.
De leden van de SP-fractie vragen of ik nog onderzoek zal doen naar het aantal ziekenhuisopnamen met al of niet gelukkige afloop als gevolg van interacties van zelf gekochte middelen met voorgeschreven middelen. Ook zou volgens deze fractie onderzoek naar misbruik en ongevallen als gevolg van middelen die het reactievermogen beïnvloeden op zijn plaats zijn.
Bij gelegenheid van dit wetsvoorstel heb ik een brief aan de Tweede Kamer gezonden (29 359, nr. 91) waarin uitgebreid wordt ingegaan op de extra (naast de reguliere) activiteiten die plaatsvinden om het aantal doden als gevolg van verkeerd medicijngebruik omlaag te brengen. Er zijn mij op dit moment geen misstanden bekend die het noodzakelijk maken dat ik nieuwe onderzoeken initieer. Ik zou daarom willen wachten tot alle lopende initiatieven zijn afgerond en dan willen kijken of hier nog vervolgonderzoeken uit voortvloeien.
De leden van de SP-fractie stellen dat onderzoek van het NIVEL heeft uitgewezen dat consumenten weinig weten over het juiste gebruik van zelfzorggeneesmiddelen. Hoe gaat de minister dit probleem verhelpen? De leden van de SP nemen aan dat de minister van plan is samen met de NPCF en de Consumentenbond een grote publiekscampagne op te zetten. Als de minister verwacht dat drogisten meer aan voorlichting zullen gaan doen, welke eisen stelt hij dan aan hun opleiding, certificering, accreditering?
Ik ga ervan uit dat de leden van de SP-fractie doelen op een literatuurstudie uit 2005 van het NIVEL, in opdracht van het Centraal Bureau Drogisterijbedrijven. Deze literatuurstudie had betrekking op de VS, Engeland en Australië, waar de verkrijgbaarheid van zelfzorgmiddelen ruimer is dan in Nederland. Ook worden daar verpakkingen verkocht die veel groter zijn dan die in Nederland. Deze bevindingen zeggen niets over de situatie in Nederland. De kop boven de samenvatting luidt: «Weinig bekend over kennis van Nederlanders over zelfzorggeneesmiddelen». Voorts zegt een van de onderzoekers dat Nederlanders in vergelijking met inwoners van andere landen heel terughoudend zijn met slikken.
Uit een onderzoek van TNS-NIPO in opdracht van Neprofarm uitgebracht op 22 september 2006 over het gebruik van vrij verkrijgbare pijnstillers blijkt dat het overgrote deel van de gebruikers aangeeft zich te houden aan de informatie in de bijsluitertekst. Wij moeten dus niet te snel aannemen dat consumenten onwetend zijn op het terrein van zelfzorgmiddelen. De industrie draagt bovendien zorg voor goede bijsluiterteksten en waarschuwingen op de verpakking. Voorts meen ik dat juist de apothekers- en drogistenbranche goede voorlichting moet geven. Niet voor niets kennen we een kanalisatieregeling ten aanzien van zelfzorggeneesmiddelen. Die regeling is er juist met het oog op de (mogelijkheid van) voorlichting door drogisten en apothekers.
Ik stel geen eisen aan opleiding en certificering. Dat is ook niet de taak van de minister van VWS, maar van de branche zelf. De branche kan zelf opleidingseisen formuleren, waarna ik organisaties kan aanwijzen die bevoegd zijn om examens af te nemen. In de Tweede Kamer heb ik aangegeven dat ik in elk geval de stichting Pharmacon zal aanwijzen als organisatie die het drogistendiploma kan afgeven.
De leden van de SP-fractie vragen of de huidige zelfzorgmiddelen opnieuw worden ingedeeld of dat de nieuwe indeling alleen geldt voor nieuwe middelen. Tevens vragen deze leden of de UA-status meebrengt dat van steeds meer geneesmiddelen de indeling Europees wordt bepaald. Deze leden zijn van mening dat de UA-status net zo goed UR zou kunnen zijn, omdat de voorschrijver hiervan notitie maakt in het EMD, en omdat door de UA-status receptgeneesmiddelen gemakkelijker naar die categorie gaan en voor rekening van de patiënt komen.
Ook de bestaande zelfzorggeneesmiddelen zullen opnieuw worden ingedeeld in UA, UAD of AV. De wet voorziet niet in een uitzondering voor bestaande zelfzorgmiddelen. Er is ook geen enkele reden om de bestaande zelfzorggeneesmiddelen van de nieuwe indeling uit te zonderen. Daardoor zouden lange tijd twee verschillende regimes naast elkaar bestaan zonder dat daar een goede reden voor is. Dit zou bovendien voor de consument een onoverzichtelijke situatie opleveren.
Er is een ontwikkeling gaande waarbij voor steeds meer geneesmiddelen bij EMEA een handelsvergunning moet worden aangevraagd. Daarbij bepaalt EMEA ook de afleverstatus. Dit staat los van de invoering van een UA-categorie in Nederland. Het omgekeerde is wel het geval, namelijk dat invoering van een UA-status wenselijk is ten aanzien van sommige geneesmiddelen die door EMEA als niet-receptplichtig worden aangemerkt. In veel landen van de EU worden ook deze geneesmiddelen uitsluitend via apotheken verkocht. Het CBG acht het wenselijk dat het ook die mogelijkheid heeft voor gevallen waarin het CBG dit aangewezen vindt. Hierbij kan bijvoorbeeld worden gedacht aan Viagra en aan sommige statines. Ik ben het niet met de leden van de SP-fractie eens dat de UA-status net zo goed UR zou kunnen zijn. Middelen waarvan door deskundigen tussenkomst door een arts niet nodig wordt geacht, moeten niet UR worden. Wanneer tussenkomst van een apotheek wel nodig is, biedt de UA-categorie dus een goede uitkomst.
De leden van de SP-fractie vragen zich af hoe de bevoegdheid van de minister tot het verlenen en intrekken van apotheekvergunningen in de praktijk gaat werken nu de provinciale commissies voor de gebiedsaanwijzing worden afgeschaft. Zij vragen voorts of de minister op eigen initiatief de apotheekvergunningen gaat intrekken of dat hij dat alleen zal doen op verzoek van een apotheker die zich in de nabijheid van een apotheekhoudende huisarts vestigt.
De minister van VWS zal een apotheekvergunning verlenen indien de huisarts die daarom verzoekt, voldoet aan de criteria die zijn vervat in artikel 61, tiende lid, eerste volzin, van de wet. Dat zijn objectieve criteria. Wordt ten tijde van de aanvraag om de vergunning niet voldaan aan het criterium van 4,5 kilometer, maar is de afstand tussen de 3,5 en 4,5 kilometer, dan verleent de minister de vergunning alleen indien dat in het belang is van de geneesmiddelenvoorziening. Wat onder dit belang in het desbetreffende gebied moet worden verstaan zal door de minister worden bepaald. Daarbij zal jurisprudentie die tot nu toe betrekking tot het afstandscriterium is ontwikkeld worden gevolgd.
De minister zal op grond van de wet een apotheekvergunning moeten intrekken indien de grond voor de verlening is vervallen; met andere woorden: als er niet meer aan het afstandscriterium van 4,5 kilometer is voldaan dan wel het belang van de geneesmiddelenvoorziening bij een afstandcriterium van 3,5 tot 4,5 kilometer niet meer aanwezig is. Veelal zal de minister hierop gewezen worden door belanghebbenden, net zoals dat thans het geval is bij de Cogeba’s.
De apotheekvergunningen worden voor onbepaalde tijd verleend. Alleen de in artikel 61 van de wet bedoelde criteria kunnen leiden tot het einde van de vergunning. Voor een aan een tijdsduur gekoppelde vergunning is derhalve geen ruimte.
De leden van de fractie van de SP vragen op welke wijze de inspraak of de mogelijkheid van beroep van beide beroepsgroepen bij de beslissingen van de minister wordt geregeld.
De wet bevat geen regeling voor inspraak van de betrokken beroepsgroepen bij de beslissing van de minister om een apotheekvergunning te verlenen of in te trekken. Uiteraard kan tegen de beslissing van de minister door belanghebbenden bezwaar en beroep worden ingesteld op grond van de Algemene wet bestuursrecht.
Ik deel de visie van de leden van de SP-fractie waar zij stellen dat de beroepsgroepen (artsen, apothekers) en de kwaliteit van zorg gebaat zijn bij heldere basale regels over de gang van zaken bij recepten en herhaalreceptuur. Sterker nog, ook patiënten zullen daarbij gebaat kunnen zijn. Ik ben dan ook bereid over dit onderwerp van gedachten te wisselen met de betrokken brancheorganisaties.
Uw Kamer ontving een brief van de KNMG (kenmerk RRo/06-11102, d.d. 31 augustus 2006) met kanttekeningen bij het aangenomen amendement van de leden Schippers en Vendrik over het voorschrijven van UR-geneesmiddelen door verpleegkundigen. De leden van de fractie van de SP vroegen mij te reageren op alle punten van die brief. Tevens vroegen deze leden naar mijn bereidheid om over die punten te overleggen met de koepel van verpleegkundigen, de KNMG en de patiënten/consumentenorganisaties.
De KNMG stelt in de brief de volgende punten aan de orde: de reikwijdte van de voorschrijfbevoegdheid, welke verpleegkundigen zullen mogen voorschrijven, de naar het oordeel van de KNMG aan de voorschrijfbevoegdheid te stellen randvoorwaarden en de verantwoordelijkheid van de arts.
Over de reikwijdte van de voorschrijfbevoegdheid kan ik duidelijk zijn: de bevoegdheid om op eigen initiatief UR-geneesmiddelen voor te schrijven is niet overdraagbaar. Dat is ook wat ik eerder aan de Tweede Kamer meldde (brief van 7 juni 2006 over de wet BIG). De apotheker mag uitsluitend UR-geneesmiddelen leveren op basis van een recept dat is ondertekend door een daartoe bevoegde voorschrijver. Op dit moment zijn dat de arts, tandarts en verloskundige. Met de nieuwe wet wordt de mogelijkheid gecreëerd daar bepaalde categorieën verpleegkundigen aan toe te voegen. Noch de WOG, noch de Geneesmiddelenwet biedt ruimte voor het afleveren van een geneesmiddel door de apotheker op basis van een recept dat is ondertekend door andere beroepsbeoefenaren. Strikt genomen is het weliswaar mogelijk dat een andere beroepsbeoefenaar een recept uitschrijft, maar het recept dient altijd ondertekend (geautoriseerd) te zijn door een in de wet genoemde beroepsbeoefenaar.
De KNMG wil dat de voorschrijfbevoegdheid uitsluitend aan verpleegkundig specialisten wordt toegekend en niet ook aan nog nader te definiëren andere categorieën (gespecialiseerde) verpleegkundigen. Anders dan de KNMG ben ik van oordeel dat het toekennen van de voorschrijfbevoegdheid niet beperkt hoeft te blijven tot (wettelijk erkende) verpleegkundig specialisten. Het kan wenselijk zijn om binnen de door de wet voorgestelde beperkingen (voorwaarden) die bevoegdheid toe te kennen aan duidelijk identificeerbare andere categorieën verpleegkundigen. Wél ben ik het met de KNMG eens dat zolang een landelijk kader voor dergelijke groepen ontbreekt en duidelijke identificatie niet mogelijk is, het niet verantwoord is de voorschrijfbevoegdheid toe te kennen.
De KNMG koppelt een zevental randvoorwaarden aan toekenning van de voorschrijfbevoegdheid aan verpleegkundig specialisten. Met het merendeel daarvan ben ik het eens. Echter, voor zover verpleegkundig specialisten handelen binnen hun (wettelijk vastgestelde) deskundigheidsgebied zou de opleiding tot verpleegkundig specialist moeten garanderen dat geen andere beperkingen of waarborgen nodig zijn dan voor artsen gelden. Een beperking dat uitsluitend binnen medische protocollen wordt voorgeschreven acht ik wél aangewezen voor andere categorieën verpleegkundigen.
Tot slot onderschrijf ik de opvatting van de KNMG dat een arts niet eindverantwoordelijk kan zijn voor handelingen die door een andere beroepsbeoefenaar zelfstandig bevoegd worden verricht. Elke beroepsbeoefenaar is verantwoordelijk voor diens aandeel in het voorschrijfbeleid. Om de kwaliteit en veiligheid van het voorschrijfbeleid en geneesmiddelengebruik te waarborgen dienen vanzelfsprekend wel goede samenwerkingsafspraken te worden gemaakt tussen daarbij betrokken beroepsbeoefenaren. Het ligt voor de hand dat van die afspraken onderdeel uitmaakt wie het beste de regierol voor de zorg op zich neemt. Dat kan de arts zijn, maar ik sluit niet uit dat het in specifieke gevallen voor de hand kan liggen om die regierol te beleggen bij een verpleegkundig specialist.
Vanzelfsprekend zal ik, zowel in het kader van de uitwerking van het nu voorliggende voorstel om de voorschrijfbevoegdheid toe te kennen aan door mij aan te wijzen specifieke categorieën verpleegkundigen als in het kader van de uitwerking van het in voorbereiding zijnde wetsvoorstel om die bevoegdheid aan (wettelijk erkende) verpleegkundig specialisten toe te kennen, overleg plegen met de door de leden van de fractie van de SP genoemde koepels.
17. Activiteiten farmaceutische industrie
Voor de leden van de SP-fractie is een aantal van de activiteiten van de farmaceutische industrie allang een doorn in het oog. Zij wijzen op de nota «ongemakkelijke minnaars» en op de initiatiefnota van Mevrouw Kant (Kamerstuk 30 482), waarover onlangs is gedebatteerd in de Tweede Kamer. De leden van de SP-fractie in de Eerste Kamer hebben met instemming kennisgenomen van het debat en de uitkomsten ervan. Ook heeft zij de brief van de minister als reactie op de initiatiefnota gelezen. Er blijven natuurlijk altijd vragen over. De Inspectie meldt dat de Stichting Code Geneesmiddelenreclame (CGR) onvoldoende toezicht houdt op de naleving van reclameregels. Wat gaat de minister doen met het rapport van de Inspectie?
De stichting CGR stelt een verbeterplan op naar aanleiding van het rapport van de Inspectie. Bij dit verbeterplan is de Inspectie ook nauw betrokken. De CGR richt zich daarbij op normontwikkeling, educatie en voorlichting, afhandeling van adviezen en klachtbehandeling. De CGR heeft geen bevoegdheden om actief op te sporen zoals de Inspectie die heeft. Ik constateer dat de CGR de afgelopen twee jaar vooruitgang heeft geboekt, maar dat er nog geen sprake is van een in alle opzichten volwassen toezicht door de zelfregulering. Een betere samenwerking tussen de Inspectie en de CGR zal naar mijn mening kunnen leiden tot een verbeterd toezicht. Die samenwerking was lange tijd onvoldoende mogelijk doordat er door de vele personele wisselingen onderbezetting was bij de Inspectie. Sinds begin 2006 is de Inspectie weer op volle sterkte en houdt de Inspectie ook actief toezicht. Dat blijkt onder andere uit het evaluatierapport dat de Inspectie over de CGR opstelde. Verder voert de Inspectie momenteel een onderzoek uit naar de beïnvloeding van de richtlijncommissies door de industrie en naar het voorschrijfgedrag op het gebied van de cholesterolverlagers. Voor de CGR ligt er nog een belangrijk verbeterpunt op het gebied van sanctiemogelijkheden richting beroepsbeoefenaren.
In dit kader stellen de leden van de SP-fractie nog de volgende vragen.
• Is de taakverdeling tussen de CGR en de IGZ wel duidelijk als het gaat om een actief, adequaat en gericht handhavingsbeleid? Zijn er samenwerkingsafspraken of een samenwerkingsconvenant? Zo nee, waarom niet?
• Wat vindt de minister van het feit dat de CRG zelf zegt niet na te gaan of zijn uitspraken ook worden nageleefd?
• De minister stelt in zijn brief dat de industrie hier en daar misschien wat te veel geld aan marketing uitgeeft en vermeldt ook dat het de taak van de overheid is, dus zijn taak, om te voorkomen dat de nadelen van de commerciële setting zich te veel manifesteren. Wat is te veel en waar ligt voor de minister de grens, kan hij een percentage noemen?
• Uit onderzoek door Joop Bouma (boek «Slikken») zou blijken dat richtlijnontwikkeling door de beroepsgroep niet vrij is van beïnvloeding door de industrie. Doet de IGZ inmiddels onderzoek?
• Hoe staat het met het onderzoek dat de IGZ zou doen naar Occam? Dit betreft de twijfel hoe met ethische zaken wordt omgegaan bij geneesmiddelenonderzoek in de derde wereld. Wanneer zijn de uitkomsten hiervan bekend?
Tijdens het debat over de initiatiefnota van het lid Kant inzake «25 medicijnen tegen te grote macht van de farmaceutische industrie» heb ik toegezegd de CGR en de Inspectie te vragen een samenwerkingsovereenkomst op te stellen. Beide partijen zijn hier voortvarend mee aan de slag gegaan en ik verwacht dat deze overeenkomst op korte termijn van kracht kan worden. In die overeenkomst is uitgegaan van de huidige taken en bevoegdheden van beide instanties en is gekeken op welke onderdelen ze samen sterker kunnen worden.
Naar aanleiding van de laatste toezichtrapportage van de Inspectie werkt de CGR op dit moment aan verbeteringen. Die houden onder meer in dat de CGR bij alle partijen zal nagaan of uitspraken zijn nageleefd.
Ik heb in mijn brief aan de Tweede Kamer over de initiatiefnota van het lid Kant inderdaad aangegeven dat het mijn taak is om te voorkomen dat de nadelen van de commerciële setting zich te veel manifesteren. Ik doe dat door de kaders te stellen en te zorgen voor handhaving. Ik heb geen prestatie-indicatoren voorhanden waarmee dit adequaat zou zijn te meten.
De Inspectie is ver gevorderd met het onderzoek naar de beïnvloeding van de richtlijncommissies. De Inspectie heeft het rapport in de zaak Occam onlangs gepubliceerd (www.igz.nl). Ik voeg hierbij een afschrift van dit rapport en mijn standpunt daarop.
De leden van de SP-fractie vragen hoe het staat met de modernisering van het geneesmiddelenvergoedingssysteem.
Het CVZ werkt momenteel aan een uitvoeringstoets over de modernisering van het GVS. Naar verwachting wordt dit rapport in december afgerond.
De leden van de fracties van de SGP en de ChristenUnie vragen zich af of door exclusieve distributie van bepaalde geneesmiddelen door slechts één apotheek de keuzevrijheid van de patiënt niet teveel beperkt wordt.
Het betreft hierbij meestal dure specialistische geneesmiddelen met iets «bijzonders» aan de toediening (bijvoorbeeld injectie) voor kleine aantallen patiënten. In veel gevallen hebben de patiënt en de voorschrijver de mogelijkheid om te kiezen voor aflevering door een landelijk werkende apotheek of door de reguliere apotheek van de patiënt.
Exclusieve distributie gaat veelal gepaard met aanvullende diensten en service (vaak aan huis verleend door verpleegkundigen) en heeft dan een meerwaarde voor de patiënt op het gebied van de toediening en de therapietrouw. Specifieke kennis en ervaring met de desbetreffende middelen wordt sneller opgedaan door de landelijk werkende exclusieve apotheken dan door lokale apotheken met slechts een zeer beperkt aantal afnemers van die geneesmiddelen. Tegenover de keuzevrijheid van de patiënt staat dan ook de meerwaarde die dergelijke distributiewijzen kunnen bieden. Overigens is de keuzevrijheid van een patiënt op zich zelf niet absoluut. Deze is veelal regionaal bepaald of afhankelijk van de overeenkomsten die zorgverzekeraars met apothekers hebben afgesloten. Ook voor de fabrikant (die op zich zelf niet verplicht is om zijn geneesmiddelen via alle apotheken af te zetten) kan een dergelijke distributiewijze voordelig zijn vanuit financieel of marketingoogpunt.
Wat de concurrentie tussen apotheken betreft, die zal zich bij exclusieve leveringen afspelen tussen apotheken die het (exclusieve) recht willen verwerven van de fabrikant tot het afleveren van de betrokken geneesmiddelen.
De medicatiebewaking wordt als zodanig niet onmogelijk door exclusieve distributie.
Apotheken wisselen de medicatiegegevens over en weer uit. De Inspectie let bij exclusieve leveringen op dit punt. Zij heeft vooralsnog geen klachten van individuele patiënten hierover ontvangen. Overigens zal met de totstandkoming van het Elektronisch Medicatie Dossier (EMD) de uitwisseling van de medicatiehistorie wettelijk geregeld zijn.
Voorzover de toegankelijkheid van de desbetreffende geneesmiddelen en de medicatie-uitwisseling niet in geding komt door de exclusieve leveranties is er geen aanleiding om op te treden.
III. Artikelsgewijze opmerkingen en vragen
De leden van de CDA-fractie vragen zich af of het niet wenselijk zou zijn om ook de aanvaarding door voormalige collegeleden van functies bij bijvoorbeeld een fabrikant of groothandel in geneesmiddelen te beperken.
Aan de beperking van belangenverstrengeling na het lidmaatschap van het CBG kleven een aantal praktische bezwaren. Ten eerste bestaat er geen formele relatie meer tussen de ex-leden van het CBG en de Staat. Veel leden vervullen voorts rollen in het onderzoek naar geneesmiddelen en hierbij zijn vaak contacten met farmaceutische bedrijven noodzakelijk. Hierom acht ik het niet wenselijk de beperking van belangenverstrengeling ook na het lidmaatschap van het CBG voort te zetten.
De leden van de PvdA-fractie vragen of artikel 18 lid 5 ook betrekking heeft op een apotheker die voor meerdere apotheken medicijnen bereidt.
Artikel 18 lid 5 zondert apothekers uit van vergunningplicht voor de vervaardiging van geneesmiddelen. Deze uitzondering geldt voor het op kleine schaal bereiden voor ter handstelling aan eigen patiënten. Een apotheker kan voor meerdere andere apothekers bereiden zolang hij maar binnen die randvoorwaarden blijft. De apotheker die bereidt moet ook terhandstellen, zij het dan in zo’n geval via de «bestellende» apotheker.
Een apotheker daarentegen die zijn bereidingen (niet op naam gesteld) doorverkoopt aan andere apothekers onderscheidt zich op dat punt niet van een gewone fabrikant of groothandelaar. In dat geval zal hij dus een fabrikantenvergunning nodig hebben.
De leden van de PvdA-fractie vragen naar het nut van artikel 22, onder b, in het licht van artikel 23. eerste lid, onder b.
Artikel 22, onder b, heeft betrekking op het vervallen van een vergunning van rechtswege. Het initiatief om van de vergunning af te raken, ligt bij de vergunninghouder zelf. Het louter meedelen door de vergunninghouder aan de minister dat hij is opgehouden met apotheekhouden, is voldoende om het rechtsgevolg te laten ingaan. Dat schept direct duidelijkheid en voorkomt procedures.
Artikel 23, eerste lid, onder b, legt het initiatief bij de minister als vergunningverlenende instantie en vergt een afweging van hem. De minister neemt de beslissing; daartegen kan bezwaar en beroep worden ingesteld door de betrokken vergunninghouder. De bewijslast ligt in deze situatie bij de minister.
De leden van de fractie van de PvdA vroegen om een toelichting in gewoon Nederlands op artikel 41.
Artikel 41 bevat de implementatie van artikel 5 lid 3 en lid 4 van de richtlijn. Het eerste lid heeft betrekking op de situatie dat er wordt vermoed of geconstateerd dat een ziekteverwekker of een giftige stof zich verspreidt die schadelijk kan zijn voor de volksgezondheid. Indien de minister van Volksgezondheid de bevolking dan adviseert of dringend verzoekt om de gevolgen daarvan tegen te gaan door een bepaald geneesmiddel te gebruiken waarvoor geen handelsvergunning is verleend zou dat gebruik schade voor de gezondheid bij mensen kunnen veroorzaken. Het eerste lid bepaalt daaromtrent dat alleen de Staat der Nederlanden, en dus bijvoorbeeld niet de fabrikant van het geneesmiddel, voor de schade van dat gebruik aansprakelijk kan worden gesteld.
Het tweede lid van artikel 41 houdt in dat als het desbetreffende geneesmiddel, dat op advies van de minister van Volksgezondheid wordt gebruikt, schade veroorzaakt als gevolg van een fout bij de productie van het geneesmiddel en derhalve onder de «gewone» regeling van de productaansprakelijkheid in het Burgerlijk Wetboek valt, de Staat voor die schade niet aansprakelijk is.
De leden van de PvdA-fractie vragen of artikel 46. eerste lid, ziet op twee verschillende besluiten of op één besluit.
Artikel 46, eerste lid, houdt in dat het besluit tot verlening van de handelsvergunning tevens uitsluitsel geeft over de samenvatting van productkenmerken. Materieel gaat het, zoals de leden van de PvdA-fractie terecht vermoeden, om twee besluiten, formeel gaat het om één besluit dat bestaat uit verschillende onderdelen. De belanghebbende kan bezwaar maken tegen het niet verlenen van een handelsvergunning, maar ook tegen het afzonderlijke (deel)besluit inzake de samenvatting van productkenmerken.
De leden van de PvdA-fractie vragen wat moet worden verstaan in artikel 49. lid 8, onder «het in voldoende mate in voorraad hebben van geneesmiddelen».
In antwoord op deze vraag merk ik het volgende op. De houder van de handelsvergunning is op grond van de wet verplicht om voor de continuïteit van de aflevering van het geneesmiddel zorg te dragen. De houder van de handelsvergunning of de groothandelaar houden er in hun bedrijfsvoering uiteraard rekening hoe groot de gemiddelde vraag naar een bepaald geneesmiddel is en hoe groot de omzetsnelheid van het geneesmiddel is. In de praktijk zal de houder van de handelsvergunning ervoor zorgen dat hij voldoende voorraad in huis heeft om aan de te kunnen voldoen.
In geval van een regionale of nationale noodsituatie zullen de leveranciers van de desbetreffende geneesmiddelen zelf kunnen leveren of vanuit andere delen van Nederland of andere (lid)staten aan de behoefte aan desbetreffende geneesmiddel kunnen tegemoet komen. Al deze aspecten spelen een rol bij de invulling van het begrip «in voldoende mate voorradig zijn» als bedoeld in artikel 49, achtste lid.
De leden van de CDA-fractie vragen of hun veronderstelling juist is dat traditionele kruidengeneesmiddelen, bedoeld in artikel 50 lid 1, de middelen zijn als bedoeld in artikel 42 lid 8.
Deze veronderstelling is juist.
De leden van de CDA-fractie vragen of het openbaar register genoemd in artikel 53 van de Geneesmiddelenwet ook op internet te raadplegen is.
Het antwoord hierop luidt bevestigend, het desbetreffende register is op de website van het CBG te raadplegen.
De leden van de CDA-fractie vragen zich af hoe de verhouding tussen artikel 10 en artikel 54 van de Geneesmiddelenwet is.
Het punt van de vaststelling van tarieven voor sommige CBG-activiteiten is in beide artikelen geregeld. Dit is een doublure, die zal worden rechtgezet bij een komende wetswijziging.
De leden van de PvdA-fractie vragen hoe een UR-verklaring voorkomt dat een geneesmiddel toch niet volgens het voorschrift wordt gebruikt.
Met de UR-verklaring wordt bereikt dat tussenkomst van een arts en apotheker noodzakelijk is. De arts stelt de diagnose en schrijft de therapie voor, de apotheker stelt ter hand en levert farmaceutische zorg. Zowel bij het voorschrijven als bij het terhandstellen kan de patiënt gewezen worden op het belang van navolging van het gebruiksvoorschrift. Dit zal zeker gebeuren indien dat de reden was van de UR-verklaring. Hiermee kan uiteraard niet geheel worden uitgesloten dat het geneesmiddel verkeerd wordt gebruikt, maar het risico wordt wel zoveel als mogelijk teruggedrongen.
In artikel 58 lid 5 is bepaald dat bij ministeriële regeling nadere regels worden gesteld ten aanzien van de criteria aan de hand waarvan het CBG besluit tot de indeling van geneesmiddelen. Het komt de leden van de CDA-fractie wenselijk voor dat deze materie wordt neergelegd in een algemene maatregel van bestuur en dat deze bij beide Kamers wordt voorgehangen.
Ik heb elders in deze Memorie reeds toegezegd dat ik de regeling ook vooraf zal toezenden aan de Eerste Kamer, gelijktijdig met de voorhang bij de Tweede Kamer. Wat de status van de regeling betreft blijft mijnerzijds toch een sterke voorkeur bestaan voor het niveau van de ministeriële regeling. Het niveau van de ministeriële regeling is passend gelet op de mate van detaillering. Oorspronkelijk was het zelfs de bedoeling dat het CBG terzake beleidsregels zou stellen, waarin het CBG zou aangeven hoe het om zou gaan met zijn wettelijke bevoegdheden. De hoofdcriteria zijn immers reeds op wetsniveau vastgelegd in artikel 58, eerste en tweede lid. Het College deelt een geneesmiddel in als UA indien dit naar zijn oordeel uit een oogpunt van medicatiebewaking, voorlichting of begeleiding bij de terhandstelling noodzakelijk is. Het College besluit tot indeling in de AV-categorie indien dit naar zijn oordeel uit een oogpunt van veilig gebruik verantwoord is, gelet op de werkzame stof, de dosering en verpakkingsgrootte. De woorden «naar zijn oordeel» geven aan dat het College hierbij enige, noodzakelijk geachte, beoordelingsvrijheid heeft.
In antwoord op de desbetreffende vraag van de leden van de CDA-fractie kan ik u mededelen dat de lijsten van UR-, UA-, UAD- en AV-geneesmiddelen op de website van het CBG zullen worden geplaatst.
De leden van de PvdA-fractie vragen zich af op welke wijze de levering van geneesmiddelen via internet effectief voorkomen kan worden.
Het leveren van geneesmiddelen via het internet is niet te voorkomen. Internet is een wereldwijd medium waar iedere burger gebruik van kan maken, hetgeen ook een ieders eigen verantwoordelijkheid is. Wel is er, voorzover mogelijk en toegestaan, sprake van toezicht op het geneesmiddelenverkeer via internet door de IGZ. Ook indien er sprake is van reclame voor geneesmiddelen via het internet wordt hierop toegezien door de IGZ.
De leden van de PvdA-fractie vragen hoe artikel 102, waarin staat dat de minister niet tweemaal een bestuurlijke boete kan opleggen vanwege dezelfde gedraging, zich verhoudt tot artikel 101, lid 2, waaruit blijkt dat een apotheker een strafbaar feit begaat indien hij tweemaal een boete krijgt voor dezelfde gedraging.
Artikel 101, lid 2, heeft betrekking op eenzelfde gedraging; dat wil zeggen een bepaalde gedraging van een bepaalde (rechts)persoon waaraan hij zich meer dan eenmaal schuldig heeft gemaakt en waarvoor telkens een bestuurlijke boete kan worden opgelegd. Artikel 102, eerste lid, onder a, heeft betrekking op dezelfde gedraging van de betrokkene, dat wil zeggen op één feitencomplex waaraan hij zich schuldig heeft gemaakt. Dat doet zich voor als de onderdelen van het feitencomplex nauw samenhangen en de betrokkene voor elk van de onderdelen een verwijt van dezelfde strekking kan worden gemaakt.
Kopieer de link naar uw clipboard
https://zoek.officielebekendmakingen.nl/kst-20062007-29359-D.html
De hier aangeboden pdf-bestanden van het Staatsblad, Staatscourant, Tractatenblad, provinciaal blad, gemeenteblad, waterschapsblad en blad gemeenschappelijke regeling vormen de formele bekendmakingen in de zin van de Bekendmakingswet en de Rijkswet goedkeuring en bekendmaking verdragen voor zover ze na 1 juli 2009 zijn uitgegeven. Voor pdf-publicaties van vóór deze datum geldt dat alleen de in papieren vorm uitgegeven bladen formele status hebben; de hier aangeboden elektronische versies daarvan worden bij wijze van service aangeboden.
