Kamerstuk
| Datum publicatie | Organisatie | Vergaderjaar | Dossier- en ondernummer |
|---|---|---|---|
| Tweede Kamer der Staten-Generaal | 2023-2024 | 36343 nr. 3 |
Zoals vergunningen, bouwplannen en lokale regelgeving.
Adressen en contactpersonen van overheidsorganisaties.
U bent hier:

| Datum publicatie | Organisatie | Vergaderjaar | Dossier- en ondernummer |
|---|---|---|---|
| Tweede Kamer der Staten-Generaal | 2023-2024 | 36343 nr. 3 |
Aan de Voorzitter van de Tweede Kamer der Staten-Generaal
Den Haag, 9 oktober 2023
De vaste commissie voor Volksgezondheid, Welzijn en Sport heeft mij verzocht te reageren op de initiatiefnota over «Geneesmiddelen weer binnen bereik» van het lid Van den Berg (CDA).1 In deze brief geef ik mijn reactie op de verschillende voorstellen die het lid Van den Berg in deze initiatiefnota heeft gedaan.
Allereerst dank ik het lid Van den Berg voor het schrijven van deze initiatiefnota waarin zij oproept tot het oplossen van geneesmiddelentekorten en tot het beperken van de negatieve gevolgen van geneesmiddelengebruik. Net als het lid Van den Berg maak ik mij zorgen over de beschikbaarheid van geneesmiddelen. Waar in de initiatiefnota nog wordt gesproken over 1514 meldingen van geneesmiddelentekorten in 2022, heeft de KNMP inmiddels laten weten dat het aantal meldingen in de eerste helft van 2023 is opgelopen tot 1179.2 De urgentie voor ingrijpen om de beschikbaarheid van geneesmiddelen te waarborgen is dus toegenomen.
Ik heb in mijn brief van 13 maart jl.3 aan uw Kamer laten weten dat de oorzaken van beschikbaarheidsproblemen multifactorieel zijn. De oplossingen zoek ik dan ook in een breed scala aan acties, zowel bij genees- als hulpmiddelen en zowel nationaal als internationaal. Tegelijkertijd heb ik meerdere keren aangegeven dat ik, ondanks mijn maximale inzet, geen volledige beschikbaarheid kan garanderen én dat voor het aanpakken van beschikbaarheidsproblemen de samenwerking met veldpartijen essentieel is. Inmiddels heb ik uw Kamer in de brief van 4 juli jl. geïnformeerd over de voortgang van mijn inzet op dit gebied.4
In deze brief reageer ik puntsgewijs op de zes voorstellen die het lid Van den Berg doet in haar nota.
Voorstel 1. Onderzoek de oorzaken van regionale verschillen in medicijngebruik en bevorder het ontpillen. Treed tevens met apothekers in overleg over nieuwe bekostigingsmogelijkheden rondom het stoppen en minderen van medicatie.
In het kader van het Integraal Zorgakkoord (IZA) en het Programma Wonen, Ondersteuning en Zorg voor Ouderen (WOZO) ben ik in gesprek met veldpartijen om te komen tot een toekomstvisie op en afspraken over het optimaliseren van de farmaceutische zorg. Centraal staat de vraag welke behoefte aan farmaceutische zorg er nu bestaat en wat nodig zal zijn om daaraan – ook in de toekomst waarin de zorgvraag naar verwachting toeneemt – te blijven voldoen. Partijen hebben daartoe gezamenlijke ambities op bestuurlijk niveau vastgesteld. Zo onderschrijven alle partijen de uitgangspunten van passende farmaceutische zorg en de centrale rol van de apotheker als zorgverlener daarin. Uit de gesprekken blijkt ook dat, hoewel de inhoud van de extramurale zorg zelf centraal staat, het bekostigingsvraagstuk ook deel zal moeten worden van de uiteindelijke afspraken. Ik zal uw Kamer aan het einde van dit jaar informeren over de voortgang van de gesprekken.
Het is van belang dat patiënten hun geneesmiddelen goed en veilig gebruiken en, wanneer gebruik niet langer nodig is, tijdig minderen en stoppen. Om dit te bevorderen is het van belang dat zorgverleners op lokaal en regionaal niveau eenduidige afspraken maken over het voorschrijf- en afbouwbeleid. Het verstevigen van de samenwerking tussen zorgverleners op lokaal en regionaal niveau kan het minderen en stoppen van medicatie bevorderen. Verdiepend op de te maken afspraken over het optimaliseren van de farmaceutische zorg en aansluitend bij de beweging van regionaliseren onder het IZA zullen regionale verschillen bekeken worden en de resultaten besproken worden met apothekers.
Voorstel 2. Onderzoek de prijsstelling van generieke geneesmiddelen, bijvoorbeeld ten opzichte van Duitsland en België, die niet meer verkrijgbaar zijn en waardoor medische problemen zijn ontstaan en kijk of het boetebeleid proportioneel is.
Het lid Van den Berg doet in haar initiatiefnota het voorstel om de prijsstelling van geneesmiddelen die in Nederland niet meer verkrijgbaar zijn te vergelijken met bijvoorbeeld Duitsland en België. De redenatie hierachter is dat het voor sommige geneesmiddelen niet lonend zou zijn om in Nederland op de markt te zijn vanwege de lage prijs. Ik onderzoek op dit moment of deze analyse uitgevoerd kan worden. Gezien de complexiteit van de data die nodig is, kan ik op dit moment niet aangeven of deze analyse ook daadwerkelijk kans van slagen heeft. Ik zal in de volgende Kamerbrief over de beschikbaarheid van medische producten een update geven over deze analyse. Vooruitlopend hierop wil ik wel nogmaals aangeven dat geneesmiddeltekorten en het uit de handel halen van geneesmiddelen een wereldwijd probleem is en vele complexe oorzaken kent. Bij veel ernstige tekorten zien we dan ook dat omringende landen ook beschikbaarheidsproblemen hebben, denk bijvoorbeeld aan Visudyne, Metalyse/Actilyse of Sabril. Het uit de handel halen van een geneesmiddel is daarnaast ook een beslissing die veelal genomen wordt door het (Europese) hoofdkantoor voor meerdere landen tegelijk.
Boetebeleid
Het lid Van den Berg vraagt om te kijken of het boetebeleid proportioneel is. Hieronder ga ik in op de voorgeschiedenis van de maximale bestuurlijke boetehoogte, het boetebeleid en de mogelijke opeenstapeling van een bestuurlijke boete met een contractuele boete indien partijen een boetebeding overeenkomen.
Bestuurlijke boetes
Geneesmiddelentekorten zijn een ernstig probleem dat tot grote negatieve gevolgen kan leiden voor patiënten. Om deze tekorten zoveel mogelijk te voorkomen, zijn groothandels- en handelsvergunninghouders van geneesmiddelen in de Geneesmiddelenwet verplicht om voldoende voorraden aan te houden (artikel 49, lid 9). Daarnaast zijn handelsvergunninghouders verplicht om onderbrekingen van de handel tijdig te melden bij het Meldpunt geneesmiddelentekorten en -defecten (artikel 49, lid 7, hierna; het Meldpunt) van het College ter Beoordeling van Geneesmiddelen (CBG) en de Inspectie Gezondheidszorg en Jeugd (IGJ). In de Geneesmiddelenwet is de bevoegdheid opgenomen om een bestuurlijke boete op te leggen bij overtreding van deze wettelijke bepalingen. Het boetemaximum van deze wet bedraagt de zesde categorie van artikel 23, vierde lid, van het Wetboek van Strafrecht. Graag wijs ik erop dat de maximumhoogte van de bestuurlijke boete is ingegeven door de aangenomen (Handelingen II 2015/16, nr. 55, item 27) nader gewijzigde motie van de voormalige leden Bruins Slot en Van Gerven, waarin verzocht werd om een substantiële verhoging van de bestuurlijke boete.5 Deze motie is ingediend in het kader van een debat over medicijnentekort in het algemeen en het tekort van het geneesmiddel Thyrax in het bijzonder. Dit heeft geleid tot wijziging van de Geneesmiddelenwet in verband met technische verbeteringen en verhoging van het boetemaximum, die op 1 januari 2019 in werking is getreden.6
De Beleidsregels bestuurlijke boete Ministerie Volksgezondheid Welzijn en Sport 2019 (hierna: beleidsregels) bevatten factoren aan de hand waarvan we daadwerkelijk op te leggen boetebedrag wordt bepaald. Per overtreding heeft de Minister passende normbedragen binnen het wettelijk boetemaximum vastgesteld. Dit bedrag vormt het uitgangspunt voor de berekening van het boetebedrag, waarna een verdere differentiatie plaatsvindt. Bij boeteoplegging wordt bijvoorbeeld gekeken of een natuurlijk persoon of een onderneming de overtreding heeft begaan, en indien dat laatste het geval is wordt ook de grootte van de onderneming betrokken. Gelet op de financiële draagkracht van grote ondernemingen, zijn hoge boetes nodig om een afschrikwekkend effect te hebben. De initiatiefnota signaleert echter dat bepaalde bedrijven het bedrijfsrisico dusdanig hoog inschatten dat zij besluiten te stoppen met het produceren van medicijnen met een geringe omzet, wat een averechts effect kan hebben op de beschikbaarheid van geneesmiddelen. In de praktijk zie ik dat er momenteel veel meldingen bij het Meldpunt worden gedaan van mogelijke leveringsonderbrekingen. De meerderheid van deze meldingen wordt zekerheidshalve gedaan en leidt uiteindelijk niet tot een daadwerkelijk tekort voor de patiënt. Dit grote aantal meldingen bemoeilijkt het tijdig signaleren en acteren op daadwerkelijke leveringsonderbrekingen. In vervolg op de aankondiging in de brief van 4 juli jl., kijk ik op dit moment binnen de herziening van de boetebeleidsregels op welke wijze het boetebeleid gewijzigd moet worden om hiermee de proportionaliteit beter te borgen. Ik ben hierover in gesprek met de IGJ. Deze wijziging treedt in werking met ingang van 1 januari 2024. Hiermee kom ik tegemoet aan het voorstel van lid Van den Berg om te kijken of het boetebeleid proportioneel is.
Boetebedingen in contractuele afspraken
Overeenkomsten kunnen boetebedingen bevatten, die inhouden dat de ene partij aan de andere partij een boete verschuldigd is indien sprake is van een toerekenbare tekortkoming.
Zo spreken de meeste zorgverzekeraars met leveranciers van preferente geneesmiddelen contractueel af dat bedrijven het verschil in prijs moeten betalen als zij hun product niet kunnen leveren. Dit voorkomt dat de rekening voor een tekort bij de premiebetaler komt. Ook hier heb ik signalen ontvangen dat deze contractuele boetes mogelijk ongewenste neveneffecten hebben op de beschikbaarheid van geneesmiddelen. Zo zijn bedrijven bijvoorbeeld huiverig om in te springen bij een tekort van een concurrent uit angst om zelf uit te verkopen, met vergoeding voor prijsverschillen als gevolg. Ik ben daarom in gesprek met zorgverzekeraars om aandacht te vragen voor de mogelijke neveneffecten van deze afspraken, zodat toegewerkt wordt naar een evenwichtig systeem dat de beschikbaarheid bevordert.
Voorstel 3. Maak een plan van aanpak om het magistraal bereiden door kleine en grote bereidende apothekers in Nederland aantrekkelijker te maken, inclusief een reactie op bijgaande brief vanuit het veld over het Belgische model.
Voor de appreciatie van dit voorstel zal ik specifiek ingaan op de verankering van doorgeleverd bereiden, de vergoeding van apotheekbereidingen en de rol van apotheekbereidingen bij tekorten. Ten slotte geef ik een reactie op de bijgevoegde brief vanuit het veld over het Belgische model.
Verankering doorgeleverd bereiden
Ik deel het uitgangspunt van het lid Van den Berg dat de voorkeur uitgaat naar geregistreerde geneesmiddelen, maar dat apotheekbereidingen in sommige gevallen een oplossing kunnen bieden. Ik zie een rol voor doorgeleverde apotheekbereidingen binnen het huidige geneesmiddelensysteem, omdat er in de praktijk behoefte bestaat aan geneesmiddelen waarvan (tijdelijk of structureel) geen geregistreerde vormen (commercieel) beschikbaar zijn op de Nederlandse markt en de meeste apotheken tegenwoordig niet meer kunnen of willen bereiden. Het collegiaal doorleveren van apotheekbereidingen wordt hierom sinds 2002 gedoogd op grond van de circulaire «Handhavend optreden bij collegiaal doorleveren van eigen bereidingen door apothekers» (hierna: de circulaire) van de IGJ. Afgelopen zomer is deze circulaire voor één jaar verlengd door de IGJ, en zijn VWS en IGJ al langer in gesprek over de passendheid en wenselijkheid van de huidige circulaire. Collegiaal doorgeleverde bereidingen zijn tegenwoordig een vast onderdeel van significante omvang (4,7 miljoen vergoede uitgiftes in 2021 extramuraal7) in de geneesmiddelvoorziening in Nederland, zonder dat dit type geneesmiddel wettelijk verankerd is. Het is wenselijk dat er op Europees niveau wordt ingezet op een haakje om doorgeleverde bereidingen juridisch te kunnen verankeren. De herziening van de farmaceutische basiswetgeving biedt op dit moment op Europees niveau de mogelijkheid om juridische verankering te bewerkstelligen. Echter is dit een traject van lange adem, waarbij de gewenste uitkomst niet gegarandeerd isHierom werk ik samen met de IGJ in de tussenperiode aan een beleidsregel vanuit het Ministerie van VWS die de circulaire in 2024 zal vervangen om meer zekerheid te bieden voor doorgeleverde bereidingen. Hierbij is het uitgangspunt om de huidige voorwaarden uit de circulaire over te nemen. Tegelijkertijd is het goed om de kansen, die zich voordoen tijdens dit traject om de patiëntveiligheid te verbeteren, ook te gebruiken. Bij dit traject zullen de IGJ en ik het veld nauw betrekken. In oktober ga ik hierover met veldpartijen in gesprek om het vervolgtraject te bespreken. Het huidige voornemen is dat de beleidsregel voor de zomer gepubliceerd wordt.
Vergoeding van magistrale apotheekbereidingen
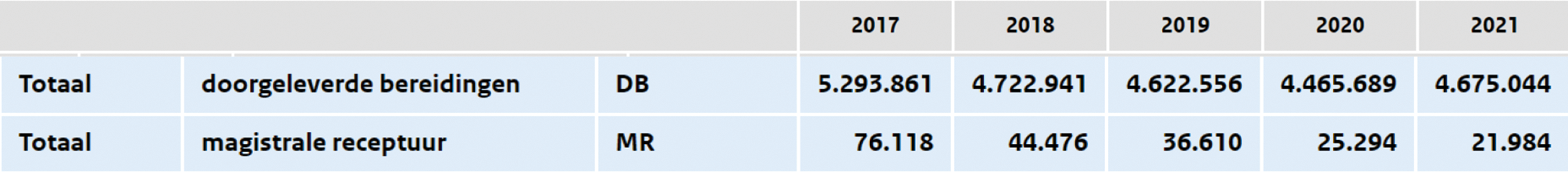
In Nederland neemt de uitgifte van vergoede magistrale bereidingen in de extramurale farmacie de afgelopen jaren af (tabel 1). Er is geen goede data beschikbaar over apotheekbereidingen in de intramurale farmacie. De aanspraak op apotheekbereidingen als onderdeel van farmaceutische zorg is geregeld in het Besluit zorgverzekeringen (hierna: Bzv) en de Regeling zorgverzekering (hierna: Rzv).
Apotheekbereidingen worden alleen vergoed wanneer er sprake is van rationele farmacotherapie8 en – tenzij bij ministeriële regeling anders is bepaald – indien (nagenoeg) gelijkwaardig aan een geregistreerd geneesmiddel dat is opgenomen in het GVS9. De initiatiefnota stelt dat de vergoeding van magistrale bereidingen niet altijd toereikend is voor de daadwerkelijk gemaakte kosten en dat deze als administratief belastend wordt ervaren door apothekers. De precieze onderbouwing hiervan wordt niet uiteengezet in de nota en het is mij hierom niet duidelijk waar het probleem precies wordt ervaren. Ik kaart dit punt graag aan binnen de reeds bestaande overleggen met apothekers om de precieze knelpunten te identificeren. Op basis hiervan zal ik verdere stappen nemen, als blijkt dat hier aanleiding toe is.
Tabel 1: aantal vergoede extramurale uitgiftes (GIP-databank)
Apotheekbereidingen bij tekorten
Bij geneesmiddelentekorten wordt door het Meldpunt eerst gekeken of er een alternatief mogelijk is van een geregistreerd geneesmiddel in Nederland, de Europese Unie of een MRA-land10. Geregistreerde alternatieven hebben als voordeel dat de kwaliteit vooraf is getoetst en dat deze direct of vrijwel direct inzetbaar zijn bij tekorten. Apotheekbereidingen kunnen een rol spelen bij het opvangen van tekorten, wanneer er geen geregistreerd alternatief beschikbaar is. Het hangt van een aantal aspecten af of apotheekbereidingen een oplossing kunnen bieden, namelijk de algemene beschikbaarheid aan grondstoffen en de beschikbaarheid bij de apotheekbereider aan juiste kennis en faciliteiten om het betreffende geneesmiddel te kunnen bereiden. Farmanco rapporteert dat in 2022 in 1,8% van de gevallen is uitgeweken naar een apotheekbereiding als (gedeeltelijke) oplossing11.
In de initiatiefnota wordt gesteld dat het bieden van een oplossing door middel van apotheekbereidingen tegen belemmeringen aanloopt. Specifiek wordt genoemd dat de vraag naar magistrale bereidingen bij een tekort hoger is dan wat wordt toegestaan. Op het moment dat er sprake is van een tekort, is er echter geen geregistreerd alternatief. Dit betekent dat apotheekbereidingen binnen de kaders van doorgeleverde bereidingen kunnen vallen, waaraan geen voorwaarde van schaalgrootte is gekoppeld. Dit punt herken ik daarmee niet. Ook worden de investeringsrisico’s genoemd als belemmering bij grootbereiders om in te springen bij tekorten. Het klopt dat wanneer een geneesmiddel in tekort weer op de markt beschikbaar is, doorgeleverde bereidingen niet meer worden gedoogd. Ik ben bereid om te kijken of het wenselijk is om de rol van apotheekbereidingen bij tekorten te vergroten door mogelijke belemmeringen weg te nemen. Daarbij moet de kwaliteit, werkzaamheid en veiligheid van het geneesmiddel leidend zijn.
Reactie op bijgaande brief vanuit het veld over het Belgische model
Tijdens het plenaire debat in uw Kamer op 18 januari 202312 over het wetsvoorstel Verzamelwet VWS 202213 heeft het lid Van den Berg (CDA) een amendement over apotheekbereidingen ingediend14. In de Kamerbrief van 20 januari 202315 over toezeggingen naar aanleiding van dat debat heb ik uw Kamer het amendement onderbouwd ontraden. Tijdens de stemmingen op 31 januari 202316 heeft het lid Van den Berg het amendement met instemming van uw Kamer ingetrokken. Op 17 april 2023 heeft het lid Van den Berg de initiatiefnota «Geneesmiddelen weer binnen bereik»17 bij uw Kamer ingediend. De initiatiefnota gaat inhoudelijk in op mijn onderbouwing in de Kamerbrief om het amendement te ontraden en doet een voorstel voor een in te dienen aangepast amendement en vraagt hierover mijn reactie.
Kader 1: Voorstel aangepast amendement uit initiatiefnota (vetgedrukt zijn toevoegingen t.o.v. ingediend amendement tijdens Verzamelwet 2022) (Kamerstuk 36 002)

Allereerst moet ik opmerken dat er geen mogelijkheid meer is om een aangepast amendement in te dienen met betrekking tot wetsvoorstel Verzamelwet VWS 2022, aangezien deze wet inmiddels in het Staatsblad (Stb. 2023, nr. 293) is gepubliceerd. Mijn reactie heeft daarmee betrekking op uitwerking van het voorstel in wetgeving op andere wijze.
Ik deel het standpunt dat een juridische verankering voor het doorleveren van apotheekbereidingen de voorkeur heeft boven gedoogbeleid. Ik zet mij hierom binnen de herziening van de Europese basiswetgeving in om deze ruimte te creëren en juridische verankering te bewerkstelligen. In dit licht heb ik dan ook met interesse van het voorstel kennisgenomen.
Het voorstel poneert een mogelijke juridische route om het gedoogbeleid te vervangen binnen het huidige stelsel. Het lezen van de argumentatie in de (bijlage van de) initiatiefnota brengt mij echter niet op een ander standpunt dan eerder tijdens bovengenoemd debat verwoord en in bovengenoemde Kamerbrief opgenomen. Hoewel in de initiatiefnota enkele punten uit de Kamerbrief geadresseerd zijn en daarmee enkele van mijn eerder geuite bezwaren worden weggenomen, blijven er nog grote inhoudelijke bezwaren bestaan.
Het voorstel neemt mijn bezwaar weg rondom het uitbesteden aan fabrikanten met een vergunning. Ook geeft het voorstel ruimte om de term «uitbesteding» nader uit te werken. Echter, richtlijn 2001/83 EG (hierna: richtlijn; Geneesmiddelenrichtlijn) biedt geen ruimte voor nationale regels waarin wordt toegestaan dat apotheekbereidingen worden uitbesteed. Er wordt in het voorstel overigens ook geen nadere invulling gegeven aan de term «uitbesteden».
De andere argumenten om eerder het amendement te ontraden blijven na het lezen van de initiatiefnota ook gelden ten aanzien van het voorstel, zowel het feit dat het voorstel op gespannen voet staat met de richtlijn, als de inhoudelijke vragen die het oproept (zie hierna de subalinea’s «Geneesmiddelenrichtlijn» en «inhoudelijke bezwaren»)
Geneesmiddelenrichtlijn
Het voorstel geeft mijn inziens geen nadere invulling aan de mogelijkheid op kleine schaal geneesmiddelen in een apotheek te bereiden, zoals de initiatiefnota stelt, maar geeft invulling aan wie er mag bereiden en waar, waardoor het voorstel op gespannen voet staat met de richtlijn. Artikel 3, onderdeel 2, van de richtlijn luidt voor zover hier van toepassing: «Deze richtlijn is niet van toepassing op (...) geneesmiddelen die in de apotheek overeenkomstig de aanwijzingen van de farmacopee worden bereid en voor verstrekking rechtstreeks aan de klanten van die apotheek zijn bestemd (...).»
In de initiatiefnota wordt gesteld dat er in het Abcur-arrest van 16 juli 2015 van het Hof van Justitie van de Europese Unie (hierna: het Hof)18 «niet staat dat «de apotheek» waarin het middel bereid wordt, dezelfde apotheek moet zijn waarin het middel aan een patiënt van die apotheek ter hand wordt gesteld». Die lezing van dit arrest kan ik niet delen. Een paar citaten uit genoemd arrest kunnen dit verduidelijken. Het arrest behandelt (kortgezegd) rechtsvragen over een geneesmiddel dat aan niet aan het bereidende ziekenhuis verbonden apotheken wordt geleverd op basis van een «abonnementssysteem» waarbij die apotheken zijn aangesloten. De conclusie van het Hof luidt: «Het Hof (Derde kamer) verklaart voor recht: (...) Die geneesmiddelen kunnen slechts onder de uitzondering van artikel 3, punt 2, van richtlijn 2001/83, zoals gewijzigd bij richtlijn 2004/27, vallen wanneer zij rechtstreeks worden verstrekt door de apotheek die deze geneesmiddelen voor haar klanten heeft bereid.».
In overweging 67 van genoemd arrest stelt het Hof: «In dit verband blijkt uit de bewoordingen van artikel 3, onderdeel 2, van richtlijn 2001/83, (...), dat het betrokken geneesmiddel «in de apotheek» moet zijn bereid en «rechtstreeks» aan de klanten van «die» apotheek moet worden verstrekt. Bijgevolg moet dit geneesmiddel, om te vallen onder de uitzondering waarin die bepaling voorziet, rechtstreeks worden verstrekt door de apotheek die dit geneesmiddel voor haar klanten heeft bereid.»
Het Hof geeft een beperkte uitleg aan de uitzonderingen voor formula magistralis en formula officinalis zoals omschreven in artikel 3, onderdeel 1 respectievelijk 2, van de richtlijn.
In de initiatiefnota wordt gesteld dat de patiënt geen patiënt van de bereidende apotheek wordt. Dit weerlegt echter niet mijn eerder gegeven argument dat in die situatie geen sprake is van «rechtstreekse verstrekking aan klanten van de apotheek».
Inhoudelijke bezwaren
De praktische uitwerking van het voorstel en welk probleem dit voorstel beoogt op te lossen, is in mijn ogen onvoldoende duidelijk. Ook ontbreekt er een analyse van de impact van het voorstel op de kwaliteit en veiligheid van bereidingen, en op de geneesmiddelenbewaking. In de initiatiefnota wordt niet ingegaan op deze wezenlijke punten.
In de initiatiefnota wordt voorts gesteld dat er geen verschil is tussen het voorstel en doorgeleverde bereidingen. Ik zie dat verschil wel. Doorgeleverde bereidingen zijn in strijd met de richtlijn en de Geneesmiddelenwet. Het collegiaal doorleveren wordt alleen gedoogd wanneer er geen geregistreerd adequaat alternatief is van een geneesmiddel waar wel behoefte aan is bij de patiënt. Het gedoogbeleid rondom doorgeleverde bereidingen, beoogt de beschikbaarheid van niet-geregistreerde geneesmiddelen voor de patiënt te bevorderen, wanneer deze geen enkele andere optie heeft. Doorgeleverde bereidingen worden hierom ook gedoogd op grotere schaal, dan de geldende kleine schaal bij magistrale bereidingen, zoals geregeld in de Geneesmiddelenwet. Alleen omdat er geen enkele andere optie is, en alleen als voldaan aan de voorwaarden, wordt niet gehandhaafd.
Tot slot wordt in het voorstel gesteld dat de circulaire «Handhavend optreden bij collegiaal doorleveren van eigen bereidingen door apothekers» (hierna: de circulaire) van de IGJ over doorgeleverde bereidingen niet verlengd hoeft te worden, wanneer het voorstel zou worden uitgewerkt in wetgeving. Het voorstel beoogt het doorleveren van apotheekbereidingen op kleine schaal. Dat zou in praktijk niet aansluiten bij de behoefte die de doorgeleverde breidingen adresseert. Zoals eerder aangegeven, is de geldende schaalgrootte voor collegiaal doorgeleverde bereidingen groter dan bij magistrale bereidingen. Met het huidige aantal bereidende apotheken (179 volgens de initiatiefnota) en aantal patiënten die aangewezen zijn op doorgeleverde bereidingen (1,6 miljoen19), is de verwachting dat de huidige kleine bereidende apotheken niet de faciliteiten hebben om het aanbod van grootbereiders te overbruggen. Gezien wat het voorstel beoogt en wat de circulaire toestaat, niet overeenkomen, zou het discontinueren van het beleid waarmee doorgeleverde bereidingen wordt gedoogd, leiden tot grote verschuivingen binnen het huidige geneesmiddelensysteem waarbij de beschikbaarheid van geneesmiddelen voor patiënten naar verwachting zeer in het geding komt.
Het voorstel staat, zou het worden uitgewerkt in wetgeving, nog steeds op gespannen voet met de richtlijn en roept nog altijd inhoudelijke vragen op.
Het is onvoldoende duidelijk welk probleem het voorstel beoogt op te lossen. Apothekers die zelf niet kunnen of willen bereiden, kunnen als een bepaald geneesmiddel niet beschikbaar is, uitwijken naar (buitenlandse) varianten op het geregistreerde beschikbare geneesmiddel en kunnen door middel van doorgeleverde bereidingen reeds toegang krijgen tot apotheekbereidingen van niet geregistreerde geneesmiddelen.
Voorstel 4: Stel meer eisen aan dure geneesmiddelen zoals uitgiftekluis, biomarkers, praktijkonderzoek, eisen aan numbers to harm en numbers to treat en geef het Zorginstituut meer mogelijkheden te sturen op het basispakket.
Ik onderschrijf de oproep van het lid Van den Berg over het treffen van maatregelen voor dure geneesmiddelen. Ik heb hier in het IZA met partijen afspraken over gemaakt. Recent heb ik uw Kamer geïnformeerd over de maatregelen die ik voor ogen heb om het stelsel voor de vergoeding van nieuwe dure geneesmiddelen toekomstbestendig te maken20. In deze brief ben ik ook ingegaan op het door het lid van den Berg genoemde praktijkonderzoek. Ik zie voor praktijkonderzoek met name een rol bij het gepast gebruik van dure geneesmiddelen. Dit valt ook binnen het kader van het traject verbeteren en verbreden van de toets op het basispakket waarin ik werk aan het stellen van aanvullende voorwaarden voor gepast gebruik en onderzoek bij pakkettoelating. Ook wordt ingezet op de ontwikkeling van meer kennis en inzicht over de effectiviteit van behandelingen op de langere termijn. Het belang van praktijkonderzoek, ook wel «real world data» wordt tevens benoemd in het voorstel van de Europese Commissie voor de herziening van de Europese basiswetgeving.21
Ook moleculaire diagnostiek heeft mijn aandacht. Mede naar aanleiding van de door het lid Van den Berg genoemde initiatiefnota, heeft de toenmalig Minister voor Medische Zorg en Sport opdracht gegeven aan het Zorginstituut om onder zijn regie het project moleculaire diagnostiek in de oncologie uit te voeren. Ik heb uw Kamer meerdere keren geïnformeerd over de voortgang van dit project, voor het laatst in mei 202322. Er zijn belangrijke stappen gezet. Zo wordt er gewerkt aan een kwaliteitsstandaard, heeft de nieuw opgerichte commissie ter beoordeling diagnostiek een eerste advies gepubliceerd en is de bekostigingsstructuur aangepast. Het project gaat de afrondende fase in en de komende tijd worden de activiteiten van het project ingebed bij de verschillende partijen. Ik informeer uw Kamer in Q4 2023 over de voortgang van het dossier door middel van de eindrapportage van het project.
Een ander voorstel dat het lid Van den Berg doet is om bij de levering van dure medicijnen verplicht een uitgiftekluis te gebruiken. Ik licht graag toe waarom de uitgiftekluis op dit moment geen middel is om de kosten van dure geneesmiddelen te beperken. Als geneesmiddelen de apotheek hebben verlaten, mogen deze namelijk niet opnieuw uitgegeven worden. Ook niet als deze in de uitgiftekluis hebben gelegen. Deze medicatie is ook uit de keten geweest en valt nu ook onder heruitgifte van geneesmiddelen.
Zoals bekend wordt heruitgifte van geneesmiddelen belemmerd door Europese regelgeving. Ik heb over dit onderwerp vóór de zomer een brief verstuurd naar Europees commissaris Kyriakides om het Nederlandse standpunt over heruitgifte duidelijk te maken. Wij kunnen als Nederland niet zomaar een uitzondering creëren op EU-regels. Zoals in mijn brief aan de Kamer23 over heruitgifte van dure geneesmiddelen beschreven en naar aanleiding van de hierboven genoemde brief aan de Europese Commisssie, bespreek ik dit jaar dit onderwerp met andere lidstaten om zo meer draagvlak te krijgen voor aanpassing van de wetgeving om verspilling van dure geneesmiddelen tegen te gaan.
Voorstel 5: Onderzoek de kosteneffectiviteit van het invoeren van farmacogenetische profielen bij relevante groepen geneesmiddelengebruikers (hoogrisicogroepen), en bevorder samen met het zorgveld de verdere implementatie van farmacogenetica in de praktijk.
Farmacogenetica is een vakgebied dat zich richt op de relatie tussen genetische variaties in het DNA van patiënten en de werkzaamheid en veiligheid van geneesmiddelen. Een farmacogenetische test kan worden uitgevoerd op het moment van voorschrijven van een geneesmiddel. Het is ook mogelijk om voordat er sprake is van het voorschrijven van geneesmiddelen breed te testen op een groot aantal genen. Hiermee kan een overzicht gemaakt worden van relevante genetische variaties die van invloed zijn op geneesmiddelen met bekende gen-geneesmiddel interacties. Dit wordt een farmacogenetisch profiel genoemd (door het lid Van den Berg «enzympaspoort» genoemd).
Ik ben het met het lid Van den Berg eens dat farmacogenetische testen van meerwaarde kunnen zijn. Farmacogenetische testen worden dan ook in praktijk al ingezet. Bijvoorbeeld als patiënten ernstige bijwerkingen ervaren nadat zij een geneesmiddel zijn gaan gebruiken of voorafgaand aan de start van een behandeling. Wanneer er sprake is van een medische indicatie wordt het uitvoeren van dit onderzoek in principe door de zorgverzekeraar vergoed.
Naar aanleiding van een motie van het lid Van den Berg24 werk ik aan de uitvoering van een quickscan naar de voor- en nadelen van het farmacogenetisch profiel. Zoals eerder toegezegd, informeer ik uw Kamer voor de begrotingsbehandeling over de uitkomsten hiervan, als onderdeel van de stand van zaken over de inzet van DNA-technologie voor zorg en preventie. Als de resultaten van de quickscan daar aanleiding toe geven, overweeg ik verdere stappen. Ik ben in dit kader ook benieuwd naar een pilot van het Erasmus MC in samenwerking met zorgverzekeraar CZ, waarbij in 16 huisartsenpraktijken in Noord-Brabant vóór de start van een antidepressivum een farmacogenetische test wordt uitgevoerd. De kosteneffectiviteitsstudie waar de onderzoekers van de door het lid Van de Berg aangehaalde internationale studie25 aan werken is hiervoor ook relevant.
Voorstel 6: Maak afspraken zodat prijs geen factor meer is voor toegankelijkheid van medicatie die de sluisprocedure heeft voldaan en zodat de duur van extra beoordelingsrondes beperkt wordt.
Als de onderhandelingen in het kader van een sluisprocedure zijn afgerond, dan zijn geneesmiddelen pakketwaardig en daarmee onderdeel van het basispakket. Vaak hebben wetenschappelijke verenigingen van medisch specialisten daarvoor al een eigenstandig traject doorlopen waarin wordt beoordeeld of en hoe de beroepsgroep een geneesmiddel wil gaan inzetten in de behandelpraktijk.
De kosten van behandelingen worden slechts benoemd in adviezen en zijn geen besluitvormend criterium bij de vraag of medisch specialisten dit gaan inzetten.
Beoordelingscriteria van wetenschappelijke verenigingen zijn namelijk bedoeld om medisch specialisten een afweging te kunnen laten maken tussen de voor- en nadelen van een middel.
Tot slot
Ik dank het lid Van den Berg nogmaals voor haar initiatiefnota. Ik zet me op alle onderwerpen in om de geneesmiddelenzorg in Nederland goed, betaalbaar en beschikbaar te houden. Ik kijk ernaar uit om met het lid Van den Berg en de andere leden van uw Kamer in gesprek te gaan over de in de nota genoemde onderwerpen.
De Minister van Volksgezondheid, Welzijn en Sport, E.J. Kuipers
https://www.knmp.nl/actueel/nieuws/aantal-geneesmiddelentekorten-stijgt-2023-naar-recordhoogte.
Besluit van 31 oktober 2018, houdende vaststelling van het tijdstip van inwerkingtreding van de Wet van 25 mei 2018 tot wijziging van de Geneesmiddelenwet in verband met technische verbeteringen en verhoging van het boetemaximum (Stb. 2018, nr. 175).
Artikel 2.8, eerste lid, onderdeel b, sub 1o, Bzv. Rationele farmacotherapie is de behandeling, preventie of diagnostiek van een aandoening met een geneesmiddel in een voor de patiënt geschikte vorm, waarvan de werkzaamheid en effectiviteit blijkt uit wetenschappelijke literatuur en dat tevens het meest economisch is voor de zorgverzekering (Farmaceutisch Kompas).
Swen JJ et al. A 12-gene pharmacogenetic panel to prevent adverse drug reactions: an open-label, multicentre, controlled, cluster-randomised crossover implementation study. Lancet. 2023 Feb 4;401(10374):347–356. doi: 10.1016/S0140–6736(22)01841–4. PMID: 36739136.
Kopieer de link naar uw clipboard
https://zoek.officielebekendmakingen.nl/kst-36343-3.html
De hier aangeboden pdf-bestanden van het Staatsblad, Staatscourant, Tractatenblad, provinciaal blad, gemeenteblad, waterschapsblad en blad gemeenschappelijke regeling vormen de formele bekendmakingen in de zin van de Bekendmakingswet en de Rijkswet goedkeuring en bekendmaking verdragen voor zover ze na 1 juli 2009 zijn uitgegeven. Voor pdf-publicaties van vóór deze datum geldt dat alleen de in papieren vorm uitgegeven bladen formele status hebben; de hier aangeboden elektronische versies daarvan worden bij wijze van service aangeboden.
