Kamerstuk
| Datum publicatie | Organisatie | Vergaderjaar | Dossier- en ondernummer |
|---|---|---|---|
| Tweede Kamer der Staten-Generaal | 2014-2015 | 33703 nr. 4 |
Zoals vergunningen, bouwplannen en lokale regelgeving.
Adressen en contactpersonen van overheidsorganisaties.
U bent hier:

| Datum publicatie | Organisatie | Vergaderjaar | Dossier- en ondernummer |
|---|---|---|---|
| Tweede Kamer der Staten-Generaal | 2014-2015 | 33703 nr. 4 |
Hieronder zijn opgenomen het advies van de Afdeling advisering van de Raad van State d.d. 27 september 2013 en de reactie van de indieners d.d. 2 oktober 2014, aangeboden aan de Voorzitter van de Tweede Kamer der Staten-Generaal. Het advies van de Afdeling advisering is cursief afgedrukt.
Bij brief van de voorzitter van de Tweede Kamer der Staten-Generaal van 25 juli 2013 heeft de Tweede Kamer, bij de Afdeling advisering van de Raad van State ter overweging aanhangig gemaakt het voorstel van wet van het lid Kuzu tot wijziging van de Wet geneesmiddelenprijzen met betrekking tot de vaststelling van maximumprijzen voor geneesmiddelen, met memorie van toelichting.
Het voorstel beoogt de maximumprijzen voor geneesmiddelen verder te verlagen door de wijze van berekening van deze prijzen in de Wet geneesmiddelenprijzen (hierna: de WGP) aan te passen. Daartoe beoogt het voorstel het aantal referentielanden dat wordt gebruikt bij de vaststelling van de maximale geneesmiddelenprijzen uit te breiden en de rekensystematiek aan te scherpen. De voorgestelde wijze van berekening is gebaseerd op het systeem dat thans in Noorwegen wordt gebruikt voor de berekening van de maximumprijzen voor geneesmiddelen.
De Afdeling maakt opmerkingen over de effectiviteit en de uitvoeringskosten van het voorstel tot wijziging van de Wet geneesmiddelenprijzen en de verhouding tot het recht van de Europese Unie.
De geneesmiddelenprijzen zijn sinds 1996 gereguleerd door de WGP. Op grond van de WGP kan de Minister van Volksgezondheid, Welzijn en Sport (hierna: VWS) een maximumprijs vaststellen voor een geneesmiddel. Het gaat dan om de maximale prijs waarvoor het geneesmiddel door de apotheek wordt ingekocht (apothekersinkoopprijs). Ingevolge het eerste lid van artikel 2 van de WGP kan de Minister van VWS bij ministeriële regeling een maximumprijs voor een geneesmiddel vaststellen, indien de beschikbaarheid van dit middel voor eenieder door de overheid dient te worden gewaarborgd. De wijze van vaststelling van de maximumprijs voor een geneesmiddel is in het tweede tot en met het vierde lid geregeld. Voor België, de Bondsrepubliek Duitsland, Frankrijk en het Verenigd Koninkrijk (hierna: de huidige referentielanden), wordt een rekenkundig gemiddelde vastgesteld van de prijzen waarvoor deze geneesmiddelen aan de apotheken worden verkocht (apotheekinkoopprijs). De maximumprijs is ten minste het rekenkundige gemiddelde van deze vier referentielanden. Ingevolge artikel 3 van de WGP onderzoekt de Minister van VWS ten minste twee maal per jaar of er aanleiding bestaat de maximumprijs te wijzigen.
De initiatiefnemer stelt voor de wijze van vaststelling van de maximumprijs op twee onderdelen te wijzigen: door uitbreiding van het aantal referentielanden en door de prijs te berekenen op basis van de prijs in de drie goedkoopste referentielanden. Dit systeem wordt ook in Noorwegen gebruikt (hierna: het Noorse systeem). Daartoe worden aan de huidige vier referentielanden zes nieuwe West-Europese landen toegevoegd: Denemarken, Ierland, Finland, Noorwegen, Oostenrijk en Zweden (hierna: de voorgestelde referentielanden).
Volgens de initiatiefnemer kan invoering van het Noorse systeem leiden tot een aanzienlijke daling van de prijzen van merkgeneesmiddelen (spécialités). In Noorwegen liggen de prijzen gemiddeld 7,5% lager dan in Nederland. Gelet op de toenemende kosten van de zorg mag deze mogelijkheid tot besparing niet onbenut blijven, aldus de initiatiefnemer.1 Ter onderbouwing verwijst de initiatiefnemer onder meer naar de bevindingen van een in 2012 in opdracht van de Minister verricht onderzoek door ConQuaestor.2
Dit onderzoek betreft de werking van de WGP in Nederland. Daarbij is ook gekeken naar de effectiviteit van het Noorse systeem. Volgens het onderzoek van ConQuaestor is dit systeem technisch inpasbaar in de Nederlandse situatie. Dit vereist echter een fundamentele aanpassing van de WGP, die mogelijk in strijd is met het Europese recht. Andere beleidsinstrumenten, zoals het preferentiebeleid en het vrijgeven van de consumentenprijzen van geneesmiddelen (marktwerking), hebben wellicht een grotere kans van slagen, aldus het onderzoek.3 De Minister van VWS twijfelt eraan of herberekening van de bestaande vergoedingslimieten zelfs op papier nog aanvullende opbrengsten zou kunnen genereren.4 De Minister verwacht meer van andere beleidsmaatregelen, zoals het met ingang van 1 januari 2012 ingezette beleid om (dure) spécialités integraal onder de ziekenhuisbekostiging te brengen. De Minister verwacht dat instellingen lagere prijzen voor deze medicijnen kunnen bedingen.5
De initiatiefnemer gaat ervan uit dat invoering van het Noorse systeem in Nederland tot gevolg zal hebben dat de prijzen van vooral merkgeneesmiddelen zullen dalen tot het niveau in Noorwegen.6 De initiatiefnemer verwacht niet dat invoering van het Noorse systeem ertoe leidt dat de beschikbaarheid van geneesmiddelen, in het bijzonder spécialités, in Nederland wordt beperkt, omdat dit in Noorwegen ook niet het geval is. De prijzen in de rest van Europa zijn zodanig dat er altijd aan verdiend kan worden door de farmaceutische industrie. Bovendien is de omvang van de Nederlandse markt in relatie tot de totale wereldmarkt beperkt, aldus de toelichting.7
De Afdeling merkt hierover het volgende op.
De Afdeling stelt voorop dat de geneesmiddelenmarkt uitermate complex is. Dit maakt het moeilijk vooraf in te schatten welke prijsbeheersingsmechanismen het meeste effect hebben op de prijzen van geneesmiddelen. Uit het rapport van ConQuaestor komt naar voren dat marktwerking en het preferentiebeleid minder effecten hebben bij spécialités, omdat de onderhandelingspositie van zorgverzekeraars, consumenten en apothekers in dit onderdeel van de markt relatief zwak is. Anders dan bij generieke geneesmiddelen zijn er voor deze middelen geen (goedkopere) alternatieven beschikbaar.8 Niet uit te sluiten valt dat invoering van het Noorse systeem aanvullend kan werken op de beleidsinstrumenten die volgens de Minister meer effect zullen sorteren. In dit verband is van belang dat de overheveling van specialistische middelen naar het ziekenhuisbudget langzamer wordt ingevoerd dan aanvankelijk was gepland, zoals door de initiatiefnemer wordt opgemerkt.9
De initiatiefnemer is verheugd dat ook de Raad van State stelt dat niet uit te sluiten valt dat invoering van het Noorse systeem aanvullend kan werken op de beleidsinstrumenten die volgens de Minister meer effect zullen sorteren. De initiatiefnemer is het eens met de Raad van State dat de geneesmiddelenmarkt uitermate complex is en dat het daarom ook lastig is om in te schatten welke prijsbeheersingsmechanismen het meeste effect zullen hebben. Zonder maatregelen van de rijksoverheid zou de prijs van geneesmiddelen in Nederland jaarlijks met 10% stijgen. Tevens noemt het Ministerie van VWS in een opsomming met vier prijsbeheersingsmechanismen de WGP als tweede mechanisme, waarmee door de invoering van deze wet de prijzen voor geneesmiddelen 20% zijn gedaald.10 Feit blijft dat in Noorwegen de prijzen van specialités gemiddeld 7,5% nog lager liggen.
Indiener onderstreept dat de wijziging is bedoeld als aanvulling op reeds ingezette maatregelen om de prijzen van geneesmiddelen te beheersen. De indiener constateert tegelijkertijd dat juist ingezette maatregelen zoals preferentiebeleid en marktwerking weinig effect sorteren op de prijzen van specialités, omdat zorgverzekeraars en apothekers geen sterke onderhandelingspositie vanwege het patent dat op deze geneesmiddelen berust. De WGP is het enige instrument om de prijzen van specialités te beheersen. In een tijd waarin de zorgkosten blijven groeien en mensen een steeds groter deel van hun inkomen aan zorgpremies moeten besteden is het volgens de indiener van belang alle instrumenten te gebruiken om de kosten van de zorg, inclusief geneesmiddelen, te beheersen en zo laag mogelijk te houden.
De Minister van VWS geeft voorts aan dat veel wordt verwacht van de overheveling van specialistische middelen naar het ziekenhuisbudget. De overheveling van dure geneesmiddelen naar het ziekenhuisbudget heeft diverse malen vertraging opgelopen. Bovendien staan niet alle geneesmiddelen waar dit initiatief betrekking op heeft op de rol om overgeheveld te worden naar het ziekenhuisbudget. Ook is het de vraag of met de nieuwe add-on bekostiging nog wel besparingen gehaald zullen worden door de specialistische middelen over te hevelen naar het ziekenhuisbudget. Inmiddels is immers een brief van de Minister aan de Kamer gezonden11. De Raad van State ging nog uit van de beleidsregel dure geneesmiddelen en laat de nieuwe add-on bekostiging hierbij nog buiten beschouwing. Tot 2012 was er een systeem met inzicht in de kosten van dure geneesmiddelen. Ziekenhuizen waren verplicht de netto-inkoopprijs van dure geneesmiddelen bij verzekeraars te declareren om extra budget te krijgen (beleidsregel dure geneesmiddelen). Kortingen werden aan verzekeraars doorberekend. Bovendien werden geneesmiddelen voor vergoeding beoordeeld door het CVZ.
De Minister van VWS kiest voor een bekostiging via add-on na een tweezijdig verzoek van veldpartijen. De NZa stelt hierbij dat er een potentieel risico is ten aanzien van de macro-betaalbaarheid, omdat het mogelijk is dat de nieuwe add-on maximum tarieven hoger zullen uitvallen dan de bestaande tarieven. De NZa acht de financiële risico’s echter gering onder meer vanwege de WGP voor beheersing van de uitgaven door de WGP-maximumprijs. Met dit initiatief wordt de gewenste nieuwe bekostiging van dure geneesmiddelen in het ziekenhuis juist verder aangescherpt, omdat de werking van de WGP gunstig is voor het beperken van het potentiële risico op hogere kosten.
De initiatiefnemer wil in dit verband wijzen op een artikel dat vorig jaar in het Pharmaceutisch weekblad verscheen. (3 oktober 2013, Pharmaceutisch Weekblad, Jaargang 148 Nr 40/41) over het effect van de WGP. Hierin staat dat door nieuwe wettelijke maximumprijzen per 1 oktober de prijzen van geneesmiddelen met bijna 2% daalden. Ten opzichte van oktober 2007 liggen de prijzen van geneesmiddelen inmiddels ruim 37% lager, hetgeen voor meer dan de helft het directe gevolg is van de prijzenwet.
In het genoemde artikel staat de volgende grafiek, die het effect van de WGP visualiseert:
Grafiek 1: Prijseffecten per jaar vastgesteld in oktober (2007 t/m 2013).
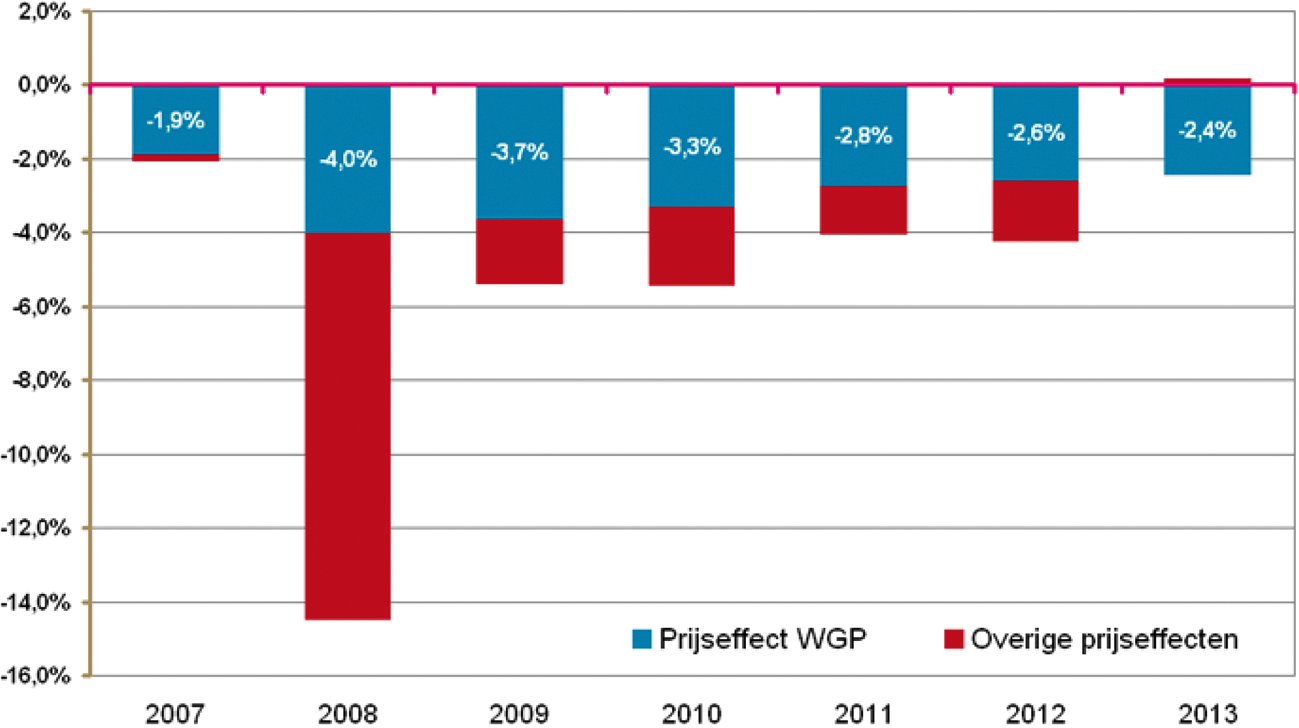
De helft van de prijsdalingen vanaf 2007 is het directe gevolg van de prijzenwet
Bron: Stichting Farmaceutische Kengetallen
Het effect van de WGP lijkt duidelijk. Door de WGP aan te scherpen zal dit effect alleen maar versterkt worden.
In zijn onderzoek wijst ConQuaestor er ook op dat de prijzen in Europa naar elkaar toe bewegen, doordat fabrikanten een Europees prijsbeleid voeren en landen elkaar als referentieland gebruiken bij de vaststelling van (maximum)prijzen. Fabrikanten houden bij het vaststellen van hun prijzen rekening met de doorwerking in de prijsreferentiesystemen in andere landen.12 Ook het Centraal Planbureau (hierna: CPB) verwacht dat de brutoprijzen van geneesmiddelen steeds meer zullen convergeren, omdat de prijsreferentiesystemen in de EU allemaal naar elkaars prijzen verwijzen. De farmaceutische industrie streeft daardoor ook meer naar dezelfde Europese brutoprijzen. Het CPB verwacht dat een aanpassing van de WGP op langere termijn weinig effect zal sorteren.13 Gelet op het voorgaande bestaat het risico dat het Noorse systeem slechts enkele jaren effect heeft.
De initiatiefnemer is van mening dat elk jaar waarin er winst te behalen valt ten gunste van de zorgpremiebetaler dit aangegrepen moet worden, ook al heeft dit een tijdelijk effect. Dat prijzen naar elkaar toe groeien, omdat er door fabrikanten een Europees prijsbeleid wordt gevoerd is volgens initiatiefnemer een beweging in de goede richting, maar onvoldoende. Hoe kan immers verklaard worden dat er een significant prijsverschil bestaat tussen diverse Europese landen? De initiatiefnemer plaatst ook de opmerkingen die het CPB maakt over convergentie van brutoprijzen in Europees verband in dit licht.
Het streven naar Europese brutoprijzen door de farmaceutische industrie kan volgens initiatiefnemer geen argument zijn om prijsbeheersingsmechanismen die werken niet verder aan te scherpen. Voorts kan initiatiefnemer zich niet voorstellen dat op de korte termijn er in Europees verband een dergelijk initiatief van de grond zal komen.
Op dit moment liggen de prijzen in Noorwegen 7.5% lager. De initiatiefnemer ziet geen enkele reden waarom Nederland niet dezelfde lagere prijzen zou kunnen hanteren.
De prijzen in de WGP zijn brutoprijzen, de prijzen die apotheken maximaal betalen voor de inkoop van geneesmiddelen. Uit het onderzoek van ConQuaestor blijkt dat ook in Nederland vaak wordt onderhandeld op basis van niet-openbare «nettoprijzen», die niet in de officiële prijslijsten voorkomen. De fabrikanten voorkomen hiermee dat een prijsdaling in een land dat vaak als referentieland wordt gebruikt doorwerkt in de (maximum)prijzen van andere landen.14
Zo heeft het Nederlandse preferentiebeleid tot gevolg dat verzekeraars veel lagere prijzen kunnen bedingen voor generieke geneesmiddelen dan de officiële prijzen. Het is dus heel goed mogelijk dat de officiële «brutoprijs» in de prijslijsten gelijk blijft of stijgt, terwijl in werkelijkheid veel lagere prijzen gelden.15 De Minister heeft hieruit geconcludeerd dat de te verwachten opbrengsten op basis van het Noorse systeem grotendeels papieren opbrengsten zullen zijn.16
Volgens de initiatiefnemer zal het Noorse systeem wel effecten hebben voor spécialités. Hij verwijst daartoe naar een onderzoek van de Boston Consulting Group, volgens welk de brutoprijs van een spécialité in 99% van de gevallen op de op grond van de WGP vastgestelde maximumprijs ligt.17 Dat betekent echter nog niet dat apotheken ook deze brutoprijs betalen.
De initiatiefnemer is zich ervan bewust dat praktijken zoals de Afdeling hierboven schetst voorkomen. Dat is dan ook precies de reden waarom de initiatiefnemer er niet in gelooft dat de farmaceutische industrie ooit zou streven naar Europese brutoprijzen. Ook is initiatiefnemer zich ervan bewust dat er een verschil bestaat tussen bruto en nettoprijzen. Bij specialités geldt echter dat de fabrikant nauwelijks een stimulans heeft om stevig te onderhandelen over een prijs omdat er vaak een patent berust op een dergelijk geneesmiddel. Voorts valt ook te betwijfelen of apotheken meer dan 7,5% korting kunnen krijgen op de brutoprijzen van specialités.
Het feit dat verzekeraars veel lagere prijzen kunnen bedingen voor generieke geneesmiddelen dan de officiële prijzen is zeker waar. Daardoor zijn enorme kostenbesparingen gerealiseerd. Dit geldt echter alleen voor generieke middelen, terwijl voorliggend wetsvoorstel juist beoogt een besparing op de prijzen van specialités te realiseren.
In het eerder genoemde artikel in het Pharmaceutisch Weekblad ((3 oktober 2013, Pharmaceutisch Weekblad, Jaargang 148 Nr 40/41) staat: «Op dit moment heeft de WGP een reikwijdte die 80% van de omzet aan receptgeneesmiddelen in de openbare apotheek betreft. Voor ongeveer driekwart van die omzet geldt dat het verschil tussen de inkoopprijs en de maximumprijs minder dan een procent bedraagt en dus dat de WGP daarmee een direct drukkend effect op de prijs uitoefent. Met inbegrip van prijsdaling in april van dit jaar zijn de prijzen onder invloed van de WGP in 2013 met 2,4% gedaald. Hiermee is het effect van de WGP in lijn met de daling van 2 tot 4% in de afgelopen jaren. Ten opzichte van oktober 2007 zijn de prijzen van geneesmiddelen inmiddels 37,5% lager. Hiervan is meer dan de helft het directe gevolg van de prijzenwet, die daarmee het belangrijkste prijsbeheersingsinstrument van de overheid is voor geneesmiddelen.»
De initiatiefnemer gaat ervan uit dat de invoering van het Noorse systeem niet tot minder beschikbaarheid van geneesmiddelen zal leiden. De Afdeling wijst op recent gepubliceerde antwoorden van de Minister van VWS naar aanleiding van een Rondetafelgesprek over de prijsbepaling van geneesmiddelen. Volgens dit verslag zijn er signalen dat in landen met lage prijzen nieuwe geneesmiddelen vertraagd beschikbaar komen.18 Verwezen wordt naar een rapport van het Instituut voor Verantwoord Medicijngebruik uit december 2012. In dit rapport wordt het systeem van referentieprijzen als mogelijke oorzaak genoemd voor tekorten aan geneesmiddelen.19
De Afdeling adviseert in de toelichting in het licht van bovenstaande punten op toereikende wijze de effectiviteit van het voorgestelde systeem, ook op langere termijn, nader te motiveren.
De initiatiefnemer kent het rapport van het IVM. Het rapport van het IVM is gebaseerd op literatuurstudie en op interviews met relevante partijen in Nederland. In het rapport worden alle factoren die invloed hebben op de beschikbaarheid van geneesmiddelen aangehaald. Er wordt echter niet aangegeven welke factoren in meer of mindere mate invloed hebben op het niet beschikbaar zijn van geneesmiddelen. Het systeem van referentieprijzen wordt zoals de Raad aangeeft als mogelijke oorzaak genoemd voor tekorten aan geneesmiddelen. Nergens wordt echter aangegeven dat dit de belangrijkste oorzaak is, integendeel, de oorzaken van geneesmiddelentekorten in Nederland zijn multifactorieel. Vooral het preferentiebeleid, betere samenwerking door stakeholders en uitbreiding van bestaande informatiesystemen werden genoemd als verbeterpunten. In het rapport wordt gewezen op het feit dat bij het oplossen van geneesmiddelentekorten ermee rekening gehouden moet worden dat de meeste producenten multinationals zijn, de productie plaatsvindt in het buitenland en beslissingen worden genomen op buitenlandse hoofdkantoren. Het rapport stelt vervolgens: «het zal dan ook moeilijk zijn om op Nederlands en zelfs EU niveau invloed te hebben op productie-investeringen, productiebeslissingen en economisch getinte beslissingen van het management.»
Voor verbetering van de beschikbaarheid van geneesmiddelen op de korte termijn is volgens het IVM verbetering van de samenwerking tussen stakeholders nodig en het verbeteren van de registratie van tekorten en het opzetten van een database met oplossingen voor tekorten. Het lijkt voor de hand te liggen dat met een betere samenwerking ook op langere termijn de beschikbaarheid van geneesmiddelen beter gehandhaafd kan worden. De initiatiefnemer constateert tot zijn spijt dat in landen met lage prijzen geneesmiddelen door de farmaceutische industrie niet op de markt gebracht worden. Veel burgers in landen op het Afrikaanse continent leiden hieronder. In West-Europa is het prijsniveau, ook nadat de wijziging zoals initiatiefnemer die wenst, nog steeds interessant genoeg waardoor de West-Europese afzetmarkt interessant zal blijven. De initiatiefnemer is geenszins in de veronderstelling dat de voorgestelde wijziging van de WGP substantieel de beschikbaarheid van geneesmiddelen in Nederland zal beïnvloeden. De initiatiefnemer heeft geen enkel signaal ontvangen dat in Noorwegen sprake is van een verminderde beschikbaarheid van geneesmiddelen.
In dit verband wijst de initiatiefnemer ook op recente ontwikkelingen in Duitsland. De Bundestag heeft ingestemd met een aantal stevige wijzigingen in de Duitse wet die gaat
over geneesmiddelenprijzen. Door de wijzigingen kunnen het Europese en het Nederlandse
prijspeil dalen. In de huidige berekeningswijze, waarbij de maximumprijs is gebaseerd op een gemiddelde van de vier ons omringende landen, zal het effect van de Duitse prijsdaling gering zijn. Wanneer het gemiddelde van de drie laagste prijzen wordt gebruikt zal Nederland wél van de Duitse prijsverlaging kunnen profiteren. De initiatiefnemer wijst er op dat Duitsland met deze krachtige maatregel waarbij openbare lagere prijzen worden gehanteerd, in het geheel niet bang is dat de beschikbaarheid van geneesmiddelen in gevaar gebracht zal worden.
In het huidige stelsel worden de prijzen in vier landen gebruikt voor de vaststelling van de maximumprijs. De prijzen in één land, het Verenigd Koninkrijk, moeten daarbij worden omgerekend in euro’s. Het initiatiefvoorstel leidt ertoe dat de prijzen voor tien landen moeten worden vastgesteld, en voor vier landen, Denemarken, Noorwegen, het Verenigd Koninkrijk en Zweden, moeten worden omgerekend in euro’s. Per geneesmiddel dienen de goedkoopste drie landen te worden bepaald.
De vaststelling heeft overigens niet alleen betrekking op de omrekening van de prijzen van geneesmiddelen. Ook moet worden vastgesteld welke geneesmiddelen onderling vergelijkbaar zijn, en moet rekening worden gehouden met het aantal eenheden per verpakking.20
De toelichting biedt geen inzicht in de verwachte extra uitvoeringskosten door de uitbreiding van vier naar tien landen. De initiatiefnemer merkt alleen op dat voldoende ervaring is opgedaan met de uitvoering van de WGP, en dat er van meer landen prijslijsten moeten worden opgevraagd.21
Voorts moet de Minister thans op grond van artikel 3, eerste lid, van de WGP, ten minste twee maal per jaar onderzoeken of er aanleiding is een vastgestelde maximumprijs te wijzigen. In de memorie van toelichting wordt erop gewezen dat in Noorwegen de prijzen één keer per jaar worden vastgesteld, en nieuwe geneesmiddelen de eerste twee jaar uitgezonderd zijn van herberekening.22 Uit de toelichting blijkt niet of de initiatiefnemer overwogen heeft de WGP op dit onderdeel aan te passen.
De Afdeling adviseert in de toelichting in te gaan op de uitvoeringskosten van de voorgestelde wijziging, alsmede de kosten en baten van wijziging van het systeem tegen elkaar af te wegen en zo nodig het voorstel aan te passen.
De initiatiefnemer dankt de Afdeling voor de opmerkingen die zij heeft gemaakt over de uitvoeringskosten van de voorgestelde wijziging. Het is immers van belang dat een voorgestelde wijziging niet meer mag kosten dan het oplevert. Inmiddels is door Farmatec veel ervaring opgedaan met de WGP en is de kennisinfrastructuur om de wijziging op een efficiënte wijze door te voeren aanwezig. Farmatec doorloopt nu de volgende stappen om de maximale prijs voor een geneesmiddel te bepalen.
1. Voor ieder referentieland worden de vergelijkbare geneesmiddelen in een productgroep ingedeeld.
2. Per land wordt op basis van de merkstamnaam van het desbetreffende vergelijkbare geneesmiddel de verpakkingsgrootte(n) met de laagste prijs per eenheid product geselecteerd. Als de geselecteerde verpakkingsgrootte(n) van dat geneesmiddel een aantal malen in de prijslijst staat, wordt/worden de gemiddelde prijs/prijzen van deze verpakkingsgrootte(n) in de berekening betrokken.
3. Per land worden de prijzen van de geselecteerde verpakkingen gemiddeld.
4. Indien nodig wordt de gemiddelde prijs omgerekend in euro’s. Bij de omrekening naar euro’s wordt uitgegaan van de middenkoers die geldt op de datum waarop de als uitgangspunt genomen prijslijst is uitgegeven.
5. De maximumprijs wordt vastgesteld op het rekenkundig gemiddelde van de (omgerekende) gemiddelden van de referentielanden.
Met de voorgestelde wijziging verandert de hierboven geschetste werkwijze niet. Wat de wijziging wel voorstelt is dat in plaats van dat deze exercitie wordt toegepast op 4 landen dat gaat gebeuren op 10 landen. Met de infrastructuur van Farmatec, de technologie die aanwezig is en de ervaring die al is opgedaan is het niet te verwachten dat de uitvoeringskosten voor de berekening waarin voortaan alleen zes extra landen meegenomen worden, tot veel hogere uitvoeringskosten zal leiden. De initiatiefnemer kan zich niet voorstellen dat het omrekenen van de valuta van Denemarken, Noorwegen en Zweden tot hogere uitvoeringskosten leidt.
Voorts vraagt de Afdeling of is overwogen om tevens volgens het Noorse model de prijzen 1 keer per jaar aan te passen en nieuwe geneesmiddelen de eerste twee jaar uit te zonderen van herberekening. Volgens de huidige WGP vindt er twee maal per jaar onderzoek plaats of er aanleiding is om de prijzen aan te passen, terwijl in Noorwegen één maal per jaar aanpassing plaatsvindt. Zo lang een aanzienlijke kostenbesparing door maar één keer per jaar prijzen aan te passen, niet aan de orde is wordt er voor gekozen bij de huidige WGP werkwijze aan te sluiten. Voorts vindt de initiatiefnemer vrijstelling in de eerste twee jaar nadat een nieuwe geneesmiddel op de markt is geen goed voorstel, omdat ook voor nieuwe geneesmiddelen geldt dat deze voor redelijke tarieven beschikbaar moeten zijn.
In de toelichting wordt niet ingegaan op de verhouding van het initiatiefvoorstel tot het Europese recht. Alleen bij de keuzecriteria voor de zes nieuwe referentielanden wordt rekening gehouden met de bevolkingsomvang, alsmede met de productie en consumptie van geneesmiddelen ten opzichte van de EU als geheel.23 Ook wordt verwezen naar de vraag die in een aantal lidstaten van de EU speelt met betrekking tot de mogelijkheid om beperkingen te stellen aan de parallelexport van geneesmiddelen.24 De vraag naar de verhouding tot het unierecht als zodanig komt echter niet aan de orde.
Hoewel naar het oordeel van de Afdeling op dit punt, gelet op de rechtspraak van het Hof van Justitie25 en van de Afdeling bestuursrechtspraak van de Raad van State,26 niet op voorhand problemen te verwachten zijn, is het wel nodig op de voorgestelde maatregelen in het licht van het unierecht in te gaan. De Afdeling wijst er daarbij op dat de wijziging van de WGP mogelijk kan worden aangemerkt als een wijziging van een nationale norm in de zin van Richtlijn 98/34/EG.27 Zekerheidshalve zal te gelegener tijd de wijziging van de WGP moeten worden aangemeld bij de Europese Commissie ter notificatie. De Afdeling brengt voorts het volgende naar voren.
Ten eerste is Richtlijn 89/105/EEG (hierna: de transparantierichtlijn) van belang. Deze bevat een unierechtelijk kader voor de prijsstelling van geneesmiddelen voor menselijk gebruik.28 De richtlijn is omgezet in de WGP.
In de considerans bij de transparantierichtlijn worden de kaders geschetst waarbinnen de lidstaten (prijs)maatregelen kunnen nemen om de uitgaven voor geneesmiddelen in de sector gezondheidszorg in de hand te houden.29
De hoofddoelstelling van dergelijke maatregelen dient de bevordering van de volksgezondheid te zijn door de beschikbaarheid van voldoende geneesmiddelen tegen redelijke prijzen te waarborgen. Tegelijkertijd moeten dergelijke maatregelen ook een efficiënte geneesmiddelenproductie bevorderen, alsmede onderzoek naar en de ontwikkeling van nieuwe geneesmiddelen. Dergelijke maatregelen mogen echter niet het intracommunautaire handelsverkeer belemmeren of verstoren en daardoor de werking van de gemeenschappelijke geneesmiddelenmarkt rechtstreeks beïnvloeden. De richtlijn heeft mede tot doel te waarborgen dat nationale maatregelen geen kwantitatieve beperkingen van in- of uitvoer of maatregelen van gelijke werking vormen.
De Afdeling adviseert in de toelichting aan de Transparantierichtlijn aandacht te besteden.
De initiatiefnemer is van mening, net als de Raad van State dat niet op voorhand problemen te verwachten zijn. Te gelegener tijd zal de gewijzigde WGP inderdaad moeten worden aangemeld bij de Europese Commissie ter notificatie. De initiatiefnemer is het hartgrondig eens met de hoofddoelstellingen van de Transparantierichtlijn, namelijk het waarborgen van voldoende geneesmiddelen tegen redelijke prijzen, het bevorderen van een efficiënte geneesmiddelenproductie en onderzoek naar en de ontwikkeling van nieuwe geneesmiddelen. De wijziging zoals voorgesteld door de initiatiefnemer is in lijn met de Transparantierichtlijn, sterker nog is ingegeven door de Transparantierichtlijn omdat er gestreefd wordt naar redelijke prijzen en goede beschikbaarheid van geneesmiddelen. De wijziging heeft verder geen directe invloed op productie, onderzoek en ontwikkeling. Voorts veronderstelt initiatiefnemer dat er door de voorgestelde wijziging geen sprake zal zijn van een extra belemmering of verstoring van het intracommunautaire handelsverkeer. Met de voorgestelde wijziging is er geen sprake van beperking van in-of uitvoer.
De initiatiefnemer wijst er ten overvloede op dat de voorgestelde wetswijziging niet een geheel nieuw systeem wil introduceren voor nieuwe prijsmaatregelen om de uitgaven voor geneesmiddelen in de hand te houden. Het gaat om een bestaande wet, die derhalve niet in strijd is met Europese wetgeving en waarbij alleen de technische berekening wordt aangepast. De doelstelling van de wet en het feit dat bij wet een maximumprijs wordt gesteld voor een geneesmiddel verandert niet.
Van belang zijn verder de regels inzake het vrij verkeer van goederen. Volgens artikel 34 van het Verdrag betreffende de werking van de Europese Unie (hierna: VWEU) zijn alle kwantitatieve invoerbeperkingen tussen de lidstaten verboden. Ingevolge artikel 36 VWEU kunnen verboden of beperkingen, onder meer ter bescherming van de gezondheid van personen gerechtvaardigd worden.
Zo een maatregel mag echter geen middel tot willekeurige discriminatie of beperking van de handel tussen de lidstaten vormen. In een zaak die betrekking had op Belgische maximumprijzen voor geneesmiddelen oordeelde het Hof dat prijsmaatregelen zonder onderscheid in beginsel geen maatregelen van gelijke werking zijn als een verboden kwantitatieve beperking van het vrij verkeer van goederen. Dit is anders indien de prijzen op een zo laag niveau liggen, dat de afzet van de ingevoerde producten onmogelijk is of meer bemoeilijkt wordt dan de afzet van binnenlandse producten. In dat geval wordt het vrije verkeer dermate belemmerd dat gesproken kan worden van een maatregel van gelijke werking. Van een dergelijke belemmering is sprake indien de ingevoerde producten niet met redelijke winst op de markt kunnen worden afgezet.30
De Afdeling adviseert de voorgestelde maatregelen te beoordelen in het licht van het geldende unierecht en de toelichting met een dergelijke beoordeling aan te vullen.
De initiatiefnemer oordeelt dat voorgestelde wijziging niet leidt tot een inbreuk op de regels voor het vrij verkeer van goederen. Door de voorgestelde wijziging is geen sprake van een extreem laag prijsniveau zodat fabrikanten van geneesmiddelen hun producten nog steeds tegen redelijke winstmarges kunnen afzetten op de Nederlandse markt.
De initiatiefnemer wijst er op dat Noorwegen wel deel uitmaakt van de Europese Economische Ruimte (EER). Het akkoord bevordert vrij verkeer van personen, goederen, diensten en kapitaal tussen de deelnemende landen. Ook wordt er samengewerkt op economisch gebied. De Noorse berekening van de geneesmiddelenprijzen wordt kennelijk niet als een belemmering voor het vrij verkeer van personen, goederen, diensten en kapitaal gezien.
Op 1 maart 2012 heeft de Europese Commissie een voorstel gepubliceerd voor een richtlijn die de transparantierichtlijn moet vervangen (hierna: de ontwerprichtlijn).31 De ontwerprichtlijn heeft tot doel om de richtlijn aan te passen aan de huidige farmaceutische situatie, terwijl de grondslagen ervan bewaard blijven.
De Minister van VWS heeft in de brief van 31 mei 2013 gewezen op de discussie in de EU over het systeem van «Differential Pricing» in Europa. In dit systeem worden dure specialistische geneesmiddelen in lidstaten met een laag welvaartsniveau voor een lagere prijs aangeboden dan in lidstaten met een hoog welvaartsniveau. Invoering van dit systeem kan leiden tot een beperking van de prijsreferentiesystemen die thans in Europa worden gebruikt.32
De Afdeling adviseert in de toelichting in te gaan op de verhouding van deze herziening tot het voorstel.
De grondslagen van de Transparantierichtlijn blijven gelijk. Het ligt niet in de verwachting dat de uitwerking in prijsreferentiesystemen geharmoniseerd zal worden.
Een eventuele herziening is volgens de initiatiefnemer geen aanleiding om nu een mogelijkheid tot kostenbesparing onbenut te laten.
De memorie van toelichting is aangevuld op de door de Raad genoemde punten. Een nieuwe paragraaf 6 is toegevoegd betreffende Unierechtelijke aspecten.
Een gewijzigde memorie van toelichting is bijgevoegd.
De Vice-President van de Raad van State,
J.P.H. Donner
Kuzu
ConQuaestor, «Onderzoek Wet geneesmiddelenprijzen. Prijsbeheersing van geneesmiddelen in Nederland», (2012), blz. 43.
Zie de brief van de Minister van VWS van 17 mei 2013 over de invoering van DBCs, Kamerstukken II 2012/13, 29 248, nr. 250, blz. 3–4 en de memorie van toelichting, blz. 12.
http://www.rijksoverheid.nl/onderwerpen/geneesmiddelen/betaalbaar-houden-van-geneesmiddelen.
Centraal Planbureau 3 juli 2012, «Aanvullende informatie voor de doorrekening van de verkiezingsprogramma’s» blz. 11. Het is niet duidelijk wat het CPB onder «langere termijn» verstaat.
The Boston Consulting Group «Prijsliberalisering in de farmaceutische zorg. Een impactanalyse» (2011), appendix.
Brief van de Minister van VWS aan de Tweede Kamer der Staten-Generaal van 6 september 2013, 135655–107512-GMT, blz. 5.
Uit onderzoek van het Noorse Ministerie van Volksgezondheid uit 2008 bleek dat het aantal eenheden per verpakking medicijnen sterk verschilt. In Oostenrijk bevat een verpakking gemiddeld 35 eenheden, in Zweden 64. Zie SNF report no. 05/08, «Are pharmaceuticals inexpensive in Norway?», blz. 18–19.
HvJ EG 19 maart 1991, C-249/88, (Commissie-België), r.o. 15 en 17. Zie ook zaak C-565/08, HvJ EU 29 maart 2011, (Commissie-Italië), r.o. 53, waar het Hof zijn standpunt over maximumprijzen bevestigde. Zie ook HvJ EU 7 maart 2013, C-577/11 (DKV Belgium NV), r.o. 43–46.
Richtlijn 98/34/EG van het Europees parlement en de Raad van 22 juni 1998 betreffende een informatieprocedure op het gebied van normen en technische voorschriften Pb EU 1998, L 204.
Richtlijn 89/105/EEG van de Raad van 21 december 1988 betreffende de doorzichtigheid van maatregelen ter regeling van de prijsstelling van geneesmiddelen voor menselijk gebruik en de opneming daarvan in de nationale stelsels van gezondheidszorg (Pb EG 1989, L 40).
Voorstel voor een richtlijn van het Europees parlement en de Raad betreffende de transparantie van maatregelen ter regeling van de prijsstelling van geneesmiddelen voor menselijk gebruik en de opneming daarvan in de openbare stelsels van gezondheidszorg, COM(2012) 84 final, 2012/0035 (COD).
Zie de brief van de Minister van VWS van 31 mei 2013, Kamerstukken II 2012/13, 29 477, nr. 245, blz. 5.
Kopieer de link naar uw clipboard
https://zoek.officielebekendmakingen.nl/kst-33703-4.html
De hier aangeboden pdf-bestanden van het Staatsblad, Staatscourant, Tractatenblad, provinciaal blad, gemeenteblad, waterschapsblad en blad gemeenschappelijke regeling vormen de formele bekendmakingen in de zin van de Bekendmakingswet en de Rijkswet goedkeuring en bekendmaking verdragen voor zover ze na 1 juli 2009 zijn uitgegeven. Voor pdf-publicaties van vóór deze datum geldt dat alleen de in papieren vorm uitgegeven bladen formele status hebben; de hier aangeboden elektronische versies daarvan worden bij wijze van service aangeboden.
